台州市仙居中学2006年高一化学期中考试卷[上学期]
文档属性
| 名称 | 台州市仙居中学2006年高一化学期中考试卷[上学期] |  | |
| 格式 | rar | ||
| 文件大小 | 105.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2008-07-07 08:33:00 | ||
图片预览



文档简介
台州 仙居中学 2006年高一化学期中考试卷
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分100分。考试时间90分钟。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 AI-27 P-31 S-32 Cl-35.5 K-39 Ca-40 Cu-64
第Ⅰ卷(选择题 共50分)
一、选择题(本题包括25小题,每小题2分,共分。每小题只有一个选项符合题意)
1、下列物质属于纯净物的是 ( )
A.液氯 B.漂白粉 C.氯水 D.盐酸
2、我国的“神州六号”载人飞船已发射成功,“嫦娥”探月工程已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以42He的形式存在。下列说法正确的是
( )
A.42He原子核内含有4个质子
B.32He和42He互为同位素
C.32He原子核内含有3个中子
D.42He的最外层电子数为2,所以42He具有较强的金属性
3、氧化还原反应的实质是 ( )
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
4、下列基本反应类型中,一定是氧化还原反应的是 ( )
A.复分解反应 B.置换反应
C.分解反应 D.化合反应
5、物质的量单位——摩尔的基准是 ( )
A、6.02×1023这个常数 B、0.012kg的碳
C、1摩尔任何物质所含的微粒数 D、0.012kg的12C所含有的原子数
6、“纳米材料”是当今材料科学研究的前沿,1纳米(nm)=10-9m,其研究成果广泛应用于催化及军事科学中。“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料,
如将“纳米材料”分散到液体分散剂中,所得混合物可能具有的性质是 ( )
A.有丁达尔效应 (光亮的通路) B.能全部透过半透膜
C.不能透过滤纸 D.所得分散系不稳定
7、下列物质属于非电解质的是 ( )
A.醋酸 B.硫酸钡 C.石墨 D.二氧化碳
8、下列有关原子的说法正确的是: ①原子是化学变化中的最小微粒;②原子不能再分;③原子在化学变化中不能再分;④原子在化学变化中 不发生变化;⑤原子核在化学变化中不发生变化。 ( )
A.①②③ B.①③④ C.①②⑤ D.①③⑤.
9、与氩原子具有相同电子层结构的微粒是: ( )
A、Na+ B、Cl- C 、Cl D、 Ne
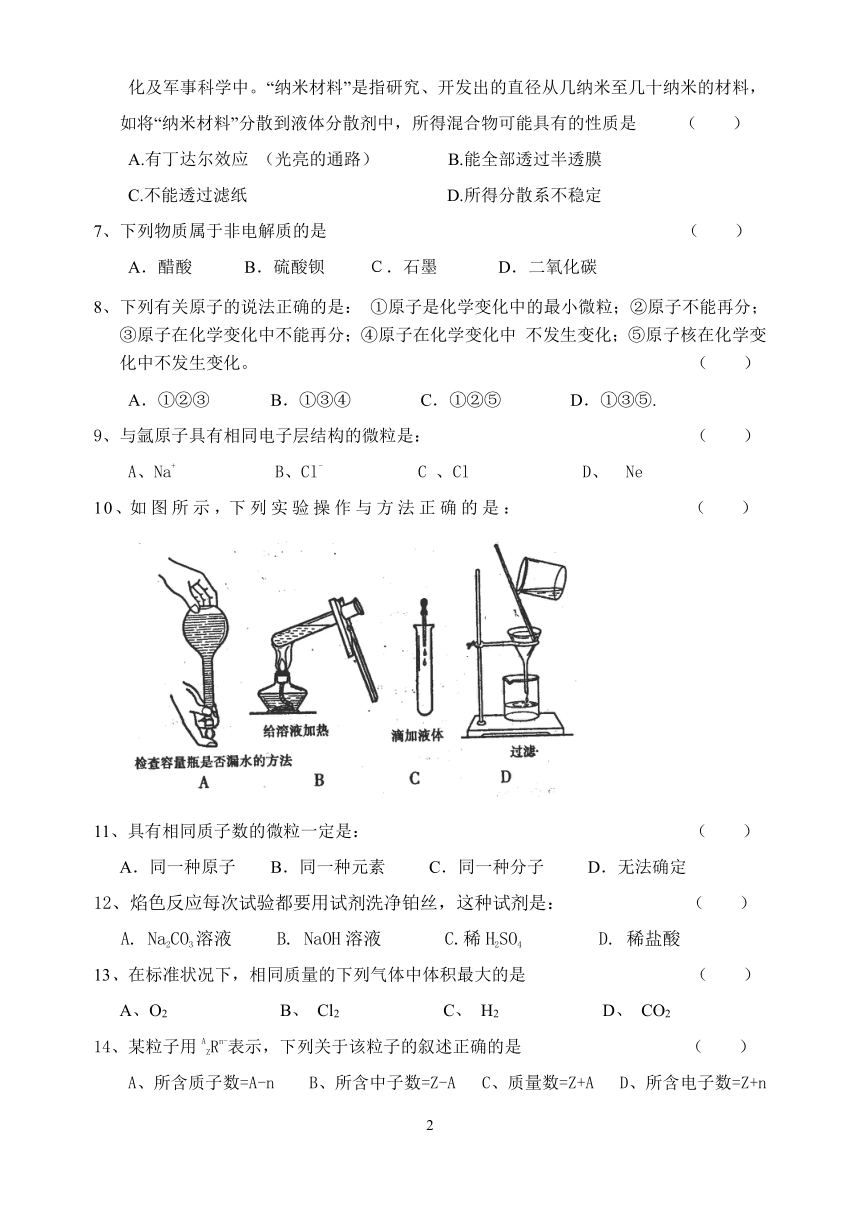
10、如图所示,下列实验操作与方法正确的是: ( )
11、具有相同质子数的微粒一定是: ( )
A.同一种原子 B.同一种元素 C.同一种分子 D.无法确定
12、焰色反应每次试验都要用试剂洗净铂丝,这种试剂是: ( )
A. Na2CO3溶液 B. NaOH溶液 C.稀H2SO4 D. 稀盐酸
13、在标准状况下,相同质量的下列气体中体积最大的是 ( )
A、O2 B、 Cl2 C、 H2 D、 CO2
14、某粒子用AZRn-表示,下列关于该粒子的叙述正确的是 ( )
A、所含质子数=A-n B、所含中子数=Z-A C、质量数=Z+A D、所含电子数=Z+n
15、分类是日常生活、化学学习和科学研究中经常用到的一种方法。下列化学物质的分类正确的是 ( )
A.碳酸钠、碳酸钾、碳酸钙、碳酸氢钙都属于可溶性的碳酸盐
?? B.二氧化硫、五氧化二磷、乙醇、乙酸都属于氧化物
? ? C.氢氧化钠、氢氧化钡、氢氧化钾、氨水都属于一元强碱
?? D. 盐酸、硝酸、氢氟酸(HF)、乙酸都属于一元酸
16、制备硅单质时,先从氧化物提取得到粗硅,再提纯为纯硅,主要化学反应如下:
⑴SiO2 + 2CSi + 2CO ⑵Si(粗) + 2Cl2SiCl4
⑶SiCl4 + 2H 2Si(纯) + 4HCl
对上述三个反应叙述中,不正确的是 ( )
A.⑴⑶为置换反应 B.⑴⑵⑶均为氧化还原反应
C.⑵为化合反应 D.三个反应中硅元素均被还原
17、下列溶液中的Cl(浓度与50 mL 1 mol ·L-1 MgCl2溶液中的Cl(浓度相等的是( )
A. 150 mL 1 mol·L-1 NaCl溶液
B. 75 mL 1 mol·L-1 CaCl2溶液
C. 100 mL 1 mol·L-1 KCl溶液
D. 75 mL 1 mol ·L-1 AlCl3溶液
18、在某化学反应中,铜离子得到2.408×1023 个电子,则可得到铜单质: ( )
A.25.6g B.32g C.12.8g D.38.4g
19、除去食盐溶液中的Ca2+、Mg2+、SO42-等杂质,需加入NaOH、Na2CO3、BaCl2和盐酸,加入顺序正确的是 ( )
A、NaOH、Na2CO3、BaCl2、HCl B、Na2CO3、BaCl2、HCl、NaOH
C、BaCl2、HCl、NaOH、Na2CO3 D、NaOH、BaCl2、Na2CO3、HCl
20、实验室制取氯气可以有以下途径,用化学方程式表示如下。若制取等质量的氯气,消耗盐酸最少的是 ( )
A、14HCl + K2Cr2O7 == 2KCl+2CrCl3+7H2O+3Cl2↑
B、16HCl + 2KMnO4 == 2MnCl2+8H2O+2KCl+5Cl2↑
C、4HCl + MnO2 △ MnCl2+2H2O+Cl2↑
D、6HCl + KClO3 == KCl+3H2O+3Cl2↑
21、下列电离方程式错误的是 ( )
A、KNO3 = K+ + NO3- B、NaHSO4 = Na+ + H+ + SO42-
C、BaCl2 = Ba2+ + Cl2- D、Na2SO4 = 2Na+ + SO42-
22、NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.2.3g钠由原子变成离子时,失去的电子数为NA
B.0.2NA个硫酸分子与19.6g磷酸(H3PO4)含有相同的氧原子数
C.28g氮气所含有的原子数为NA
D.NA个氧分子与NA个氢分子的质量比为8:1
23、向下列各物质的水溶液中滴加稀H2SO4或MgCl2溶液时,均有白色沉淀生成的是( )
A.BaCl2 B.Ba(OH)2
C.Na2CO3 D.KOH
24、痕检是公安机关提取犯罪嫌疑人指纹的一种重要的方法,AgNO3显现法就是其中的一种:人的手上有汗渍,用手动过白纸后,手指纹线就留在纸上。如果将溶液①小心地涂到纸上,溶液①中的溶质就跟汗渍中的物质②作用,生成物质③,物质③在光照下,分解出的银粒呈灰褐色,随着反应的进行,银粒逐渐增多,由灰褐色变成黑色的指纹线。用下列化学式表示这3种物质都正确的是 ( )
A、①AgNO3 ②NaBr ③AgBr
B、①AgNO3 ②NaCl ③AgCl
C、①AgCl ②AgNO3 ③NaCl
D、①AgNO3 ②NaI ③AgI
25、如图所示装配仪器,接通直流电源,电解饱和食盐水,则电解一段时间后,在碳棒和铁钉表面都有气体生成,其中碳棒表面生成的气体是 ( )
A、Cl2 B、O2
C、H2 D、HCl
第II卷(非选择题 共50分)
二、填空题(本题共有3个小题,共18分。把答案填在题中横线上。)
26、(6分) 用双线桥或单线桥标出下列两个氧化还原反应电子转移的方向和数目
① 2 KI ﹢ CI2 = 2 KCI ﹢ I2
②MnO2 ﹢ 4 HCI = MnCI2 ﹢ CI2 ﹢ 2 H2O
在该反应中氧化剂是 ,还原剂是
27、(5分)新制氯水中含有多种成分,其中分子有:CI2 、HCIO 、H2O,离子有H+、CIˉ、CIOˉ等,回答下列问题:(填写分子或离子符号)
(1)氯水应存放在 试剂瓶中密封保存。
(2)将紫色石蕊试液滴入氯水中,溶液显红色,起作用的成分是 ;过一会儿,溶液的颜色逐渐褪去,起作用的成分是 ;
(3)往氯水中滴入硝酸银溶液,产生白色沉淀,起作用的成分是 ;
(4)氯水能使淀粉碘化钾试纸变蓝,起作用的成分是 。
28、 (7分) 有一固体混合物,可能由Na 2 CO 3 、CaCO 3 、Na 2 SO 4 、CuSO 4 、CaCl 2 、NaCl等混合组成。为检验它们,做了以下实验:
⑴ 将固体混合物溶于水,搅拌后的无色透明溶液;
⑵ 往此溶液中滴加硝酸钡溶液,有白色沉淀生成;
⑶ 过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。
试判断:固体混合物中肯定有 ,肯定没有 ,可能有 ;对可能有的物质,可采取用向滤液中滴加 溶液的方法来检验。
三、实验题(本题共有2个小题,共14分。)
29、(6分)将混合气体通过某溶液时,其中一种气体被吸收,另一种气体通过,从而分离开来的方法叫洗气。对于混合物的分离或提纯,常采用的方法有:A.过滤、B.蒸发、C.蒸馏、D.萃取、E.洗气、F.加热分解等。下列各组混和物的分离或提纯应采用什么方法?(填写操作代号)
① 实验室中的石灰水久置,液面上常悬浮有CaCO3微粒。可用 的方法除去Ca(OH)2溶液中悬浮的CaCO3微粒。
② 除去H2中的CO2,可用 的方法除去。
③ 除去乙醇中溶解的微量食盐可采用 的方法。
④ 粗盐中含有不溶性的泥沙、可溶性的氯化钙、氯化镁及一些硫酸盐。要将粗盐提纯,可先将粗盐溶解,按一定的顺序加入沉淀剂,再 ;然后将溶液调成中性并__ _ ___就可以得到较为纯净的氯化钠晶体。
⑤ 除去氧化钙中的碳酸钙可用 的方法。
30、(8分)现用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL、0.2
mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙。请回答下列问题:
(1) 上述仪器中,在配制稀H2SO4时用不到的有 (填代号)。
(2) 经计算,需浓H2SO4的体积为 ml(保留1位小数)。
现有①10 mL ②50 mL ③100 mL三种规格的量筒,你选用的 (填代号) 。
(3) 将浓H2SO4用适量蒸馏水稀释后,冷却片刻,随后全部转移到 mL的
容量瓶中,转移时应用玻璃棒 。转移完毕,用少量蒸馏水洗涤
2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀。然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度1 cm ~ 2 cm处。 改用 滴加蒸馏水到瓶颈刻度的地方,使溶液的凹面正好跟刻度相平。振荡、摇匀后,装瓶、贴签。
(4) 在配制过程中,其他操作都准确,下列操作中,能引起误差偏高的有 (填代号)。
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
四、计算题(本题共有2个小题,共18分)
31、(9分)10克碳酸钙与足量的盐酸完全反应,最多可收集到多少体积(标准状况下)的二氧化碳?
32、(9分)常温下,将20.0克14.0%的NaCl溶液,跟30.0克24.0%的NaCl 溶液混合,得到密度为1.15 g/cm3的混合溶液。
问:(1)该混合溶液的质量分数为多少?
(2)物质的量浓度为多少?
(3)在1000ml水中需溶入多少克NaCl才能使浓度恰与上述混合溶液的浓度相等。
仙居中学2006~2007学年第一学期期中考试
高一化学答题卷
一、选择题(本题包括25小题,每小题2分,共50分。每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
A
B
C
B
D
A
D
D
B
A
D
D
C
题号
14
15
16
17
18
19
20
21
22
23
24
25
答案
D
D
D
B
C
D
D
C
B
B
B
A
二、填空题(本题共有3个小题,共18分。把答案填在题中横线上。)
26、(6分) 用双线桥或单线桥标出下列两个氧化还原反应电子转移的方向和数目
① 2 KI ﹢ CI2 = 2 KCI ﹢ I2
②MnO2 ﹢ 4 HCI = MnCI2 ﹢ CI2 ﹢ 2 H2O
在②反应中氧化剂是MnO2 ,还原剂是HCI
27、(5分)(填写分子或离子符号)(1)棕色(2)H+ 、HCIO
(3)CIˉ (4)CI2
28、(7分) 固体混合物中肯定有Na 2 CO 3 ,肯定没有CaCO 3 、Na 2 SO 4 、CuSO 4 、CaCl 2,可能有NaCl ;对可能有的物质,可采取用向滤液中滴加 硝酸酸化AgNO3 溶液的方法来检验。
三、实验题(本题共有2个小题,共14分。
29、(6分)(填写操作代号)① A ② E ③ C ④ A 、 B ⑤ F
30、(8分)(1)不用仪器 ②⑦⑧ (填代号)
(2) 需浓H2SO4的体积为 5.4 ml (保留1位小数) ,量筒规格 ① (填代号)。
(3) 选 500 mL容量瓶 ,玻璃棒作用 引流 , 洗涤 烧杯 2~3次,改用 胶头滴管 滴加蒸馏水。
(4) 配制过程中,其他操作都准确,下列操作能引起误差偏高的有①②⑦ (填代号)。
四、计算题(本题共有2个小题,共18分)
31、(9分)10克碳酸钙与足量的盐酸完全反应,最多可收集到多少体积(标准状况下)的二氧化碳?(2.24L)
32、(9分)常温下,将20.0克14.0%的NaCl溶液,跟30.0克24.0%的NaCl 溶液混合,得到密度为1.15 g/cm3的混合溶液。
问:(1)该混合溶液的质量分数为多少?(20.0%)
(2)物质的量浓度为多少? (3.93mol/L)
(3)在1000ml水中需溶入多少克NaCl才能使浓度恰与上述混合溶液的浓度相等。
(250g)
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分100分。考试时间90分钟。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 AI-27 P-31 S-32 Cl-35.5 K-39 Ca-40 Cu-64
第Ⅰ卷(选择题 共50分)
一、选择题(本题包括25小题,每小题2分,共分。每小题只有一个选项符合题意)
1、下列物质属于纯净物的是 ( )
A.液氯 B.漂白粉 C.氯水 D.盐酸
2、我国的“神州六号”载人飞船已发射成功,“嫦娥”探月工程已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以42He的形式存在。下列说法正确的是
( )
A.42He原子核内含有4个质子
B.32He和42He互为同位素
C.32He原子核内含有3个中子
D.42He的最外层电子数为2,所以42He具有较强的金属性
3、氧化还原反应的实质是 ( )
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
4、下列基本反应类型中,一定是氧化还原反应的是 ( )
A.复分解反应 B.置换反应
C.分解反应 D.化合反应
5、物质的量单位——摩尔的基准是 ( )
A、6.02×1023这个常数 B、0.012kg的碳
C、1摩尔任何物质所含的微粒数 D、0.012kg的12C所含有的原子数
6、“纳米材料”是当今材料科学研究的前沿,1纳米(nm)=10-9m,其研究成果广泛应用于催化及军事科学中。“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料,
如将“纳米材料”分散到液体分散剂中,所得混合物可能具有的性质是 ( )
A.有丁达尔效应 (光亮的通路) B.能全部透过半透膜
C.不能透过滤纸 D.所得分散系不稳定
7、下列物质属于非电解质的是 ( )
A.醋酸 B.硫酸钡 C.石墨 D.二氧化碳
8、下列有关原子的说法正确的是: ①原子是化学变化中的最小微粒;②原子不能再分;③原子在化学变化中不能再分;④原子在化学变化中 不发生变化;⑤原子核在化学变化中不发生变化。 ( )
A.①②③ B.①③④ C.①②⑤ D.①③⑤.
9、与氩原子具有相同电子层结构的微粒是: ( )
A、Na+ B、Cl- C 、Cl D、 Ne
10、如图所示,下列实验操作与方法正确的是: ( )
11、具有相同质子数的微粒一定是: ( )
A.同一种原子 B.同一种元素 C.同一种分子 D.无法确定
12、焰色反应每次试验都要用试剂洗净铂丝,这种试剂是: ( )
A. Na2CO3溶液 B. NaOH溶液 C.稀H2SO4 D. 稀盐酸
13、在标准状况下,相同质量的下列气体中体积最大的是 ( )
A、O2 B、 Cl2 C、 H2 D、 CO2
14、某粒子用AZRn-表示,下列关于该粒子的叙述正确的是 ( )
A、所含质子数=A-n B、所含中子数=Z-A C、质量数=Z+A D、所含电子数=Z+n
15、分类是日常生活、化学学习和科学研究中经常用到的一种方法。下列化学物质的分类正确的是 ( )
A.碳酸钠、碳酸钾、碳酸钙、碳酸氢钙都属于可溶性的碳酸盐
?? B.二氧化硫、五氧化二磷、乙醇、乙酸都属于氧化物
? ? C.氢氧化钠、氢氧化钡、氢氧化钾、氨水都属于一元强碱
?? D. 盐酸、硝酸、氢氟酸(HF)、乙酸都属于一元酸
16、制备硅单质时,先从氧化物提取得到粗硅,再提纯为纯硅,主要化学反应如下:
⑴SiO2 + 2CSi + 2CO ⑵Si(粗) + 2Cl2SiCl4
⑶SiCl4 + 2H 2Si(纯) + 4HCl
对上述三个反应叙述中,不正确的是 ( )
A.⑴⑶为置换反应 B.⑴⑵⑶均为氧化还原反应
C.⑵为化合反应 D.三个反应中硅元素均被还原
17、下列溶液中的Cl(浓度与50 mL 1 mol ·L-1 MgCl2溶液中的Cl(浓度相等的是( )
A. 150 mL 1 mol·L-1 NaCl溶液
B. 75 mL 1 mol·L-1 CaCl2溶液
C. 100 mL 1 mol·L-1 KCl溶液
D. 75 mL 1 mol ·L-1 AlCl3溶液
18、在某化学反应中,铜离子得到2.408×1023 个电子,则可得到铜单质: ( )
A.25.6g B.32g C.12.8g D.38.4g
19、除去食盐溶液中的Ca2+、Mg2+、SO42-等杂质,需加入NaOH、Na2CO3、BaCl2和盐酸,加入顺序正确的是 ( )
A、NaOH、Na2CO3、BaCl2、HCl B、Na2CO3、BaCl2、HCl、NaOH
C、BaCl2、HCl、NaOH、Na2CO3 D、NaOH、BaCl2、Na2CO3、HCl
20、实验室制取氯气可以有以下途径,用化学方程式表示如下。若制取等质量的氯气,消耗盐酸最少的是 ( )
A、14HCl + K2Cr2O7 == 2KCl+2CrCl3+7H2O+3Cl2↑
B、16HCl + 2KMnO4 == 2MnCl2+8H2O+2KCl+5Cl2↑
C、4HCl + MnO2 △ MnCl2+2H2O+Cl2↑
D、6HCl + KClO3 == KCl+3H2O+3Cl2↑
21、下列电离方程式错误的是 ( )
A、KNO3 = K+ + NO3- B、NaHSO4 = Na+ + H+ + SO42-
C、BaCl2 = Ba2+ + Cl2- D、Na2SO4 = 2Na+ + SO42-
22、NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.2.3g钠由原子变成离子时,失去的电子数为NA
B.0.2NA个硫酸分子与19.6g磷酸(H3PO4)含有相同的氧原子数
C.28g氮气所含有的原子数为NA
D.NA个氧分子与NA个氢分子的质量比为8:1
23、向下列各物质的水溶液中滴加稀H2SO4或MgCl2溶液时,均有白色沉淀生成的是( )
A.BaCl2 B.Ba(OH)2
C.Na2CO3 D.KOH
24、痕检是公安机关提取犯罪嫌疑人指纹的一种重要的方法,AgNO3显现法就是其中的一种:人的手上有汗渍,用手动过白纸后,手指纹线就留在纸上。如果将溶液①小心地涂到纸上,溶液①中的溶质就跟汗渍中的物质②作用,生成物质③,物质③在光照下,分解出的银粒呈灰褐色,随着反应的进行,银粒逐渐增多,由灰褐色变成黑色的指纹线。用下列化学式表示这3种物质都正确的是 ( )
A、①AgNO3 ②NaBr ③AgBr
B、①AgNO3 ②NaCl ③AgCl
C、①AgCl ②AgNO3 ③NaCl
D、①AgNO3 ②NaI ③AgI
25、如图所示装配仪器,接通直流电源,电解饱和食盐水,则电解一段时间后,在碳棒和铁钉表面都有气体生成,其中碳棒表面生成的气体是 ( )
A、Cl2 B、O2
C、H2 D、HCl
第II卷(非选择题 共50分)
二、填空题(本题共有3个小题,共18分。把答案填在题中横线上。)
26、(6分) 用双线桥或单线桥标出下列两个氧化还原反应电子转移的方向和数目
① 2 KI ﹢ CI2 = 2 KCI ﹢ I2
②MnO2 ﹢ 4 HCI = MnCI2 ﹢ CI2 ﹢ 2 H2O
在该反应中氧化剂是 ,还原剂是
27、(5分)新制氯水中含有多种成分,其中分子有:CI2 、HCIO 、H2O,离子有H+、CIˉ、CIOˉ等,回答下列问题:(填写分子或离子符号)
(1)氯水应存放在 试剂瓶中密封保存。
(2)将紫色石蕊试液滴入氯水中,溶液显红色,起作用的成分是 ;过一会儿,溶液的颜色逐渐褪去,起作用的成分是 ;
(3)往氯水中滴入硝酸银溶液,产生白色沉淀,起作用的成分是 ;
(4)氯水能使淀粉碘化钾试纸变蓝,起作用的成分是 。
28、 (7分) 有一固体混合物,可能由Na 2 CO 3 、CaCO 3 、Na 2 SO 4 、CuSO 4 、CaCl 2 、NaCl等混合组成。为检验它们,做了以下实验:
⑴ 将固体混合物溶于水,搅拌后的无色透明溶液;
⑵ 往此溶液中滴加硝酸钡溶液,有白色沉淀生成;
⑶ 过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。
试判断:固体混合物中肯定有 ,肯定没有 ,可能有 ;对可能有的物质,可采取用向滤液中滴加 溶液的方法来检验。
三、实验题(本题共有2个小题,共14分。)
29、(6分)将混合气体通过某溶液时,其中一种气体被吸收,另一种气体通过,从而分离开来的方法叫洗气。对于混合物的分离或提纯,常采用的方法有:A.过滤、B.蒸发、C.蒸馏、D.萃取、E.洗气、F.加热分解等。下列各组混和物的分离或提纯应采用什么方法?(填写操作代号)
① 实验室中的石灰水久置,液面上常悬浮有CaCO3微粒。可用 的方法除去Ca(OH)2溶液中悬浮的CaCO3微粒。
② 除去H2中的CO2,可用 的方法除去。
③ 除去乙醇中溶解的微量食盐可采用 的方法。
④ 粗盐中含有不溶性的泥沙、可溶性的氯化钙、氯化镁及一些硫酸盐。要将粗盐提纯,可先将粗盐溶解,按一定的顺序加入沉淀剂,再 ;然后将溶液调成中性并__ _ ___就可以得到较为纯净的氯化钠晶体。
⑤ 除去氧化钙中的碳酸钙可用 的方法。
30、(8分)现用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL、0.2
mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙。请回答下列问题:
(1) 上述仪器中,在配制稀H2SO4时用不到的有 (填代号)。
(2) 经计算,需浓H2SO4的体积为 ml(保留1位小数)。
现有①10 mL ②50 mL ③100 mL三种规格的量筒,你选用的 (填代号) 。
(3) 将浓H2SO4用适量蒸馏水稀释后,冷却片刻,随后全部转移到 mL的
容量瓶中,转移时应用玻璃棒 。转移完毕,用少量蒸馏水洗涤
2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀。然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度1 cm ~ 2 cm处。 改用 滴加蒸馏水到瓶颈刻度的地方,使溶液的凹面正好跟刻度相平。振荡、摇匀后,装瓶、贴签。
(4) 在配制过程中,其他操作都准确,下列操作中,能引起误差偏高的有 (填代号)。
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
四、计算题(本题共有2个小题,共18分)
31、(9分)10克碳酸钙与足量的盐酸完全反应,最多可收集到多少体积(标准状况下)的二氧化碳?
32、(9分)常温下,将20.0克14.0%的NaCl溶液,跟30.0克24.0%的NaCl 溶液混合,得到密度为1.15 g/cm3的混合溶液。
问:(1)该混合溶液的质量分数为多少?
(2)物质的量浓度为多少?
(3)在1000ml水中需溶入多少克NaCl才能使浓度恰与上述混合溶液的浓度相等。
仙居中学2006~2007学年第一学期期中考试
高一化学答题卷
一、选择题(本题包括25小题,每小题2分,共50分。每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
A
B
C
B
D
A
D
D
B
A
D
D
C
题号
14
15
16
17
18
19
20
21
22
23
24
25
答案
D
D
D
B
C
D
D
C
B
B
B
A
二、填空题(本题共有3个小题,共18分。把答案填在题中横线上。)
26、(6分) 用双线桥或单线桥标出下列两个氧化还原反应电子转移的方向和数目
① 2 KI ﹢ CI2 = 2 KCI ﹢ I2
②MnO2 ﹢ 4 HCI = MnCI2 ﹢ CI2 ﹢ 2 H2O
在②反应中氧化剂是MnO2 ,还原剂是HCI
27、(5分)(填写分子或离子符号)(1)棕色(2)H+ 、HCIO
(3)CIˉ (4)CI2
28、(7分) 固体混合物中肯定有Na 2 CO 3 ,肯定没有CaCO 3 、Na 2 SO 4 、CuSO 4 、CaCl 2,可能有NaCl ;对可能有的物质,可采取用向滤液中滴加 硝酸酸化AgNO3 溶液的方法来检验。
三、实验题(本题共有2个小题,共14分。
29、(6分)(填写操作代号)① A ② E ③ C ④ A 、 B ⑤ F
30、(8分)(1)不用仪器 ②⑦⑧ (填代号)
(2) 需浓H2SO4的体积为 5.4 ml (保留1位小数) ,量筒规格 ① (填代号)。
(3) 选 500 mL容量瓶 ,玻璃棒作用 引流 , 洗涤 烧杯 2~3次,改用 胶头滴管 滴加蒸馏水。
(4) 配制过程中,其他操作都准确,下列操作能引起误差偏高的有①②⑦ (填代号)。
四、计算题(本题共有2个小题,共18分)
31、(9分)10克碳酸钙与足量的盐酸完全反应,最多可收集到多少体积(标准状况下)的二氧化碳?(2.24L)
32、(9分)常温下,将20.0克14.0%的NaCl溶液,跟30.0克24.0%的NaCl 溶液混合,得到密度为1.15 g/cm3的混合溶液。
问:(1)该混合溶液的质量分数为多少?(20.0%)
(2)物质的量浓度为多少? (3.93mol/L)
(3)在1000ml水中需溶入多少克NaCl才能使浓度恰与上述混合溶液的浓度相等。
(250g)
同课章节目录
