第五单元 化学方程式[下学期]
文档属性
| 名称 | 第五单元 化学方程式[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 800.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-06-22 13:03:00 | ||
图片预览








文档简介
课件20张PPT。第五单元 化学方程式 教师 谢奇科课题5-1 质量守恒定律 要点1 质量守恒定律的适用范围练习 不能用质量守恒定律解释的现象是 (? ?)
A.蜡烛燃烧后,越来越短、最终消失??
B.铁丝燃烧,其固体质量增加
C.潮湿的衣服在阳光下晒干??????????
D.高锰酸钾受热后,固体质量减少C注:质量守恒定律只适用于化学变化。要点2 质量守恒定律的简单应用练习1 24gMg与16g氧气恰好完全反应,生成 物为_____g。
练习2 X+2Y=R+2M中,1.6克X与若干克Y恰好完全反应后生成4.4克R,若生成的R与M的质量比为11∶9,则反应中Y与M的质量比为____。练习2解: 设生成的M质量为m
4.4g:m=11:9 m=3.6g
X + 2Y= R+ 2M
1.6g+6.4g=4.4g+3.6g 故Y与M质量比为:6.4g:3.6g=16:940要点3 用质量守恒定律推化学式练习1 4A+3B2=2AxBy,则x为___,y为____。
练习2 4NH3+5O2=4X+6H2O反应中,X的化
学式为 (?? )
A.NO B.NO2? C.N2O4 D.N223A注:用质量守恒定律推化学式关键是数原子个数,
要注意化学式前的”倍数“,如:H2O中是1 个氧原子,
6H2O中就有6个氧原子。要点4 质量守恒的原因练习 某化合物在纯氧气中燃烧生成了二氧化碳与二氧化硫,则该物质中一定含有__________元素,可能有___元素。要点5 化学变化中的变与不变练习 化学反应前后可能改变的是( )
A..原子总数 B.分子总数
C.元素种类 D.物质总质量注: 化学反应中有三个不变:
1、原子(种类、数目、质量)不变,
2、元素(种类、质量)不变,
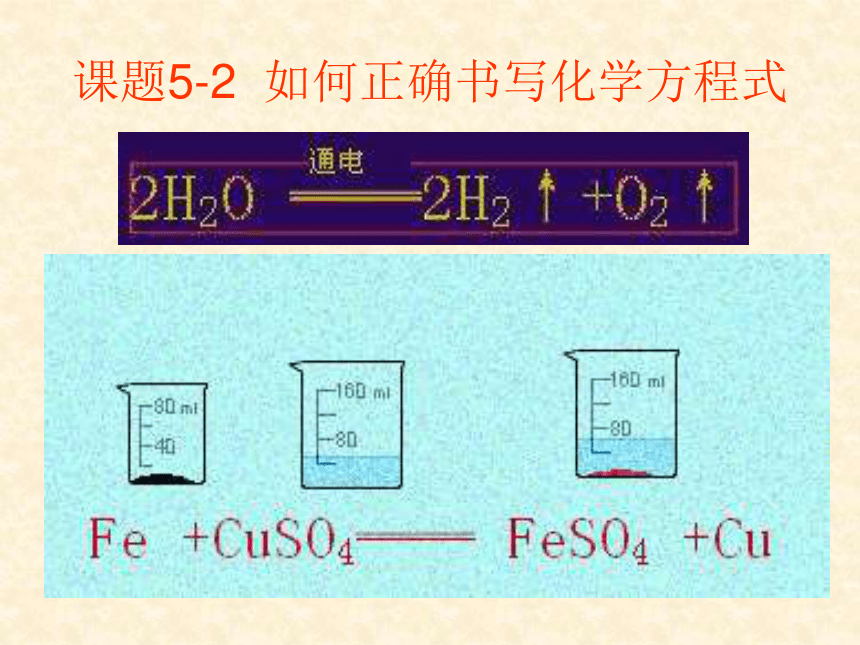
3、物质总质量不变。碳、硫氧B课题5-2 如何正确书写化学方程式要点1 化学方程式的书写原则练习 下列化学方程式中分别有以下错误中的一种,请将相应序号填在题号后的括号内。
A.不符合反应客观事实 B.缺少反应条件
C.不符合质量守恒定律 D.缺少或用错“↑”或“↓”符号
(1)4Fe+3O2 2Fe2O3 (?? )
(2)C+O2 CO2↑ (? ?)
(3)H2+O2 H2O (? ?)?????
(4)2H2O 2H2↑+O2↑ (? ?)
(5)Mg+O2 MgO2 (? ?)??????
(6)2KMnO4 K2MnO4+MnO2+O2↑ (?? )
(7)A1+O2 A12O3 (? ?)???????
(8)Fe+CuSO4 FeSO4+Cu↓ (?? )
ADCBABCD要点2 化学方程式的配平练习 配平下列方程式
1、 Al+ Fe3O4 Fe+ Al2O3 8Al+3Fe3O4 9Fe+4Al2O3 注:化学方程式的配平方法有最小公倍数法、奇偶法、
观察法、待定系数法等。 2、 CO+ Fe3O4 Fe+ CO2 4CO+Fe3O4 3Fe+4CO23、 N2H4+ H2O2= H2O+N2
N2H4+2H2O2=4H2O+N2趣味化学 某国的Possible镇有个美丽的小湖,还有一个古老的蛋糕店,店里有个叫Normal的蛋糕师,她不是我们故事的主角,故事的主角是她命名的叫Normal的乌鸦,多年来这只乌鸦常常带领伙伴们到蛋糕店后堆积蛋壳的垃圾堆中找吃的。几年前美丽的小湖开始被大量酸性工业废水污染,成了一个大污水池, Normal为此伤心。有一天她发现Normal带领伙伴们叨起蛋壳飞向湖边丢进湖水中,此后每天都有这样的事情发生,于是她说服大家挖了条沟把所有的蛋壳排到小湖中,湖水又恢复了澄清,美丽的小湖又成了人们休闲的好地方。如今,这个湖叫Normal湖,湖边还有人们树立的乌鸦雕塑,雕塑上刻着一句话:“动物大多时候比人类聪明!”你能用学过的化学知识解释湖水恢复的奇迹吗?写出可能的化学方程式。
CaCO3 +2HCl= CaCl2+H2O+CO2↑要点3 化学方程式的意义
练习 下图学生在讨论某一个化学方程式表示的意义,他们所描述的化学方程式是(相对原子质量:H-1;C-12;O-16;S-32) (?? )
A.S十O2 SO2????? B.2CO+O2 2CO2
C.2H2+O2 2H2O???
D.CH4+2O2 CO2+2H2OC课题5-3 利用化学方程式的计算利用化学方程式的计算要注意:
1、化学方程式计算的步骤
注:最重要的是先审题,找到化学反应、已知量与未知量 。
2、涉及质量、体积、密度的计算
m=ρV
3、涉及杂质的计算
纯物质的质量=混合物的质量×质量分数
4、计算中要注意利用质量守恒定律
VCO2 (L)tv0练习 将一石灰石粉末逐渐加入100克未知浓度的稀盐酸中,测得生成气体的体积与时间t的关系图如下:⑴若t1时滤出部分溶液A, t2时滤出部分溶液B,A与B中溶质质量分数的关系是________。
⑵ 若已知V为2.23L,求稀盐
酸的质量分数(CO2的密度为1.977g/L) 。
⑶若t1时加入的石灰石为12克, t2时加入的石灰石为15克,求石灰石中碳酸钙的纯度。t1t2
解: ⑴可知 t1、 t2时反应都已完成,滤出的氯化钙溶液
质量分数相同。故可填上“相同”。
⑵生成了二氧化碳为
2.23L× 1.977g/L=4.4g
设氯化氢为x,参加反应的碳酸钙为y
CaCO3 +2HCl= CaCl2+H2O+CO2↑
100 73 44
y x 4.4g
73 44 100
x 4.4g y
x=7.3g y=10g
7.3
100
答:稀盐酸的质量分数为7.3%.×100%=7.3%⑶碳酸钙完全反应在t1时,故石灰石应按12克计算
10
12
答:石灰石中碳酸钙的纯度为83%.×100%=83%提高部分练习1 从含有Cu2S的铜矿石中炼铜的步骤为:
⑴矿石粉碎后在炉中与空气燃烧,生成两种氧化物。
⑵将上步生成的固体与质量与它相同的原矿石粉混合入炉中隔绝空气高温加热,得到铜与上步中相同的一种气态氧化物,它有刺激性气味。写出两步的方程式 。Cu2S+2O2 2CuO+ SO2
2CuO+ Cu2S 4Cu+ SO2↑练习2 甲、乙、丙、丁四人用锌与稀硫酸制氢气,记录如下:求:⑴甲用的锌的质量。
⑵稀硫酸中硫酸的质量分数。分析:可见甲、乙中锌与氢气的质量成比例,甲、乙中锌已完全
反应。故甲用的锌的质量可由甲中的氢气求算。比较乙与丙,可
见锌与氢气的质量不成比例,故丙中锌过量,硫酸应由丙中的氢
气求算。解:设100克稀硫酸中硫酸质量为x
Zn+H2SO4=ZnSO4+H2↑
65 98 2
a 0.4g
x 0.6g
65:a=2:0.4g a=13g
98:x=2:0.6g x=29.4g
(29.4÷100) ×100%=29.4%
答:甲用的锌为13克,稀硫酸中硫酸的质量分数
为29.4%.练习3 氢氧化钠与硫酸铜的混合物溶于水中,然后往所得混合物中加入10%的稀盐酸,所加稀盐酸与杯中沉淀质量的关系如下图所示:
求:最初沉淀的质量。0分析:可见前10g稀盐酸没有使沉淀减少,后面36.5g稀盐酸才是与最初杯中沉淀氢氧化铜反应。解:设沉淀氢氧化铜为x
Cu(OH)2+2HCl CuCl2+2H2O
98 73
x (46.5g-10g) ×10%
98:x=73:3.65g
x=4.9g
答:最初沉淀为4.9克。10g46.5g沉淀的质量稀盐酸的质量
A.蜡烛燃烧后,越来越短、最终消失??
B.铁丝燃烧,其固体质量增加
C.潮湿的衣服在阳光下晒干??????????
D.高锰酸钾受热后,固体质量减少C注:质量守恒定律只适用于化学变化。要点2 质量守恒定律的简单应用练习1 24gMg与16g氧气恰好完全反应,生成 物为_____g。
练习2 X+2Y=R+2M中,1.6克X与若干克Y恰好完全反应后生成4.4克R,若生成的R与M的质量比为11∶9,则反应中Y与M的质量比为____。练习2解: 设生成的M质量为m
4.4g:m=11:9 m=3.6g
X + 2Y= R+ 2M
1.6g+6.4g=4.4g+3.6g 故Y与M质量比为:6.4g:3.6g=16:940要点3 用质量守恒定律推化学式练习1 4A+3B2=2AxBy,则x为___,y为____。
练习2 4NH3+5O2=4X+6H2O反应中,X的化
学式为 (?? )
A.NO B.NO2? C.N2O4 D.N223A注:用质量守恒定律推化学式关键是数原子个数,
要注意化学式前的”倍数“,如:H2O中是1 个氧原子,
6H2O中就有6个氧原子。要点4 质量守恒的原因练习 某化合物在纯氧气中燃烧生成了二氧化碳与二氧化硫,则该物质中一定含有__________元素,可能有___元素。要点5 化学变化中的变与不变练习 化学反应前后可能改变的是( )
A..原子总数 B.分子总数
C.元素种类 D.物质总质量注: 化学反应中有三个不变:
1、原子(种类、数目、质量)不变,
2、元素(种类、质量)不变,
3、物质总质量不变。碳、硫氧B课题5-2 如何正确书写化学方程式要点1 化学方程式的书写原则练习 下列化学方程式中分别有以下错误中的一种,请将相应序号填在题号后的括号内。
A.不符合反应客观事实 B.缺少反应条件
C.不符合质量守恒定律 D.缺少或用错“↑”或“↓”符号
(1)4Fe+3O2 2Fe2O3 (?? )
(2)C+O2 CO2↑ (? ?)
(3)H2+O2 H2O (? ?)?????
(4)2H2O 2H2↑+O2↑ (? ?)
(5)Mg+O2 MgO2 (? ?)??????
(6)2KMnO4 K2MnO4+MnO2+O2↑ (?? )
(7)A1+O2 A12O3 (? ?)???????
(8)Fe+CuSO4 FeSO4+Cu↓ (?? )
ADCBABCD要点2 化学方程式的配平练习 配平下列方程式
1、 Al+ Fe3O4 Fe+ Al2O3 8Al+3Fe3O4 9Fe+4Al2O3 注:化学方程式的配平方法有最小公倍数法、奇偶法、
观察法、待定系数法等。 2、 CO+ Fe3O4 Fe+ CO2 4CO+Fe3O4 3Fe+4CO23、 N2H4+ H2O2= H2O+N2
N2H4+2H2O2=4H2O+N2趣味化学 某国的Possible镇有个美丽的小湖,还有一个古老的蛋糕店,店里有个叫Normal的蛋糕师,她不是我们故事的主角,故事的主角是她命名的叫Normal的乌鸦,多年来这只乌鸦常常带领伙伴们到蛋糕店后堆积蛋壳的垃圾堆中找吃的。几年前美丽的小湖开始被大量酸性工业废水污染,成了一个大污水池, Normal为此伤心。有一天她发现Normal带领伙伴们叨起蛋壳飞向湖边丢进湖水中,此后每天都有这样的事情发生,于是她说服大家挖了条沟把所有的蛋壳排到小湖中,湖水又恢复了澄清,美丽的小湖又成了人们休闲的好地方。如今,这个湖叫Normal湖,湖边还有人们树立的乌鸦雕塑,雕塑上刻着一句话:“动物大多时候比人类聪明!”你能用学过的化学知识解释湖水恢复的奇迹吗?写出可能的化学方程式。
CaCO3 +2HCl= CaCl2+H2O+CO2↑要点3 化学方程式的意义
练习 下图学生在讨论某一个化学方程式表示的意义,他们所描述的化学方程式是(相对原子质量:H-1;C-12;O-16;S-32) (?? )
A.S十O2 SO2????? B.2CO+O2 2CO2
C.2H2+O2 2H2O???
D.CH4+2O2 CO2+2H2OC课题5-3 利用化学方程式的计算利用化学方程式的计算要注意:
1、化学方程式计算的步骤
注:最重要的是先审题,找到化学反应、已知量与未知量 。
2、涉及质量、体积、密度的计算
m=ρV
3、涉及杂质的计算
纯物质的质量=混合物的质量×质量分数
4、计算中要注意利用质量守恒定律
VCO2 (L)tv0练习 将一石灰石粉末逐渐加入100克未知浓度的稀盐酸中,测得生成气体的体积与时间t的关系图如下:⑴若t1时滤出部分溶液A, t2时滤出部分溶液B,A与B中溶质质量分数的关系是________。
⑵ 若已知V为2.23L,求稀盐
酸的质量分数(CO2的密度为1.977g/L) 。
⑶若t1时加入的石灰石为12克, t2时加入的石灰石为15克,求石灰石中碳酸钙的纯度。t1t2
解: ⑴可知 t1、 t2时反应都已完成,滤出的氯化钙溶液
质量分数相同。故可填上“相同”。
⑵生成了二氧化碳为
2.23L× 1.977g/L=4.4g
设氯化氢为x,参加反应的碳酸钙为y
CaCO3 +2HCl= CaCl2+H2O+CO2↑
100 73 44
y x 4.4g
73 44 100
x 4.4g y
x=7.3g y=10g
7.3
100
答:稀盐酸的质量分数为7.3%.×100%=7.3%⑶碳酸钙完全反应在t1时,故石灰石应按12克计算
10
12
答:石灰石中碳酸钙的纯度为83%.×100%=83%提高部分练习1 从含有Cu2S的铜矿石中炼铜的步骤为:
⑴矿石粉碎后在炉中与空气燃烧,生成两种氧化物。
⑵将上步生成的固体与质量与它相同的原矿石粉混合入炉中隔绝空气高温加热,得到铜与上步中相同的一种气态氧化物,它有刺激性气味。写出两步的方程式 。Cu2S+2O2 2CuO+ SO2
2CuO+ Cu2S 4Cu+ SO2↑练习2 甲、乙、丙、丁四人用锌与稀硫酸制氢气,记录如下:求:⑴甲用的锌的质量。
⑵稀硫酸中硫酸的质量分数。分析:可见甲、乙中锌与氢气的质量成比例,甲、乙中锌已完全
反应。故甲用的锌的质量可由甲中的氢气求算。比较乙与丙,可
见锌与氢气的质量不成比例,故丙中锌过量,硫酸应由丙中的氢
气求算。解:设100克稀硫酸中硫酸质量为x
Zn+H2SO4=ZnSO4+H2↑
65 98 2
a 0.4g
x 0.6g
65:a=2:0.4g a=13g
98:x=2:0.6g x=29.4g
(29.4÷100) ×100%=29.4%
答:甲用的锌为13克,稀硫酸中硫酸的质量分数
为29.4%.练习3 氢氧化钠与硫酸铜的混合物溶于水中,然后往所得混合物中加入10%的稀盐酸,所加稀盐酸与杯中沉淀质量的关系如下图所示:
求:最初沉淀的质量。0分析:可见前10g稀盐酸没有使沉淀减少,后面36.5g稀盐酸才是与最初杯中沉淀氢氧化铜反应。解:设沉淀氢氧化铜为x
Cu(OH)2+2HCl CuCl2+2H2O
98 73
x (46.5g-10g) ×10%
98:x=73:3.65g
x=4.9g
答:最初沉淀为4.9克。10g46.5g沉淀的质量稀盐酸的质量
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
