原电池[下学期]
图片预览


文档简介
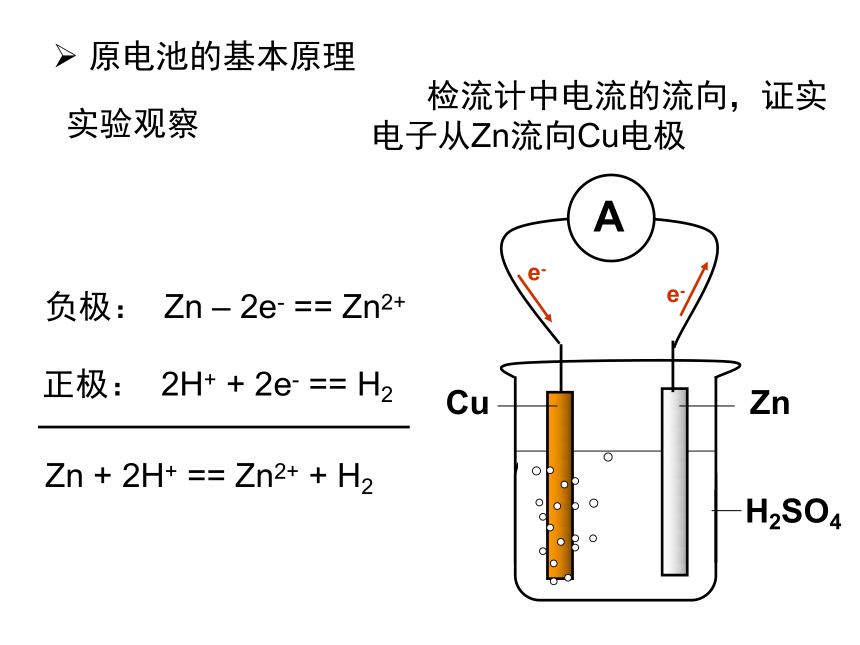
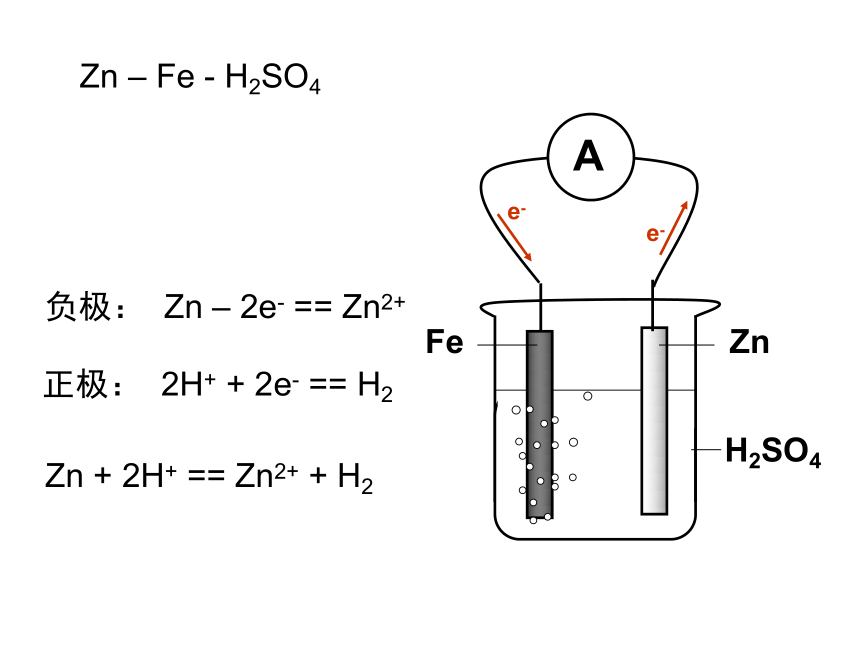
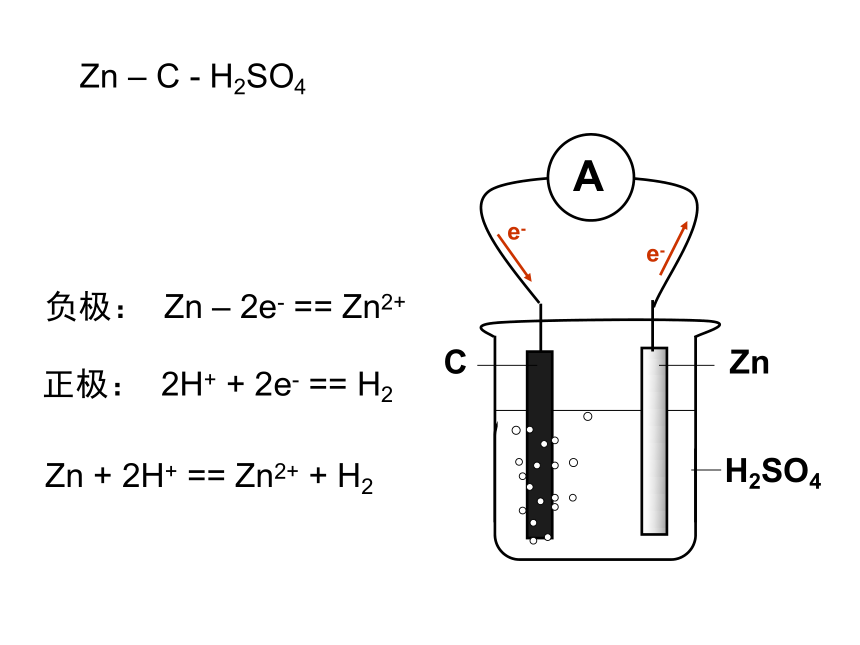
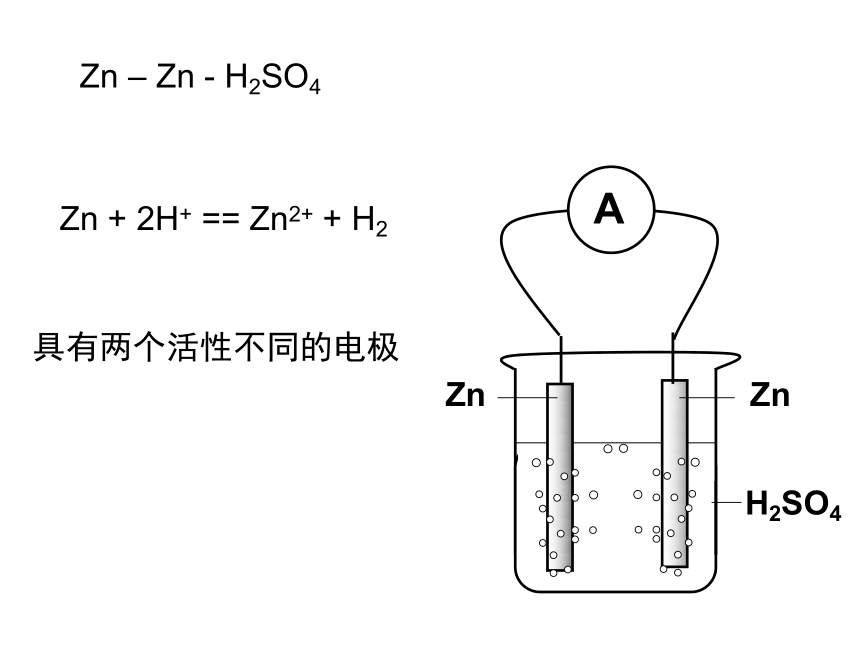
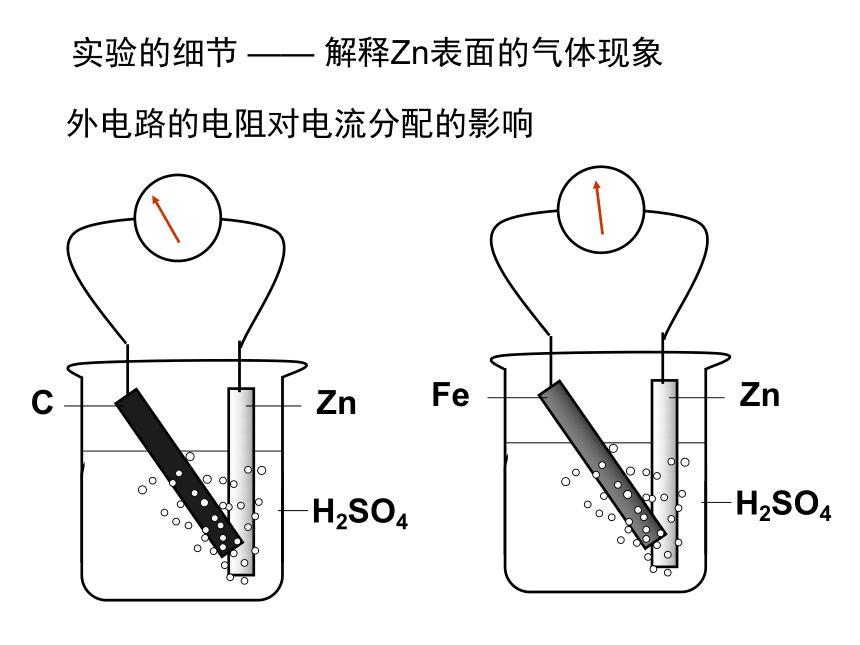
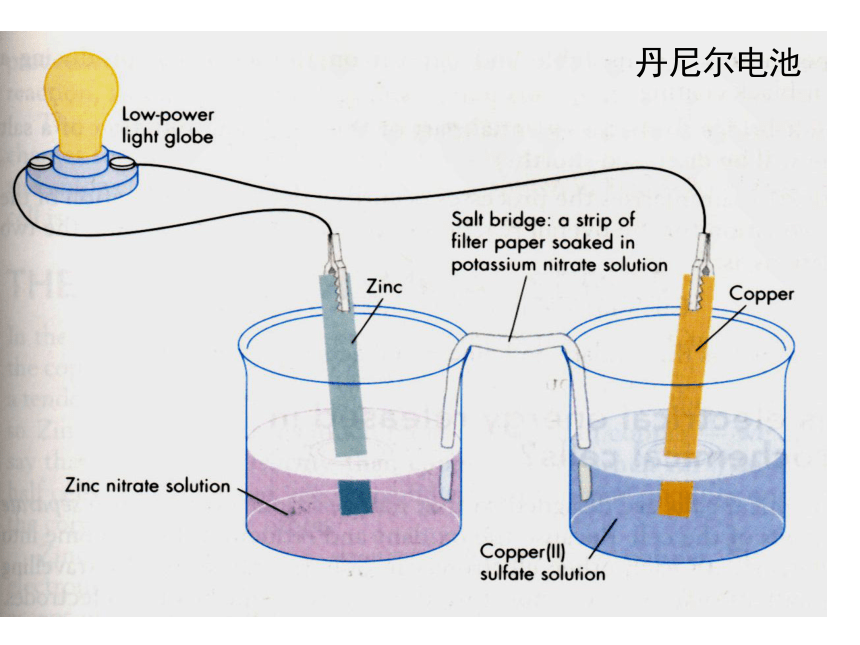
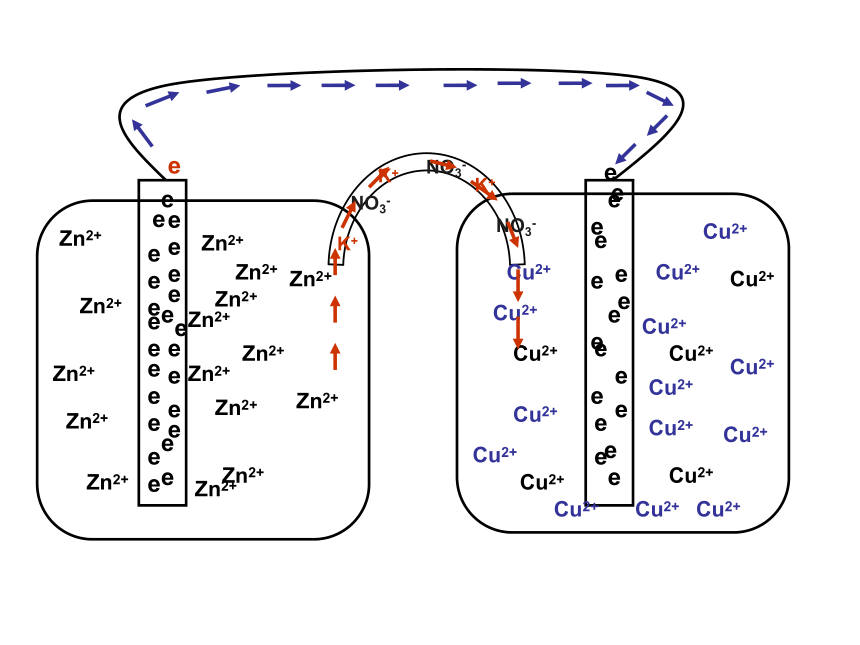
课件22张PPT。原电池 原电池的基本原理实验观察 检流计中电流的流向,证实电子从Zn流向Cu电极e-e-负极: Zn – 2e- == Zn2+正极: 2H+ + 2e- == H2Zn + 2H+ == Zn2+ + H2FeZnH2SO4e-e-负极: Zn – 2e- == Zn2+正极: 2H+ + 2e- == H2Zn + 2H+ == Zn2+ + H2Zn – Fe - H2SO4e-e-负极: Zn – 2e- == Zn2+正极: 2H+ + 2e- == H2Zn + 2H+ == Zn2+ + H2Zn – C - H2SO4Zn – Zn - H2SO4Zn + 2H+ == Zn2+ + H2具有两个活性不同的电极外电路的电阻对电流分配的影响实验的细节 —— 解释Zn表面的气体现象丹尼尔电池Zn2+Zn2+Zn2+Zn2+Zn2+Zn2+Zn2+eeeeeeeeeeeeeeZn2+Zn2+Zn2+Zn2+eeeeeeeeeeeZn2+eeK+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+K+K+NO3-NO3-NO3-Zn2+Zn2+Zn2+Zn2+ 形成原电池的基本条件(1) 有氧化还原反应的支撑,
(2) 有两个反应活性不同的电极,
(3) 需要相应的电解质溶液,
(4) 产生电流的条件:形成闭合电路 负极:Cu + Cl2 == CuCl22e-Cu – 2e- == Cu2+正极:Cl2 + 2e- == 2Cl-负极:Fe + 2H+ == Fe2+ + H22e-Fe – 2e- == Fe2+正极:2H+ + 2e- == H2 几种常见的化学电源干电池负极:Zn – 2e- == Zn2+
正极:2NH4+ +2MnO2 + 2e- == 2NH3 + Mn2O3 + H2O 已知:PbSO4难溶于水
Pb + PbO2 + 2H2SO4 == 2PbSO4 + 2H2O 负极:Pb + SO42- - 2e- == PbSO4正极:PbO2 + 4H+ + SO42- + 2e- == PbSO4 + 2H2O燃料电池的反应方程式:2H2 + O2 == 2H2O正极:O2 + 2H2O + 4e- == 4OH-4e-负极:2H2 – 4e- == 4H+碱性条件下正极:O2 + 2H2O + 4e- == 4OH- 电解质溶液的酸碱性对电极反应的影响负极:2H2 – 4e- == 4H+负极:2H2 – 4e- == 4H+正极:O2 + 4H+ + 4e- == 2H2O酸性条件下负极:2H2 + 4OH- – 4e- == 4H2O正极:O2 + 2H2O + 4e- == 4OH-— 有效地防止电解质溶液对外壳的腐蚀 改变燃料正极:O2 + 2H2O + 4e- == 4OH-H2正极:O2 + 2H2O + 8e- == 8OH-负极:CH4 + 10OH- – 8e- == CO32- + 7H2OCH4 +2O2 == CO2 + 2H2OCH4 +2O2 + 2OH- == CO32- + 2H2OCH4负极:2H2 + 4OH- – 4e- == 4H2OZn2+Zn2+Zn2+Zn2+Zn2+Zn2+Zn2+eeeeeeeeeeeeeeZn2+Zn2+Zn2+Zn2+eeeeeeeeeeeZn2+eeK+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+K+K+NO3-NO3-NO3-Zn2+Zn2+Zn2+Zn2+
(2) 有两个反应活性不同的电极,
(3) 需要相应的电解质溶液,
(4) 产生电流的条件:形成闭合电路 负极:Cu + Cl2 == CuCl22e-Cu – 2e- == Cu2+正极:Cl2 + 2e- == 2Cl-负极:Fe + 2H+ == Fe2+ + H22e-Fe – 2e- == Fe2+正极:2H+ + 2e- == H2 几种常见的化学电源干电池负极:Zn – 2e- == Zn2+
正极:2NH4+ +2MnO2 + 2e- == 2NH3 + Mn2O3 + H2O 已知:PbSO4难溶于水
Pb + PbO2 + 2H2SO4 == 2PbSO4 + 2H2O 负极:Pb + SO42- - 2e- == PbSO4正极:PbO2 + 4H+ + SO42- + 2e- == PbSO4 + 2H2O燃料电池的反应方程式:2H2 + O2 == 2H2O正极:O2 + 2H2O + 4e- == 4OH-4e-负极:2H2 – 4e- == 4H+碱性条件下正极:O2 + 2H2O + 4e- == 4OH- 电解质溶液的酸碱性对电极反应的影响负极:2H2 – 4e- == 4H+负极:2H2 – 4e- == 4H+正极:O2 + 4H+ + 4e- == 2H2O酸性条件下负极:2H2 + 4OH- – 4e- == 4H2O正极:O2 + 2H2O + 4e- == 4OH-— 有效地防止电解质溶液对外壳的腐蚀 改变燃料正极:O2 + 2H2O + 4e- == 4OH-H2正极:O2 + 2H2O + 8e- == 8OH-负极:CH4 + 10OH- – 8e- == CO32- + 7H2OCH4 +2O2 == CO2 + 2H2OCH4 +2O2 + 2OH- == CO32- + 2H2OCH4负极:2H2 + 4OH- – 4e- == 4H2OZn2+Zn2+Zn2+Zn2+Zn2+Zn2+Zn2+eeeeeeeeeeeeeeZn2+Zn2+Zn2+Zn2+eeeeeeeeeeeZn2+eeK+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+K+K+NO3-NO3-NO3-Zn2+Zn2+Zn2+Zn2+
