高一化学必修2专题一复习[下学期]
图片预览








文档简介
课件33张PPT。回顾
随着原子序数的递增
元素原子的核外电子排布
元素原子半径
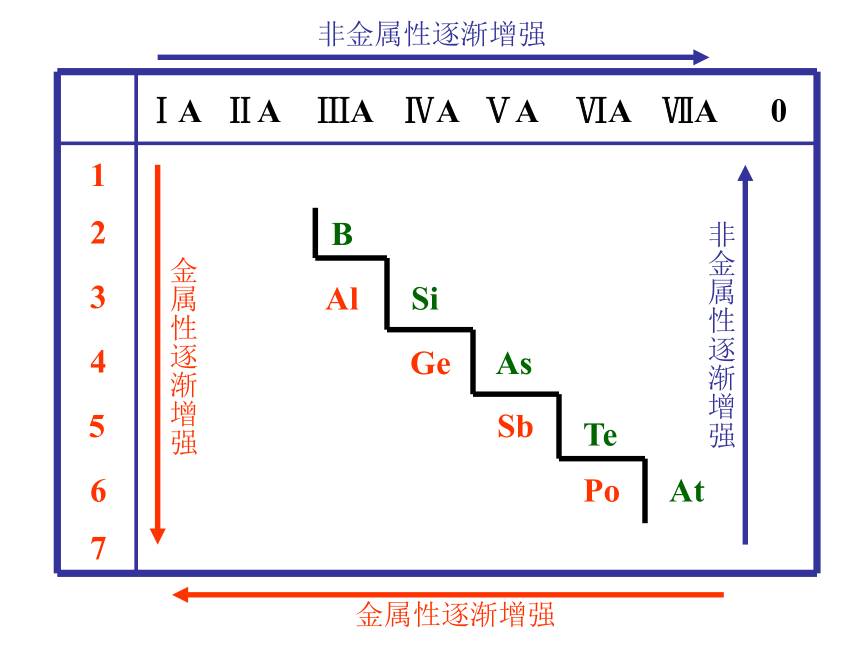
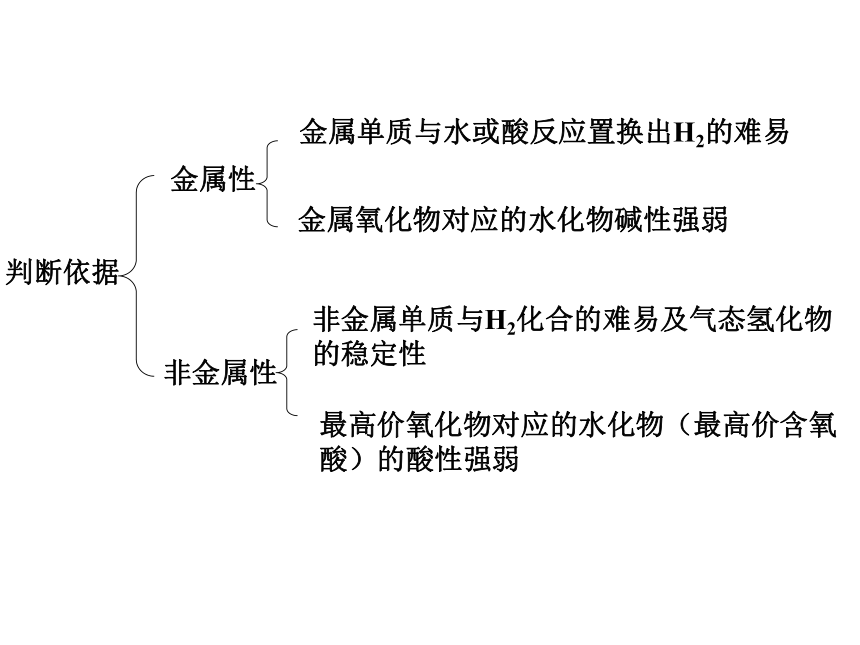
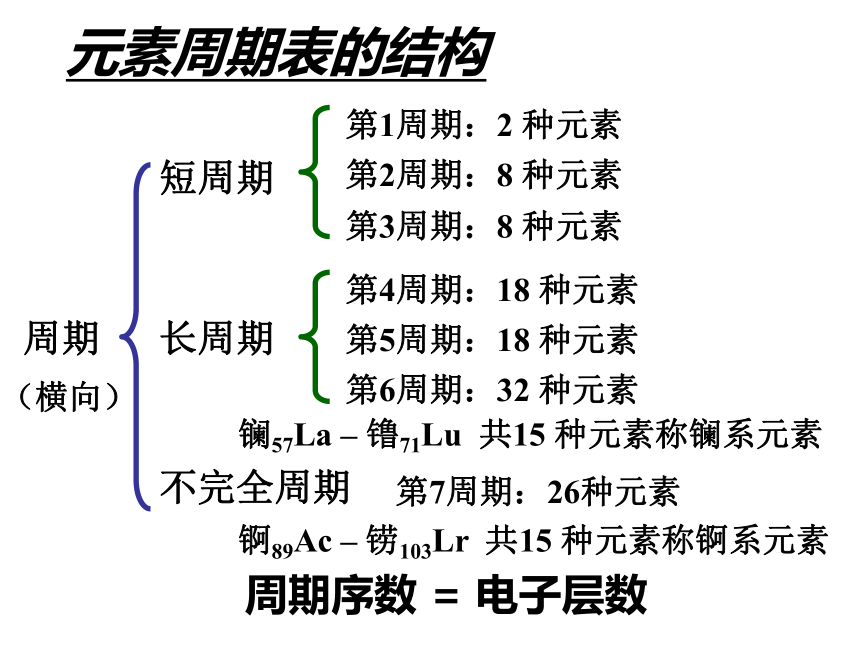
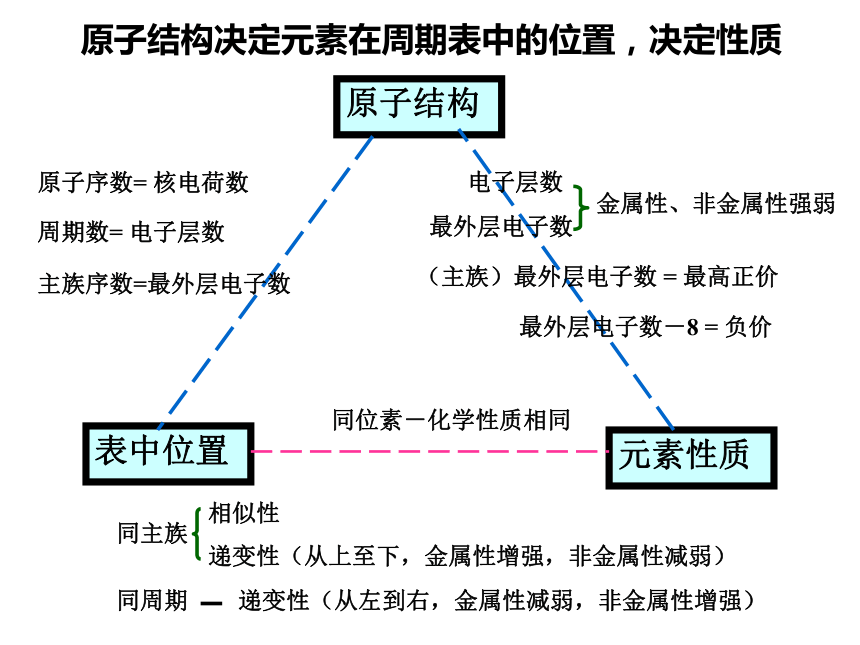
元素主要化合价呈现周期性变化元素性质的递变规律同周期(左→右)项 目核电荷数同主族(上→下)电子层数原子半径化 合 价 相 同 逐渐减小 最高正价:+1 →+7 逐渐增大 负化合价:- 4 → -1 增 大 增 多 逐渐增大 最高正价=族序数 负化合价= -(8-族序数)主族元素原子的最外层电子叫做价电子 1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强判断依据元素周期表的结构周期短周期长周期第1周期:2 种元素第2周期:8 种元素第3周期:8 种元素第4周期:18 种元素第5周期:18 种元素第6周期:32 种元素不完全周期第7周期:26种元素镧57La – 镥71Lu 共15 种元素称镧系元素锕89Ac – 铹103Lr 共15 种元素称锕系元素周期序数 = 电子层数 (横向)元素周期表的结构 族主族:副族:ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA 第VIII 族:稀有气体元素主族序数 = 最外层电子数 (纵向) 零族:共七个主族:长短周期共同组成ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB 共七个副族:仅由长周期组成三个纵行,位于Ⅶ B 与ⅠB中间 原子结构表中位置元素性质原子序数= 核电荷数周期数= 电子层数主族序数=最外层电子数同位素-化学性质相同 相似性
递变性(从上至下,金属性增强,非金属性减弱)同周期同主族递变性(从左到右,金属性减弱,非金属性增强)电子层数最外层电子数金属性、非金属性强弱(主族)最外层电子数 = 最高正价 最外层电子数-8 = 负价原子结构决定元素在周期表中的位置,决定性质元素周期律及元素周期表
的三大意义 ⑴ 学习和研究化学的规律和工具 ⑵ 研究发现新物质 ⑶ 论证了量变引起质变的规律性 预言新元素,研究新农药,寻找半导体材料、催化剂、耐高温耐腐蚀材料。1、定义: 使阴阳离子结合成化合物的静电作用,叫做离子键。成键微粒:阴阳离子相互作用:静电作用(静电引力和斥力)成键过程:阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。含有离子键的化合物就是离子化合物。二、离子键 使阴阳离子结合成化合物的静电作用,叫 做离子键。思考 哪些物质能形成离子键? 活泼的金属元素(IA,IIA)和活泼的非金属
元素(VIA,VIIA)之间的化合物。 活泼的金属元素和酸根离子形成的盐 铵根离子和酸根离子(或活泼非金属元素离子)形成的盐。离子化合物的电子式:AB型AB2型A2B型NaClNa2SNa2OMgCl2注:阴、阳离子的电子式相间写,相同离子不能合并。用 电子式 表示 离子化合物 的 形成过程 用电子式表示氯化钠的形成过程 用电子式表示溴化钙的形成过程 3、离子键的强弱根据离子键的成因,离子键的强弱取决于成键离子的半径以及所带电荷数,由于两者一般不矛盾,所以通常可以直接通过阴阳离子的半径大小来判断离子键的强弱。
如比较NaCl和MgCl2 NaCl和NaBr 碘 +→ 用电子式表示下列共价分子的形成过程水 二氧化碳 氨 2 H ·+→硫化氢2 H ·+→3 H ·+→+2→定义:原子之间通过共用电子对所形成的相互作用,叫做共价键。成键微粒:原子相互作用:共用电子对成键元素:同种或不同种非金属元素含有共价键的化合物不一定是共价化合物共价键 氢氧化钠晶体中,钠离子与氢氧根离子以
离子键结合;在氢氧根离子中,氢与氧以共价
键结合。请用电子式表示氢氧化钠。 [ ] +- 过氧化钠晶体中,过氧根离子 (O2 ) 2-与钠
离子以离子键结合;在过氧根离子中,两个氧
原子以共价键结合。请用电子式表示过氧化钠。[ ]++2-离子键和共价键的比较共价键的强弱共价键的强弱主要取决与成键原子的半径,成键原子半径越大,则共价键越弱。分子间作用力的特点1.广泛存在(由分子构成的物质)2.作用范围小3.作用力弱4.主要影响物质的物理性质(熔沸点)相邻的原子间强烈的相互作用把分子聚集在一起的作用力分子内原子间分子之间较 强与化学键相比弱的多主要影响化学性质主要影响物理性质(如熔沸点)化学键与分子间作用力的比较卤族元素单质物理性质差异4.氢键对物质性质的影响⑴氢键的存在使物质的熔沸点相对较高⑵解释一些反常现象:如水结成冰时,为什么体积会膨胀。一 碳的几种同素异形体二 氧的同素异形体 O2O3颜色无色淡蓝气味无味有特殊臭味性质氧化性强氧化性(做消毒剂)三 磷的同素异形体不仅熔沸点有差异,且化学性质也存在差异,如乙醇可与金属钠反应,而二甲醚就不与金属钠反应.定义:一、离子晶体实例:食盐、氯化铯物理性质:形成离子晶体的物质: 离子化合物中的阴、阳离子按一定的方式有规则
地排列而形成的晶体叫做离子晶体。 具有较高的熔沸点,在熔融状态或水溶液中能
导电,有些离子晶体溶于水,有些难溶于水KOH 、 CuSO4、
NH4Cl 、 CaO、等离子化合物
二、分子晶体分子晶体:分子晶体的物理性质:定义:实例:如干冰、冰等共价化合物形成分子晶体的物质: 熔、沸点低,硬度小,在水
中的溶解度存在很大的差异。H2、Cl2、He 、HCl 、H2O、CO2等 分子间通过分子间作用力相
结合的晶体,叫做分子晶体。三、原子晶体定义:实例:原子晶体的物理性质:如二氧化硅晶体、金刚石常见的原子晶体:熔沸点很高,硬度很大,难溶于水,
一般不导电。金刚石、金刚砂(SiC)、
晶体硅、石英(SiO2) 这种相邻原子通过共价键结合而形成
空间网状结构的晶体,叫做原子晶体。小结1、离子晶体、分子晶体、原子晶体结构与性质关系的比较:阴、阳离子分子原子金属阳离子和自由移动电子离子键分子间
作用力共价键金属键差距大大小较大较大小高差距大导电不导电溶液有些导电熔融或溶液导电
随着原子序数的递增
元素原子的核外电子排布
元素原子半径
元素主要化合价呈现周期性变化元素性质的递变规律同周期(左→右)项 目核电荷数同主族(上→下)电子层数原子半径化 合 价 相 同 逐渐减小 最高正价:+1 →+7 逐渐增大 负化合价:- 4 → -1 增 大 增 多 逐渐增大 最高正价=族序数 负化合价= -(8-族序数)主族元素原子的最外层电子叫做价电子 1B Al SiGe As Sb Te 2 3 4 5 6 7ⅠAⅡAⅢAⅣAⅤAⅥAⅦA 0 Po At非金属性逐渐增强 金属性逐渐增强金属性逐渐增强 非金属性逐渐增强判断依据元素周期表的结构周期短周期长周期第1周期:2 种元素第2周期:8 种元素第3周期:8 种元素第4周期:18 种元素第5周期:18 种元素第6周期:32 种元素不完全周期第7周期:26种元素镧57La – 镥71Lu 共15 种元素称镧系元素锕89Ac – 铹103Lr 共15 种元素称锕系元素周期序数 = 电子层数 (横向)元素周期表的结构 族主族:副族:ⅠA , ⅡA , ⅢA , ⅣA ,ⅤA , ⅥA , ⅦA 第VIII 族:稀有气体元素主族序数 = 最外层电子数 (纵向) 零族:共七个主族:长短周期共同组成ⅠB , ⅡB , ⅢB , ⅣB ,ⅤB , ⅥB , ⅦB 共七个副族:仅由长周期组成三个纵行,位于Ⅶ B 与ⅠB中间 原子结构表中位置元素性质原子序数= 核电荷数周期数= 电子层数主族序数=最外层电子数同位素-化学性质相同 相似性
递变性(从上至下,金属性增强,非金属性减弱)同周期同主族递变性(从左到右,金属性减弱,非金属性增强)电子层数最外层电子数金属性、非金属性强弱(主族)最外层电子数 = 最高正价 最外层电子数-8 = 负价原子结构决定元素在周期表中的位置,决定性质元素周期律及元素周期表
的三大意义 ⑴ 学习和研究化学的规律和工具 ⑵ 研究发现新物质 ⑶ 论证了量变引起质变的规律性 预言新元素,研究新农药,寻找半导体材料、催化剂、耐高温耐腐蚀材料。1、定义: 使阴阳离子结合成化合物的静电作用,叫做离子键。成键微粒:阴阳离子相互作用:静电作用(静电引力和斥力)成键过程:阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。含有离子键的化合物就是离子化合物。二、离子键 使阴阳离子结合成化合物的静电作用,叫 做离子键。思考 哪些物质能形成离子键? 活泼的金属元素(IA,IIA)和活泼的非金属
元素(VIA,VIIA)之间的化合物。 活泼的金属元素和酸根离子形成的盐 铵根离子和酸根离子(或活泼非金属元素离子)形成的盐。离子化合物的电子式:AB型AB2型A2B型NaClNa2SNa2OMgCl2注:阴、阳离子的电子式相间写,相同离子不能合并。用 电子式 表示 离子化合物 的 形成过程 用电子式表示氯化钠的形成过程 用电子式表示溴化钙的形成过程 3、离子键的强弱根据离子键的成因,离子键的强弱取决于成键离子的半径以及所带电荷数,由于两者一般不矛盾,所以通常可以直接通过阴阳离子的半径大小来判断离子键的强弱。
如比较NaCl和MgCl2 NaCl和NaBr 碘 +→ 用电子式表示下列共价分子的形成过程水 二氧化碳 氨 2 H ·+→硫化氢2 H ·+→3 H ·+→+2→定义:原子之间通过共用电子对所形成的相互作用,叫做共价键。成键微粒:原子相互作用:共用电子对成键元素:同种或不同种非金属元素含有共价键的化合物不一定是共价化合物共价键 氢氧化钠晶体中,钠离子与氢氧根离子以
离子键结合;在氢氧根离子中,氢与氧以共价
键结合。请用电子式表示氢氧化钠。 [ ] +- 过氧化钠晶体中,过氧根离子 (O2 ) 2-与钠
离子以离子键结合;在过氧根离子中,两个氧
原子以共价键结合。请用电子式表示过氧化钠。[ ]++2-离子键和共价键的比较共价键的强弱共价键的强弱主要取决与成键原子的半径,成键原子半径越大,则共价键越弱。分子间作用力的特点1.广泛存在(由分子构成的物质)2.作用范围小3.作用力弱4.主要影响物质的物理性质(熔沸点)相邻的原子间强烈的相互作用把分子聚集在一起的作用力分子内原子间分子之间较 强与化学键相比弱的多主要影响化学性质主要影响物理性质(如熔沸点)化学键与分子间作用力的比较卤族元素单质物理性质差异4.氢键对物质性质的影响⑴氢键的存在使物质的熔沸点相对较高⑵解释一些反常现象:如水结成冰时,为什么体积会膨胀。一 碳的几种同素异形体二 氧的同素异形体 O2O3颜色无色淡蓝气味无味有特殊臭味性质氧化性强氧化性(做消毒剂)三 磷的同素异形体不仅熔沸点有差异,且化学性质也存在差异,如乙醇可与金属钠反应,而二甲醚就不与金属钠反应.定义:一、离子晶体实例:食盐、氯化铯物理性质:形成离子晶体的物质: 离子化合物中的阴、阳离子按一定的方式有规则
地排列而形成的晶体叫做离子晶体。 具有较高的熔沸点,在熔融状态或水溶液中能
导电,有些离子晶体溶于水,有些难溶于水KOH 、 CuSO4、
NH4Cl 、 CaO、等离子化合物
二、分子晶体分子晶体:分子晶体的物理性质:定义:实例:如干冰、冰等共价化合物形成分子晶体的物质: 熔、沸点低,硬度小,在水
中的溶解度存在很大的差异。H2、Cl2、He 、HCl 、H2O、CO2等 分子间通过分子间作用力相
结合的晶体,叫做分子晶体。三、原子晶体定义:实例:原子晶体的物理性质:如二氧化硅晶体、金刚石常见的原子晶体:熔沸点很高,硬度很大,难溶于水,
一般不导电。金刚石、金刚砂(SiC)、
晶体硅、石英(SiO2) 这种相邻原子通过共价键结合而形成
空间网状结构的晶体,叫做原子晶体。小结1、离子晶体、分子晶体、原子晶体结构与性质关系的比较:阴、阳离子分子原子金属阳离子和自由移动电子离子键分子间
作用力共价键金属键差距大大小较大较大小高差距大导电不导电溶液有些导电熔融或溶液导电
