2.3.1 化学能转化为电能 ppt课件1-苏教版[下学期]
文档属性
| 名称 | 2.3.1 化学能转化为电能 ppt课件1-苏教版[下学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 837.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-04-08 00:00:00 | ||
图片预览








文档简介
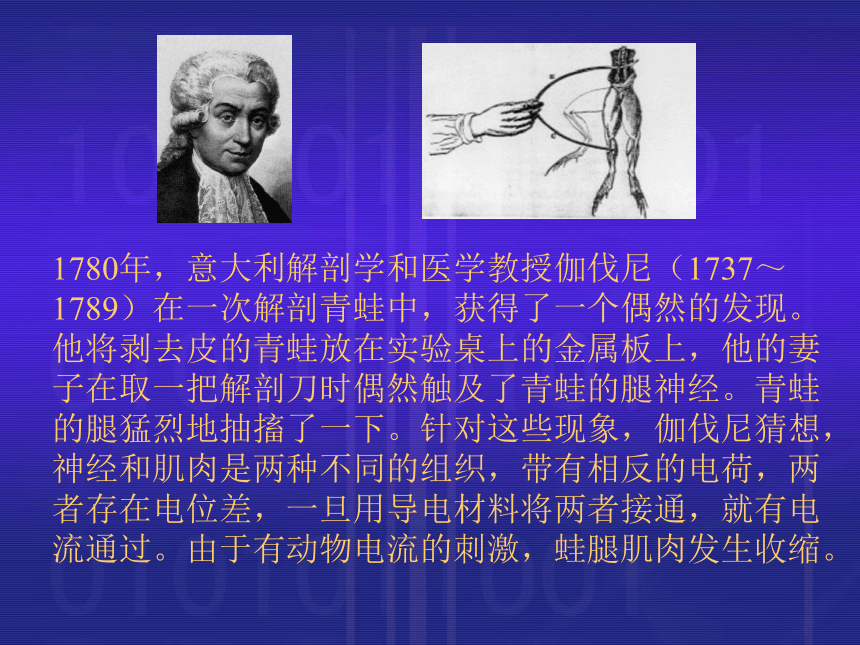
课件21张PPT。化学能转化为电能伽伐尼(galvanism )伏打(Alessandro Volta)1780年,意大利解剖学和医学教授伽伐尼(1737~1789)在一次解剖青蛙中,获得了一个偶然的发现。他将剥去皮的青蛙放在实验桌上的金属板上,他的妻子在取一把解剖刀时偶然触及了青蛙的腿神经。青蛙的腿猛烈地抽搐了一下。针对这些现象,伽伐尼猜想,神经和肌肉是两种不同的组织,带有相反的电荷,两者存在电位差,一旦用导电材料将两者接通,就有电流通过。由于有动物电流的刺激,蛙腿肌肉发生收缩。 1791年意大利物理学家亚历山德罗.伏打(Alessandro Volta,1745~1827)(右图)得知伽伐尼的这一发现,引起了他的极大兴趣,做了一系列实验,甚至还在自己身上做实验。通过研究,伏打认为蛙腿只是起了显示电流通过的作用,所谓特殊的“动物电”是不存在的。伽伐尼实验中连接起来的是两种不同的金属和含有液体的青蛙肌肉。伏打用几只碗盛了盐水,把几对黄铜和锌做成的电极连接起来,就有电流产生。1800年3月20日,伏打宣布了这个重要的发现,这就是著名的“伏打电池”(右图)。 请思考下列问题:
1.伽伐尼和伏打对“动物电”见解有何本质区别?
2.两种不同的金属用导线连接,在一定条件下,为什么会产生电流?
3.“伏打电池”的发明给你什么启示?在容器中加入约2/3容积的稀硫酸,请按下列要求实验并记录实验现象:1.将一块铜片和一块锌片分别插入盛有稀硫酸的烧杯中。
2.将一块铜片和一块锌片同时插入盛有稀硫酸的烧杯中。(铜片和锌片不 要接触)
3.用导线把锌片和铜片连接起来,插入盛有稀硫酸的烧杯中。
4.在锌片和铜片的导线中间连接一个灵敏电流计,插入盛有稀硫酸的烧杯中。 铜片上没有明显现象,锌片上有无色气体产生。铜片上没有明显现象,锌片上有无色气体产生。铜片上有无色气体产生,锌片无明显现象。铜片上有无色气体产生,锌片无明显现象,电流计发生偏转。H+在铜片上得到电子被还原成氢气。H+在铜片上得到电子被还原成氢气,有电流产生。思考下列问题:
1、实验1或2(锌片和铜片分别插入稀硫酸中)与实验步骤3(用电线把锌片连接起来插入盛有稀硫酸的容器中)发生的现象有什么不同?
2、为什么当锌片与铜片连接后插入稀硫酸中,在铜片上有气泡产生?锌片铜片上可能各发生了什么反应?
3、灵敏电流计显示有电流通过,电流是如何产生的?演示请看还原剂(Zn)失去电子,发生氧化反应氧化剂(H+)在铜极上得到电子,发生还原反应还原剂失去的电子从锌极流出流入铜极.经外电路Zn2+H+SO42-电流方向1、原电池是如何构成的?用_____连接_______________________极板插入____________中。在原电池中,______金属极板发生氧化反应,电子经导线从_______金属一极流向________金属极板,溶液中易得到电子的______在不活泼的金属极板发生________。 在原电池中,相对活泼的金属为___极,相对不活泼的金属(或石墨电极)为___极。上述原电池发生的反应是: 在锌电极(负极): ________________ 在铜电极(正极):_________________ 电子流方向:电子流从原电池的_____经导线流向_____。 溶液中离子运动方向:阳离子向____运动,阴离子向____运动。电流方向:电流从原电池的____经导线流向____。再从_____经内电路流向______,从而形成闭合回路。你知道了吗?2、原电池是如何工作的?导线两块活动性不同的金属电解质溶液较活泼较活泼较不活泼阳离子还原反应负正Zn-2e-=Zn2+负极正极正极负极正极负极负极正极练1:判断下列装置,哪些能形成原电池练一练练习2如图装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的哪一组( ) A、A是锌,B是铜,C为稀H2SO4
B、A是铜,B是锌,C为稀硫酸
C、A是铁,B是银,C为AgNO3溶液
D、A是Ag,B是铁,C为AgNO3溶液 走近化学电源空气电池锂电池干电池 上图是锌-锰干电池 随着用电器朝着
小型化、多功能化发
展的要求,对电池的
发展也提出了小型化、
多功能化发展的要求。 体积小、性能好的碱性锌-锰电池应运
而生。这类电池的重要特征是电解液由原来
的中性变为离子导电性更好的碱性,负极也由
锌片改为锌粉,反应面积成倍增长,使放电电
流大幅度提高。铅蓄电池锂电池 锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。新型燃料电池 燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池LET'S GO!试一试请利用水果、铜片、锌片、若干导线和小耳机制作一个水果电池,并检验其是否能产生电流。再见
1.伽伐尼和伏打对“动物电”见解有何本质区别?
2.两种不同的金属用导线连接,在一定条件下,为什么会产生电流?
3.“伏打电池”的发明给你什么启示?在容器中加入约2/3容积的稀硫酸,请按下列要求实验并记录实验现象:1.将一块铜片和一块锌片分别插入盛有稀硫酸的烧杯中。
2.将一块铜片和一块锌片同时插入盛有稀硫酸的烧杯中。(铜片和锌片不 要接触)
3.用导线把锌片和铜片连接起来,插入盛有稀硫酸的烧杯中。
4.在锌片和铜片的导线中间连接一个灵敏电流计,插入盛有稀硫酸的烧杯中。 铜片上没有明显现象,锌片上有无色气体产生。铜片上没有明显现象,锌片上有无色气体产生。铜片上有无色气体产生,锌片无明显现象。铜片上有无色气体产生,锌片无明显现象,电流计发生偏转。H+在铜片上得到电子被还原成氢气。H+在铜片上得到电子被还原成氢气,有电流产生。思考下列问题:
1、实验1或2(锌片和铜片分别插入稀硫酸中)与实验步骤3(用电线把锌片连接起来插入盛有稀硫酸的容器中)发生的现象有什么不同?
2、为什么当锌片与铜片连接后插入稀硫酸中,在铜片上有气泡产生?锌片铜片上可能各发生了什么反应?
3、灵敏电流计显示有电流通过,电流是如何产生的?演示请看还原剂(Zn)失去电子,发生氧化反应氧化剂(H+)在铜极上得到电子,发生还原反应还原剂失去的电子从锌极流出流入铜极.经外电路Zn2+H+SO42-电流方向1、原电池是如何构成的?用_____连接_______________________极板插入____________中。在原电池中,______金属极板发生氧化反应,电子经导线从_______金属一极流向________金属极板,溶液中易得到电子的______在不活泼的金属极板发生________。 在原电池中,相对活泼的金属为___极,相对不活泼的金属(或石墨电极)为___极。上述原电池发生的反应是: 在锌电极(负极): ________________ 在铜电极(正极):_________________ 电子流方向:电子流从原电池的_____经导线流向_____。 溶液中离子运动方向:阳离子向____运动,阴离子向____运动。电流方向:电流从原电池的____经导线流向____。再从_____经内电路流向______,从而形成闭合回路。你知道了吗?2、原电池是如何工作的?导线两块活动性不同的金属电解质溶液较活泼较活泼较不活泼阳离子还原反应负正Zn-2e-=Zn2+负极正极正极负极正极负极负极正极练1:判断下列装置,哪些能形成原电池练一练练习2如图装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的哪一组( ) A、A是锌,B是铜,C为稀H2SO4
B、A是铜,B是锌,C为稀硫酸
C、A是铁,B是银,C为AgNO3溶液
D、A是Ag,B是铁,C为AgNO3溶液 走近化学电源空气电池锂电池干电池 上图是锌-锰干电池 随着用电器朝着
小型化、多功能化发
展的要求,对电池的
发展也提出了小型化、
多功能化发展的要求。 体积小、性能好的碱性锌-锰电池应运
而生。这类电池的重要特征是电解液由原来
的中性变为离子导电性更好的碱性,负极也由
锌片改为锌粉,反应面积成倍增长,使放电电
流大幅度提高。铅蓄电池锂电池 锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。新型燃料电池 燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池LET'S GO!试一试请利用水果、铜片、锌片、若干导线和小耳机制作一个水果电池,并检验其是否能产生电流。再见
