江苏省 原电池[下学期]
图片预览






文档简介
课件18张PPT。化学能转化为电能§3.1化学能转化为电能实验探究:
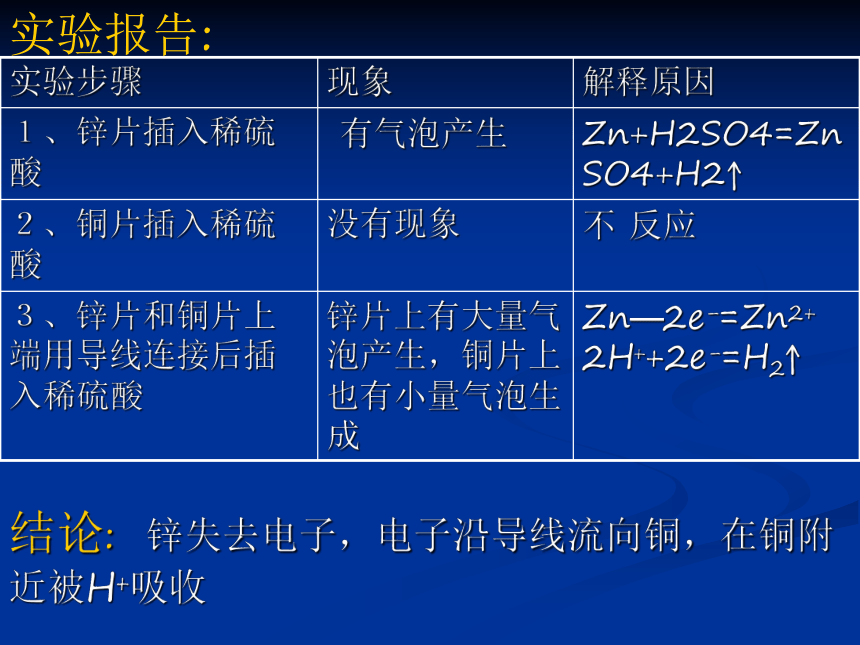
实验1.将锌片和铜片分别插入稀硫酸中
实验2.将锌片和铜片同时插入稀硫酸中
实验3.将锌片和铜片用导线连接后插入稀硫酸中 思考:
1、铜片上的气体是什么?
2、氢元素原来以什么形式存在?
3、氢离子转变为氢气是得电子还是失电 子?
4、所得的电子从何而来?实验报告:结论: 锌失去电子,电子沿导线流向铜,在铜附近被H+吸收疑问?
假如上述推论正确,按照电子定向移动形成电流的原
理,在实验3中应形成电流。那么,用什么来检验电流的存在?实验探究:
实验4.在导线中间连接一个灵敏电流计
注意事项:正负极接法 实验报告: 【学生小结】
锌片: 较活泼,电子流出,发生氧化反应 Zn-2e - = Zn 2+铜片: 较不活泼,电子流入,发生还原反应 2H++2e - = H2↑能量变化: 化学能转变为电能结论: 这种把化学能转化为电能的装置叫原电池伏打和伏打电池
伏打(1745-1827),意大利科学家。他于1799年捕捉到原电池的实验现象,并加以研究,发明了世界上第一个电池——伏打电池,即原电池思考: 1、如何使用电流表检验干电池的正负极?实验探究:
实验5.给你一节干电池,用实验证明铜锌原电池的正负极结论:原电池的原理:
负极:电子流出,较活泼,(锌片):Zn -2e - = Zn2+ (氧化反应)
正极:电子流入,较不活泼,(铜片):2H++2e - = H2↑(还原反应)试试看:
写出铜锌原电池的总反应方程式,并比较其与锌片直接跟稀硫酸反应有何异同。 总反应方程式为:Zn + 2H+ = Zn2+ + H2 ↑
相同点:总反应方程式相同
不同点:电子转移途径不同原电池的实质是氧化还原反应,氧化还原反应都可以设计成原电池,那么构成原电池要有哪些条件呢? 总结:组成原电池的条件:
①有两种活动性不同的金属作电极
②电极材料均插入电解质溶液中
③两极相连形成闭合回路思考:
正极材料发生变化吗?负极和电解质溶液之间发生了什么反应?正极材料本身并未发生变化,负极和电解质溶液之间发生了氧化还原反应 试一试:请同学结合组成原电池的条件,将氧化还原反应:Fe + Cu2+ = Cu + Fe2+ 设计成一个原电池。人们利用原电池的原理制作了多种电池作为一个电池的消费者,你希望使用怎样的电池?假如你是一个电池的研究生产者,你应该开发生产怎样的电池?
在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用本课小结一、原电池的概念
二、原电池的原理
三、原电池的形成条件
四、原电池原理的应用课后探究1、 回家搜集废干电池并拆开,弄清它的构造及原理
2、观察铁在不同环境下腐蚀的情况并加以分析谢谢大家!
实验1.将锌片和铜片分别插入稀硫酸中
实验2.将锌片和铜片同时插入稀硫酸中
实验3.将锌片和铜片用导线连接后插入稀硫酸中 思考:
1、铜片上的气体是什么?
2、氢元素原来以什么形式存在?
3、氢离子转变为氢气是得电子还是失电 子?
4、所得的电子从何而来?实验报告:结论: 锌失去电子,电子沿导线流向铜,在铜附近被H+吸收疑问?
假如上述推论正确,按照电子定向移动形成电流的原
理,在实验3中应形成电流。那么,用什么来检验电流的存在?实验探究:
实验4.在导线中间连接一个灵敏电流计
注意事项:正负极接法 实验报告: 【学生小结】
锌片: 较活泼,电子流出,发生氧化反应 Zn-2e - = Zn 2+铜片: 较不活泼,电子流入,发生还原反应 2H++2e - = H2↑能量变化: 化学能转变为电能结论: 这种把化学能转化为电能的装置叫原电池伏打和伏打电池
伏打(1745-1827),意大利科学家。他于1799年捕捉到原电池的实验现象,并加以研究,发明了世界上第一个电池——伏打电池,即原电池思考: 1、如何使用电流表检验干电池的正负极?实验探究:
实验5.给你一节干电池,用实验证明铜锌原电池的正负极结论:原电池的原理:
负极:电子流出,较活泼,(锌片):Zn -2e - = Zn2+ (氧化反应)
正极:电子流入,较不活泼,(铜片):2H++2e - = H2↑(还原反应)试试看:
写出铜锌原电池的总反应方程式,并比较其与锌片直接跟稀硫酸反应有何异同。 总反应方程式为:Zn + 2H+ = Zn2+ + H2 ↑
相同点:总反应方程式相同
不同点:电子转移途径不同原电池的实质是氧化还原反应,氧化还原反应都可以设计成原电池,那么构成原电池要有哪些条件呢? 总结:组成原电池的条件:
①有两种活动性不同的金属作电极
②电极材料均插入电解质溶液中
③两极相连形成闭合回路思考:
正极材料发生变化吗?负极和电解质溶液之间发生了什么反应?正极材料本身并未发生变化,负极和电解质溶液之间发生了氧化还原反应 试一试:请同学结合组成原电池的条件,将氧化还原反应:Fe + Cu2+ = Cu + Fe2+ 设计成一个原电池。人们利用原电池的原理制作了多种电池作为一个电池的消费者,你希望使用怎样的电池?假如你是一个电池的研究生产者,你应该开发生产怎样的电池?
在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用本课小结一、原电池的概念
二、原电池的原理
三、原电池的形成条件
四、原电池原理的应用课后探究1、 回家搜集废干电池并拆开,弄清它的构造及原理
2、观察铁在不同环境下腐蚀的情况并加以分析谢谢大家!
