微粒之间的相互作用[下学期]
图片预览





文档简介
(共35张PPT)
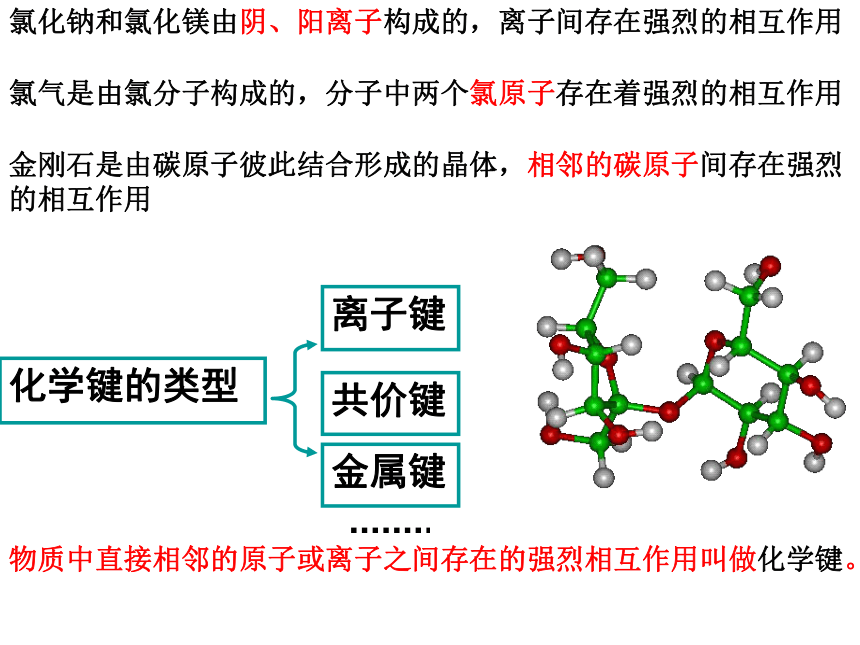
氯化钠和氯化镁由阴、阳离子构成的,离子间存在强烈的相互作用
氯气是由氯分子构成的,分子中两个氯原子存在着强烈的相互作用
金刚石是由碳原子彼此结合形成的晶体,相邻的碳原子间存在强烈的相互作用
物质中直接相邻的原子或离子之间存在的强烈相互作用叫做化学键。
化学键的类型
离子键
共价键
金属键
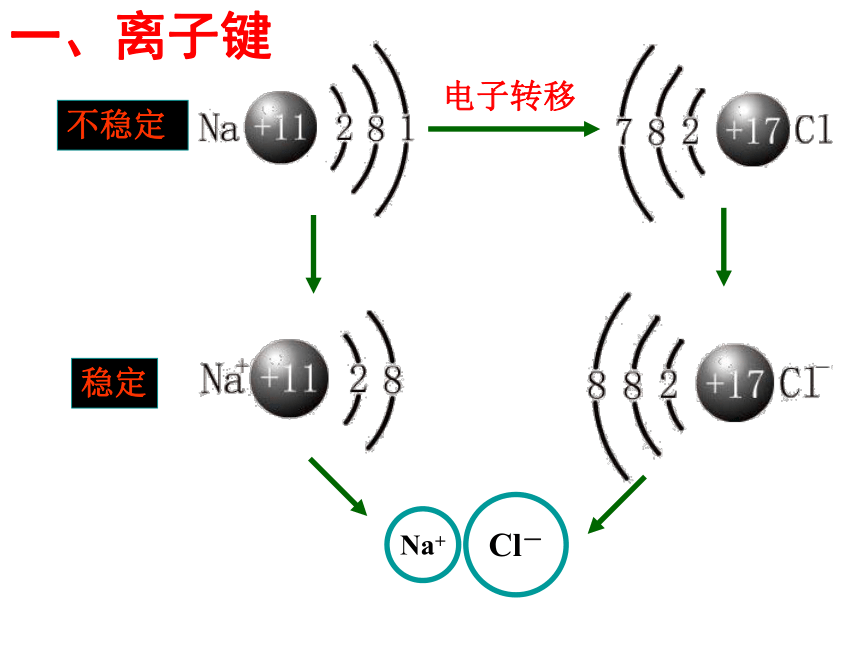
Na+
Cl-
电子转移
不稳定
稳定
一、离子键
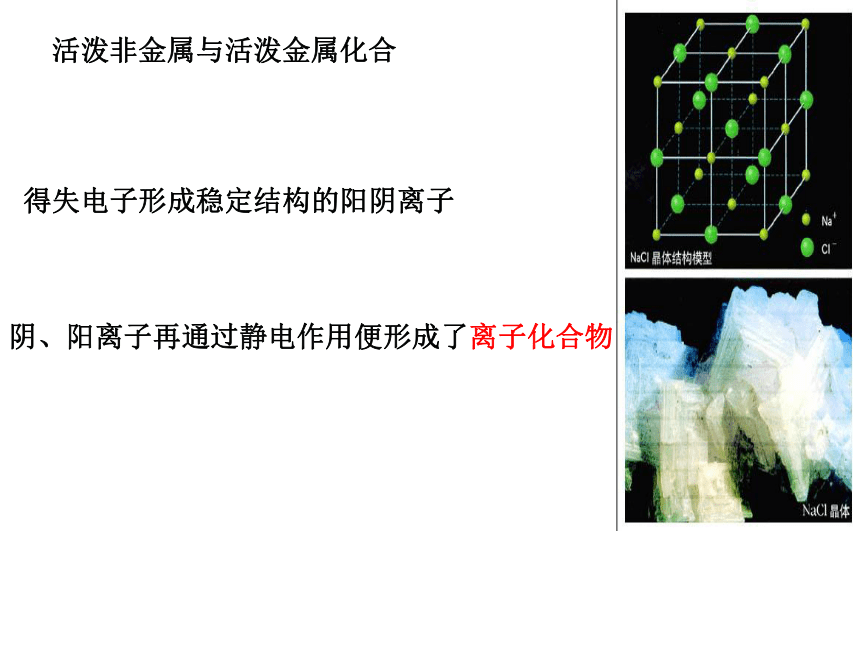
活泼非金属与活泼金属化合
得失电子形成稳定结构的阳阴离子
阴、阳离子再通过静电作用便形成了离子化合物
离子键:使带相反电荷的阴、阳离子结合的相互作用。
成键微粒:阴、阳离子。
相互作用:静电作用。
含有离子键的化合物就是离子化合物。
离子键
IA,IIA和VIA,VIIA之间的化合物。
活泼金属元素和酸根离子
铵根离子和酸根离子(或活泼非金属元素)
目的:使双方最外电子层均达到稳定结构
NaCl,MgCl2,Na2O,MgO
NaNO3,MgSO4,NaOH
NH4Cl,NH4NO3
(二)共价键
··
· Cl
··
:
H ·
+
→
Cl
··
··
:
H
··
··
通过共用电子对—形成共价键
成键微粒:原子
相互作用:共用电子对
成键元素:同种或不同种非金属元素
共价键
原子之间通过共用电子对所形成的强烈的相互作用称为共价键。
使双方最外电子层均达到稳定结构
共价化合物:直接相邻原子间均以共价键相结合的化合物
共价化合物只含共价键,不含离子键但离子化合物可含共价键。
HCl,CH4,HNO3,NH4NO3,NaOH
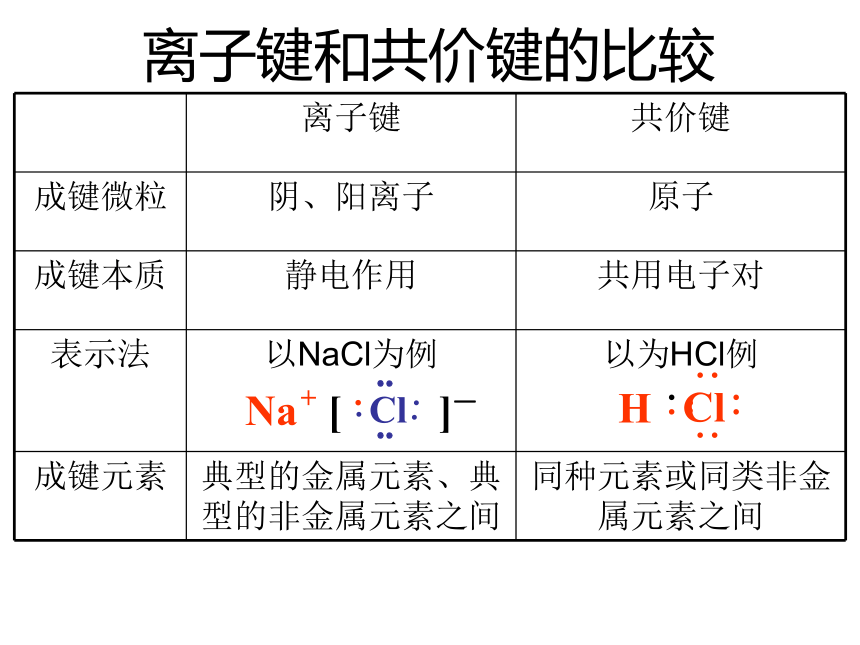
离子键和共价键的比较
离子键 共价键
成键微粒 阴、阳离子 原子
成键本质 静电作用 共用电子对
表示法 以NaCl为例
以为HCl例
成键元素 典型的金属元素、典型的非金属元素之间 同种元素或同类非金属元素之间
[ ]
+
-
·
Na
Cl
·
·
:
:
·
Cl
··
··
:
H
··
··
使离子键断裂或使气态分子中共价键断裂,则要吸收能量。
化学反应本质是旧化学键断裂和新化学键形成
阴、阳离子通过离子键相互结合形成化合物,原子间通过共价键形成分子的过程中要放出能量
电子式:离子化合物共价化合物用“ · ”或“×”来表示原子最外层电子,表示原子、离子的最外层的电子排布的式子
共价化合物分子可用电子式和结构式表示
结构式:共价化合物用一条短线线表示一对共用电子对
离子化合物分子可用电子式
结构简式:共价化合物中有机化合物也用结构简式
(1)原子的电子式:
(2)阳离子的电子式:不画出离子最外层电子数,元素右上角标出“n+”电荷字样。
(3)阴离子的电子式:要画出最外层电子数,用 “[ ]”括起来,右上角标出“n·-”
H ·
Na ·
Cl ·
··
··
··
H+
Na+
[ O ]2-
··
··
:
:
[ Cl ]-
··
··
:
:
(4)离子化合物的电子式:由阴、阳离子的电子式组成,相同离子不能合并
(4)共价化合物的电子式:画出离子最外层电子数
离子化合物的电子式:由阴、阳离子的电子式组成,但对相同离子不能合并
AB型
AB2型
A2B型
用电子式、结构式表示共价化合物
水
二氧化碳
﹕
H O H
﹕
﹕
﹕
:N N :
﹕
﹕
﹕
氯化氢
Cl
··
··
H
··
··
氮气
﹕
O C O
﹕
﹕
﹕
﹕
﹕
﹕
﹕
结构式
H Cl
结构式
结构式
结构式
N N
H O H
O C O
课堂练习
练习1、下列说法正确的是:
A.离子键就是使阴、阳离子结合成化合物
的静电引力
B.所有金属与所有非金属原子之间都能形
成离子键
C.在化合物CaCl2中,两个氯离子之间也存
在离子键
D.活泼金属元素与活泼非金属元素化合时,形成离子键
D
练习2、下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是:
A.10与12 B.8与17
C.11与17 D.6与14
C
小结
离子键:使带相反电荷的阴、阳离子结合的相互作用。
含有离子键的化合物就是离子化合物。
金属,铵根离子
共价键:原子之间通过共用电子对所形成的强烈的相互作用
共价化合物:直接相邻原子间均以共价键相结合的化合物
共价化合物只含共价键,不含离子键但离子化合物可含共价键。
HCl,CH4,HNO3
议一议:干冰受热时很容易气化,而CO2气体加热到很高温度也不分解,这是为什么?
干冰(构成微粒
CO2分子)
CO2气体
吸收能量
晶体中CO2分子不能自由移动,只能在平衡位置作振动
构成微粒仍是CO2分子,CO2分子能自由移动
克服分子间作
用力
(三)分子间作用力
干冰气化克服:分子间作用力
CO2气体分解克服:碳氧原子的共价键
分子间作用力与化学键是两种强度不同、作用对象不同的作用力
①分子间作用力:分子间存在着将分子聚集在一起的作用力,称分子间作用力,又叫范德华力。
②分子间作用力比化学键弱得多,是一种存在于分子之间的,较弱的相互作用。
分子间作用力是影响物质熔沸点和溶解性的重要因素之一
冰
液态水
水蒸汽
吸收能量
吸收能量
克服分子间作用力
分子间作用力的大小决定了物质熔沸点的高低
对于由分子构成的物质而言,若结构
相似,则分子量越大,熔沸点越高
水的物理性质十分特殊,除熔沸点高外,水的比热容较大
结论:H2O分子间存在着一种特殊作用,这种作用比化学键弱,但比范德华力强,是一种特殊的分子间作用力——氢键
水分子间的氢键:一个水分子中的氢原子与另一个水分子中的氧原子间的分子间作用力。
氯化钠和氯化镁由阴、阳离子构成的,离子间存在强烈的相互作用
氯气是由氯分子构成的,分子中两个氯原子存在着强烈的相互作用
金刚石是由碳原子彼此结合形成的晶体,相邻的碳原子间存在强烈的相互作用
物质中直接相邻的原子或离子之间存在的强烈相互作用叫做化学键。
化学键的类型
离子键
共价键
金属键
Na+
Cl-
电子转移
不稳定
稳定
一、离子键
活泼非金属与活泼金属化合
得失电子形成稳定结构的阳阴离子
阴、阳离子再通过静电作用便形成了离子化合物
离子键:使带相反电荷的阴、阳离子结合的相互作用。
成键微粒:阴、阳离子。
相互作用:静电作用。
含有离子键的化合物就是离子化合物。
离子键
IA,IIA和VIA,VIIA之间的化合物。
活泼金属元素和酸根离子
铵根离子和酸根离子(或活泼非金属元素)
目的:使双方最外电子层均达到稳定结构
NaCl,MgCl2,Na2O,MgO
NaNO3,MgSO4,NaOH
NH4Cl,NH4NO3
(二)共价键
··
· Cl
··
:
H ·
+
→
Cl
··
··
:
H
··
··
通过共用电子对—形成共价键
成键微粒:原子
相互作用:共用电子对
成键元素:同种或不同种非金属元素
共价键
原子之间通过共用电子对所形成的强烈的相互作用称为共价键。
使双方最外电子层均达到稳定结构
共价化合物:直接相邻原子间均以共价键相结合的化合物
共价化合物只含共价键,不含离子键但离子化合物可含共价键。
HCl,CH4,HNO3,NH4NO3,NaOH
离子键和共价键的比较
离子键 共价键
成键微粒 阴、阳离子 原子
成键本质 静电作用 共用电子对
表示法 以NaCl为例
以为HCl例
成键元素 典型的金属元素、典型的非金属元素之间 同种元素或同类非金属元素之间
[ ]
+
-
·
Na
Cl
·
·
:
:
·
Cl
··
··
:
H
··
··
使离子键断裂或使气态分子中共价键断裂,则要吸收能量。
化学反应本质是旧化学键断裂和新化学键形成
阴、阳离子通过离子键相互结合形成化合物,原子间通过共价键形成分子的过程中要放出能量
电子式:离子化合物共价化合物用“ · ”或“×”来表示原子最外层电子,表示原子、离子的最外层的电子排布的式子
共价化合物分子可用电子式和结构式表示
结构式:共价化合物用一条短线线表示一对共用电子对
离子化合物分子可用电子式
结构简式:共价化合物中有机化合物也用结构简式
(1)原子的电子式:
(2)阳离子的电子式:不画出离子最外层电子数,元素右上角标出“n+”电荷字样。
(3)阴离子的电子式:要画出最外层电子数,用 “[ ]”括起来,右上角标出“n·-”
H ·
Na ·
Cl ·
··
··
··
H+
Na+
[ O ]2-
··
··
:
:
[ Cl ]-
··
··
:
:
(4)离子化合物的电子式:由阴、阳离子的电子式组成,相同离子不能合并
(4)共价化合物的电子式:画出离子最外层电子数
离子化合物的电子式:由阴、阳离子的电子式组成,但对相同离子不能合并
AB型
AB2型
A2B型
用电子式、结构式表示共价化合物
水
二氧化碳
﹕
H O H
﹕
﹕
﹕
:N N :
﹕
﹕
﹕
氯化氢
Cl
··
··
H
··
··
氮气
﹕
O C O
﹕
﹕
﹕
﹕
﹕
﹕
﹕
结构式
H Cl
结构式
结构式
结构式
N N
H O H
O C O
课堂练习
练习1、下列说法正确的是:
A.离子键就是使阴、阳离子结合成化合物
的静电引力
B.所有金属与所有非金属原子之间都能形
成离子键
C.在化合物CaCl2中,两个氯离子之间也存
在离子键
D.活泼金属元素与活泼非金属元素化合时,形成离子键
D
练习2、下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是:
A.10与12 B.8与17
C.11与17 D.6与14
C
小结
离子键:使带相反电荷的阴、阳离子结合的相互作用。
含有离子键的化合物就是离子化合物。
金属,铵根离子
共价键:原子之间通过共用电子对所形成的强烈的相互作用
共价化合物:直接相邻原子间均以共价键相结合的化合物
共价化合物只含共价键,不含离子键但离子化合物可含共价键。
HCl,CH4,HNO3
议一议:干冰受热时很容易气化,而CO2气体加热到很高温度也不分解,这是为什么?
干冰(构成微粒
CO2分子)
CO2气体
吸收能量
晶体中CO2分子不能自由移动,只能在平衡位置作振动
构成微粒仍是CO2分子,CO2分子能自由移动
克服分子间作
用力
(三)分子间作用力
干冰气化克服:分子间作用力
CO2气体分解克服:碳氧原子的共价键
分子间作用力与化学键是两种强度不同、作用对象不同的作用力
①分子间作用力:分子间存在着将分子聚集在一起的作用力,称分子间作用力,又叫范德华力。
②分子间作用力比化学键弱得多,是一种存在于分子之间的,较弱的相互作用。
分子间作用力是影响物质熔沸点和溶解性的重要因素之一
冰
液态水
水蒸汽
吸收能量
吸收能量
克服分子间作用力
分子间作用力的大小决定了物质熔沸点的高低
对于由分子构成的物质而言,若结构
相似,则分子量越大,熔沸点越高
水的物理性质十分特殊,除熔沸点高外,水的比热容较大
结论:H2O分子间存在着一种特殊作用,这种作用比化学键弱,但比范德华力强,是一种特殊的分子间作用力——氢键
水分子间的氢键:一个水分子中的氢原子与另一个水分子中的氧原子间的分子间作用力。
