第二单元化学反应中的热量第一课时[下学期]
文档属性
| 名称 | 第二单元化学反应中的热量第一课时[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 986.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-04-11 16:03:00 | ||
图片预览








文档简介
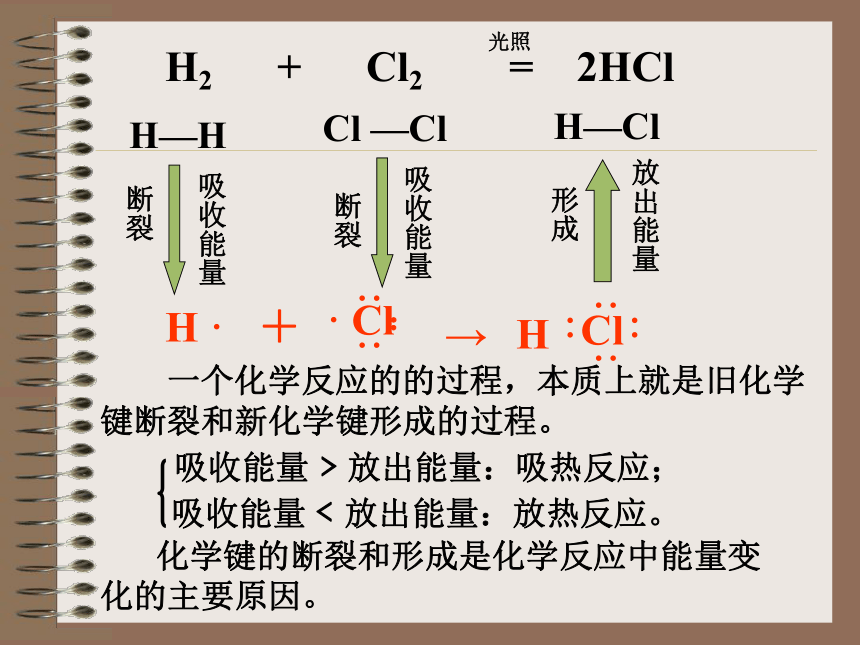
课件23张PPT。第二单元 化学反应中的热量(第一课时)【你知道吗】 生活中哪些事实说明了在化学反应中伴随着能量的变化?请说出能量转化的方式。【归纳总结】化学能转化为光能和热能化学能转化为光能和热能化学能转化为电能电能转化为化学能热能转化为化学能【活动与探究】 化学反应中的热量变化【实验1】 向一支试管中放入用砂纸打磨光亮的镁条,加入5mL2mol/L盐酸,用手触摸试管外壁,有什么感觉?【实验2】 向完好的塑料薄膜袋中加入约7g 氢氧化钙,再加入约10g NH4Cl晶体,排出袋内空气,扎紧袋口,将固体混匀,使之充分反应。反应混合物的温度有什么变化?用手触摸塑料袋感受一下。有热量放出的化学反应叫做放热反应。 吸收热量的化学反应叫做吸热反应。【整理与归纳】 用化学键的观点来分析化学反应的本质过程是什么?【理论分析】H ·+→H2 + Cl2 = 2HClH—H Cl —ClH—Cl断裂断裂形成光照放出能量 一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。 化学键的断裂和形成是化学反应中能量变化的主要原因。 已知断开1molH2中的 H-H键需要吸收436.4kJ能量,断开1molCl2中的Cl-Cl键需要吸收242.7kJ能量,生成1molHCl中的H-Cl键放出431.8kJ能量.试说明H2 + Cl2 = 2HCl是吸热反应还是放热反应. 【问题解决】E反应历程△E = kJ吸收436.4 kJ (H2)
吸收242.7 kJ(Cl2)放出2×431.8 kJ
= 863.6 kJ184.5(注:1mol H2和1mol Cl2反应)放热反应的逆反应一定是吸热反应吗?
如:2HCl = H2 + Cl2是吸热反应吗? ? E184.5反应物的总能量=生成物的总能量+放出的热量生成物的总能量=反应物的总能量+吸收的热量放热反应吸热反应放热反应吸热反应 化学反应的过程,也可以看成是能量的“释放” 或“贮存”的过程。 常见的放热反应、吸热反应放热
反应吸热
反应【整理与归纳】1.下列说法不正确的是 ( )
A、化学反应除了生成新物质外,还
伴随着能量的变化
B、化学反应中能量变化一定表现为
热量变化
C、反应物的总能量高于生成物的总
能量时,发生放热反应
D、吸热反应贮备能量B检测2. 下列反应既属于氧化还原反应,又属于吸热反应的是 ( )A.铝片与稀盐酸的反应
B.Ba(OH)2·8H2O和NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在氧气中的燃烧反应C 3. 下列说法正确的是 ( )
A. 大多数的化合反应是释放能量的反应
B. 大多数分解反应是吸收能量的反应
C. 放热反应不需要加热即可发生
D. 需要加热的化学反应都是吸热反应AB4. 下列反应中生成物总能量高于反应物总能量的是 ( )A.碳酸钙受热分解
B.乙醇燃烧
C.铝粉与氧化铁粉末反应
D.氧化钙溶于水A5.如图所示,向试管中加入几块铝片,再把试管放入盛有25℃饱和石灰水的小烧杯中,用铁夹固定,然后用胶头滴管加入5mL盐酸。试回答下列问题:
(1)实验时烧杯中产生的
现象是 。
(2)产生上述现象的原因
是
(3)由实验推知,AlCl3
和H2的总能量 (选填
“大于”“小于”或“等于”)
Al和HCl的总能量。出现白色沉淀(或溶液变浑浊)铝片与盐酸反应放出热量,温度升高,而Ca(OH)2的溶解度随着温度的升高而减少。小于1、物质发生化学反应的同时还伴随着能量的变化,而这种能量变化又通常表现为热能变化。2、化学键的断裂和形成是化学反应中能量变化的主要原因。3、一个确定的化学反应在发生过程中是吸
收能量还是放出能量,取决于反应物的总
能量与生成物的总能量的相对大小。4、化学反应中能量转化遵循能量守恒原则。【本节小结】【作业】1.教材p37第5题
2.常规训练
3.查阅资料,制作化学冰袋、化学暖袋。
吸收242.7 kJ(Cl2)放出2×431.8 kJ
= 863.6 kJ184.5(注:1mol H2和1mol Cl2反应)放热反应的逆反应一定是吸热反应吗?
如:2HCl = H2 + Cl2是吸热反应吗? ? E184.5反应物的总能量=生成物的总能量+放出的热量生成物的总能量=反应物的总能量+吸收的热量放热反应吸热反应放热反应吸热反应 化学反应的过程,也可以看成是能量的“释放” 或“贮存”的过程。 常见的放热反应、吸热反应放热
反应吸热
反应【整理与归纳】1.下列说法不正确的是 ( )
A、化学反应除了生成新物质外,还
伴随着能量的变化
B、化学反应中能量变化一定表现为
热量变化
C、反应物的总能量高于生成物的总
能量时,发生放热反应
D、吸热反应贮备能量B检测2. 下列反应既属于氧化还原反应,又属于吸热反应的是 ( )A.铝片与稀盐酸的反应
B.Ba(OH)2·8H2O和NH4Cl的反应
C.灼热的炭与CO2的反应
D.甲烷在氧气中的燃烧反应C 3. 下列说法正确的是 ( )
A. 大多数的化合反应是释放能量的反应
B. 大多数分解反应是吸收能量的反应
C. 放热反应不需要加热即可发生
D. 需要加热的化学反应都是吸热反应AB4. 下列反应中生成物总能量高于反应物总能量的是 ( )A.碳酸钙受热分解
B.乙醇燃烧
C.铝粉与氧化铁粉末反应
D.氧化钙溶于水A5.如图所示,向试管中加入几块铝片,再把试管放入盛有25℃饱和石灰水的小烧杯中,用铁夹固定,然后用胶头滴管加入5mL盐酸。试回答下列问题:
(1)实验时烧杯中产生的
现象是 。
(2)产生上述现象的原因
是
(3)由实验推知,AlCl3
和H2的总能量 (选填
“大于”“小于”或“等于”)
Al和HCl的总能量。出现白色沉淀(或溶液变浑浊)铝片与盐酸反应放出热量,温度升高,而Ca(OH)2的溶解度随着温度的升高而减少。小于1、物质发生化学反应的同时还伴随着能量的变化,而这种能量变化又通常表现为热能变化。2、化学键的断裂和形成是化学反应中能量变化的主要原因。3、一个确定的化学反应在发生过程中是吸
收能量还是放出能量,取决于反应物的总
能量与生成物的总能量的相对大小。4、化学反应中能量转化遵循能量守恒原则。【本节小结】【作业】1.教材p37第5题
2.常规训练
3.查阅资料,制作化学冰袋、化学暖袋。
