温州 化学反应中的热量[下学期]
图片预览






文档简介
课件19张PPT。第二单元 化学反应中的热量碧莲中学 罗正将
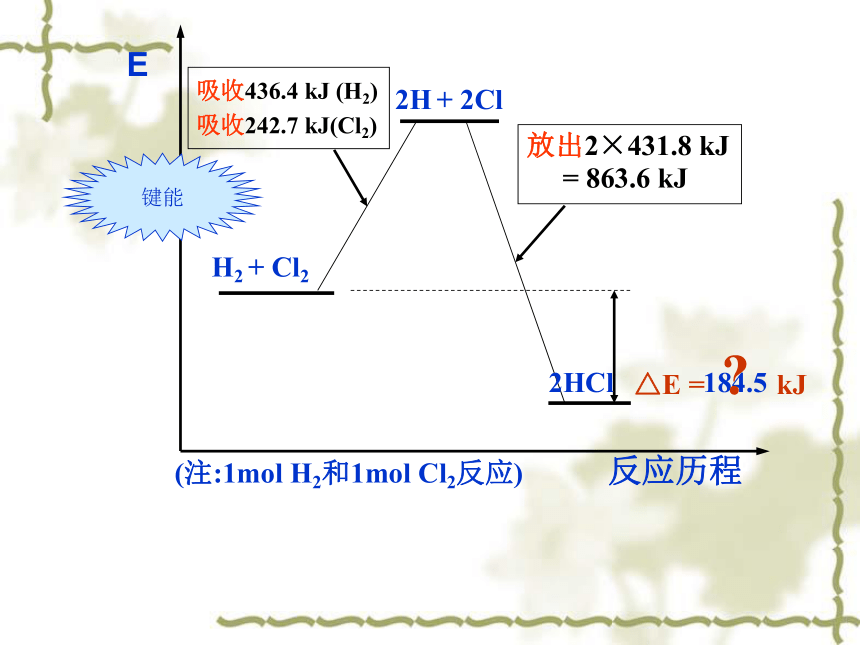
2007.4.10(第二课时)你能解释氢气和氯气反应放热的道理吗? 交流与讨论:根据键能,你能计算1mol H2和1mol Cl2反应,生成2molHCl气体放出的热量吗?E反应历程△E = kJ吸收436.4 kJ (H2)
吸收242.7 kJ(Cl2)放出2×431.8 kJ
= 863.6 kJ184.5(注:1mol H2和1mol Cl2反应)? 键能二、反应热
化学反应过程中放出或吸收的热量
用△H表示,单位:kJ·mol-1
△H<0时,为放热反应;
△H>0时,为吸热反应。
H2 (g) + Cl2 (g) = 2HCl (g) △H= -184.5kJ·mol-1 三、热化学方程式书写热化学方程式注意事项:
(1)反应物和生成物要标明其聚集状态,用g、l、s分别代表气态、液态、固态。
(2)方程式右端用△H 标明恒压条件下反应放出或吸收的热量,放热为负,吸热为正。
表示化学反应中放出或吸收的热量的化学方程式。(3)热化学方程式中各物质前的化学计量数不表示分子个数,只表示物质的量,因此可以是整数或分数。
(4)对于相同物质的反应,当化学计量数不同时,其△H 也不同,即△H 的值与计量数成正比。
(5)物质的状态不同,其△H 也不同。
① 2H2(g) + O2 (g) = 2H2O( l ) △H = -571.6kJmol-1② H2(g) +1/2 O2 (g) = H2O( l ) △H = -285.8kJmol-1③ H2(g) + 1/2 O2 (g) = H2O( g) △H = -241.8kJmol-1依据实验数据,写出下列反应的热化学方程式:
(1)1molN2(g)与适量H2(g)发生反应,生成NH3(g) ,放出92.2kJ热量。
(2)1molCu(s)与适量O2(g) 发生反应,生成CuO(s),放出157kJ热量。
(3)卫星发射时可用肼(N2H4) 作燃料,1molN2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(g),放出534kJ热量。
(4)1molCaCO3(S)完全分解,生成CaO(S)和CO2(g) ,需要吸收177.8kJ热量。练习与实践:请同学们阅读问题解决P34 T2:
(1)完全燃烧相同物质的量的上述物质,放出热量的大小顺序为:
(2)完全燃烧相等质量的上述物质,放出热量的大小顺序为:
质量相同的不同燃料,完全燃烧后放出的热量不相等。我国目前使用的主要燃料是什么?燃烧值或热值来表示16.6%2.1%5.1%76.2%我国化石燃料和水电能源消耗构成图大量使用化石燃料燃烧时,会带来哪些问题呢?交流与讨论:化石燃料仍然是当今世界使用最多的能源,面对现状,我们怎么办? 如何提高燃料的使用效率?
使燃料充分燃烧
简要说明使煤炉中的煤充分燃烧所应采取的措施。
怎样高效、清洁地利用煤炭?
怎样提高固体和液体燃料的燃烧效率?
开发洁净、高效的新能源
要有适当过量的空气、
燃料与空气要有足够大的接触面积
将固体燃料粉碎,或将液体燃料以雾状喷出,以增大燃料与空气的接触面煤的干馏
等综合利用美国通用汽车公司氢燃料电池车“氢动一号”日前走出实验室,标志着以零尾气排放为目标的清洁汽车距其实用阶段又近了一步。测试表明,“氢动一号”原型车时速从0—100公里的加速时间只需16秒,最高时速达140公里,可持续行驶400公里。
据悉,“氢动一号”与普通车最大的区别在于动力系统,其核心是200块燃料电池串联成、尺寸与普通汽车动力单元相当的电池组,使用储存在防热传导和防蒸发的特制不锈钢储罐中的液氢为燃料,储罐则安装在后座下面和后轴前。氢与氧燃烧产生动力,而燃烧产物是无污染的水。
练习:1980年我国首次制成燃氢汽车,乘员12人以50km/h行驶了40km。为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发,而经济的制氢方法是 。
A.电解水 B.锌和稀硫酸反应
C.光解海水C作业:教科书P37T1 T2 T3
作业本P33-35基础训练部分。打打开炉门
开炉门打开炉门在煤饼上打孔或将煤做成煤块在煤饼上打孔
燃烧时要有足够多的空气燃料与空气要有足够大的接触面
2007.4.10(第二课时)你能解释氢气和氯气反应放热的道理吗? 交流与讨论:根据键能,你能计算1mol H2和1mol Cl2反应,生成2molHCl气体放出的热量吗?E反应历程△E = kJ吸收436.4 kJ (H2)
吸收242.7 kJ(Cl2)放出2×431.8 kJ
= 863.6 kJ184.5(注:1mol H2和1mol Cl2反应)? 键能二、反应热
化学反应过程中放出或吸收的热量
用△H表示,单位:kJ·mol-1
△H<0时,为放热反应;
△H>0时,为吸热反应。
H2 (g) + Cl2 (g) = 2HCl (g) △H= -184.5kJ·mol-1 三、热化学方程式书写热化学方程式注意事项:
(1)反应物和生成物要标明其聚集状态,用g、l、s分别代表气态、液态、固态。
(2)方程式右端用△H 标明恒压条件下反应放出或吸收的热量,放热为负,吸热为正。
表示化学反应中放出或吸收的热量的化学方程式。(3)热化学方程式中各物质前的化学计量数不表示分子个数,只表示物质的量,因此可以是整数或分数。
(4)对于相同物质的反应,当化学计量数不同时,其△H 也不同,即△H 的值与计量数成正比。
(5)物质的状态不同,其△H 也不同。
① 2H2(g) + O2 (g) = 2H2O( l ) △H = -571.6kJmol-1② H2(g) +1/2 O2 (g) = H2O( l ) △H = -285.8kJmol-1③ H2(g) + 1/2 O2 (g) = H2O( g) △H = -241.8kJmol-1依据实验数据,写出下列反应的热化学方程式:
(1)1molN2(g)与适量H2(g)发生反应,生成NH3(g) ,放出92.2kJ热量。
(2)1molCu(s)与适量O2(g) 发生反应,生成CuO(s),放出157kJ热量。
(3)卫星发射时可用肼(N2H4) 作燃料,1molN2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(g),放出534kJ热量。
(4)1molCaCO3(S)完全分解,生成CaO(S)和CO2(g) ,需要吸收177.8kJ热量。练习与实践:请同学们阅读问题解决P34 T2:
(1)完全燃烧相同物质的量的上述物质,放出热量的大小顺序为:
(2)完全燃烧相等质量的上述物质,放出热量的大小顺序为:
质量相同的不同燃料,完全燃烧后放出的热量不相等。我国目前使用的主要燃料是什么?燃烧值或热值来表示16.6%2.1%5.1%76.2%我国化石燃料和水电能源消耗构成图大量使用化石燃料燃烧时,会带来哪些问题呢?交流与讨论:化石燃料仍然是当今世界使用最多的能源,面对现状,我们怎么办? 如何提高燃料的使用效率?
使燃料充分燃烧
简要说明使煤炉中的煤充分燃烧所应采取的措施。
怎样高效、清洁地利用煤炭?
怎样提高固体和液体燃料的燃烧效率?
开发洁净、高效的新能源
要有适当过量的空气、
燃料与空气要有足够大的接触面积
将固体燃料粉碎,或将液体燃料以雾状喷出,以增大燃料与空气的接触面煤的干馏
等综合利用美国通用汽车公司氢燃料电池车“氢动一号”日前走出实验室,标志着以零尾气排放为目标的清洁汽车距其实用阶段又近了一步。测试表明,“氢动一号”原型车时速从0—100公里的加速时间只需16秒,最高时速达140公里,可持续行驶400公里。
据悉,“氢动一号”与普通车最大的区别在于动力系统,其核心是200块燃料电池串联成、尺寸与普通汽车动力单元相当的电池组,使用储存在防热传导和防蒸发的特制不锈钢储罐中的液氢为燃料,储罐则安装在后座下面和后轴前。氢与氧燃烧产生动力,而燃烧产物是无污染的水。
练习:1980年我国首次制成燃氢汽车,乘员12人以50km/h行驶了40km。为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发,而经济的制氢方法是 。
A.电解水 B.锌和稀硫酸反应
C.光解海水C作业:教科书P37T1 T2 T3
作业本P33-35基础训练部分。打打开炉门
开炉门打开炉门在煤饼上打孔或将煤做成煤块在煤饼上打孔
燃烧时要有足够多的空气燃料与空气要有足够大的接触面
