温州 化学电源[下学期]
图片预览






文档简介
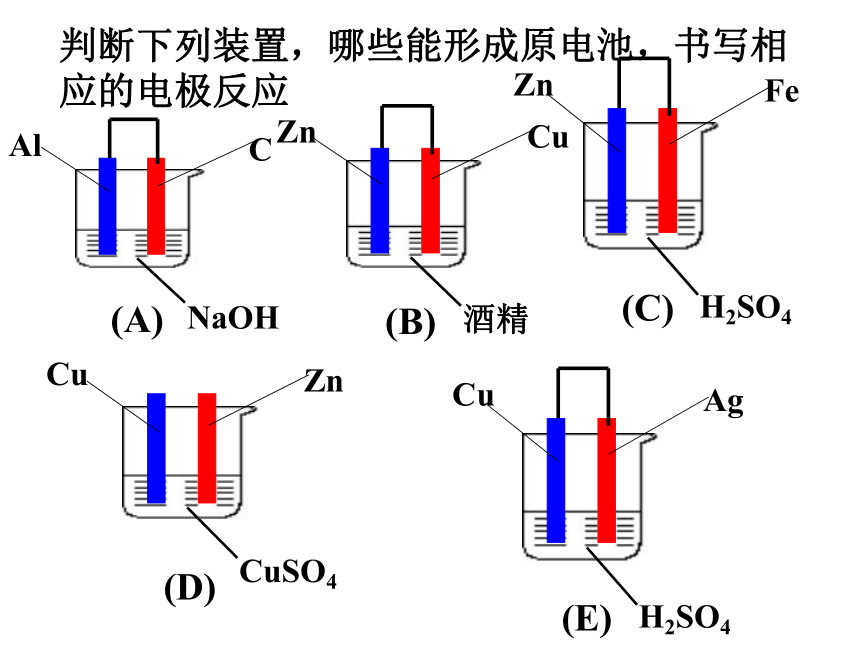
课件21张PPT。判断下列装置,哪些能形成原电池,书写相应的电极反应复习:原电池的构成条件 1、两种活泼性不同的金属构成电极。
(或一种金属和另一种非金属导体)
2、电解质溶液。
3、电极用导线相联构成闭合回路。
4.自发的氧化还原反应.负极:电子流出的电极(较活泼的金属)
正极:电子流入的电极(较不活泼的金属、
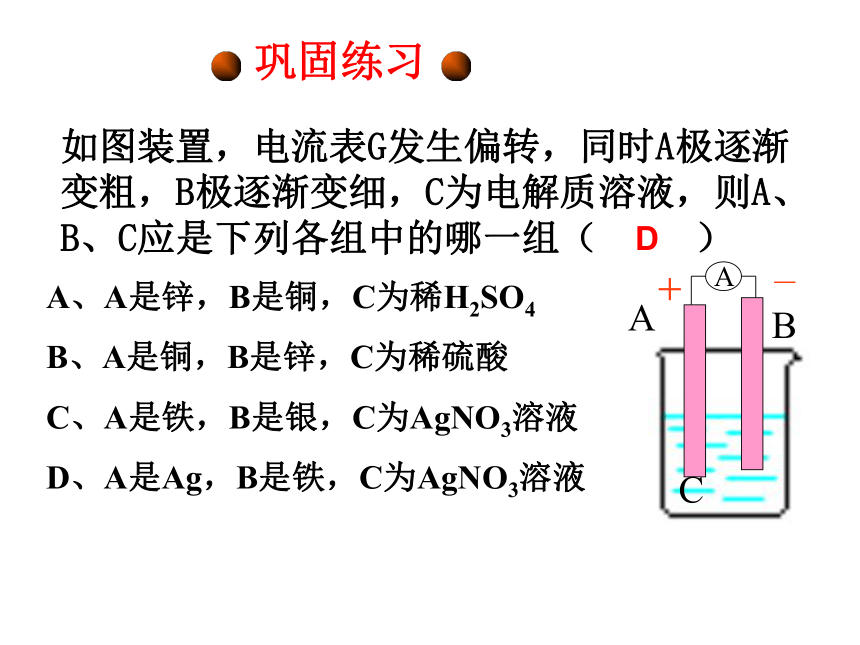
石墨等)巩固练习如图装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的哪一组( ) A、A是锌,B是铜,C为稀H2SO4
B、A是铜,B是锌,C为稀硫酸
C、A是铁,B是银,C为AgNO3溶液
D、A是Ag,B是铁,C为AgNO3溶液 D+-活动与探究1
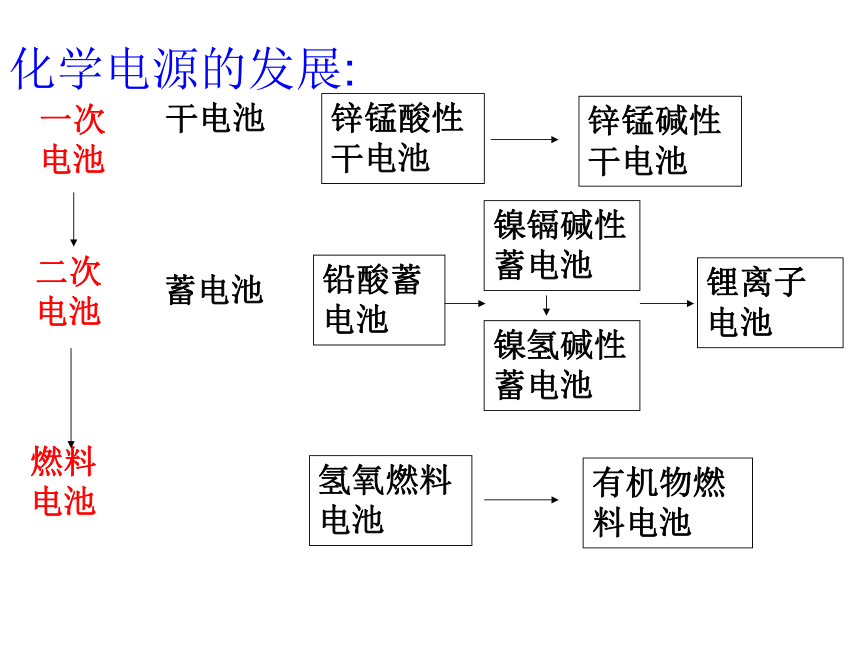
用铜片、锌片或铝片、纯碱溶液、白醋或水果等日常生活中的材料制作简易电池,并测试是否能产生电流。干电池蓄电池氢氧燃料电池锂电池化学电源的发展:一次电池干电池锌锰酸性干电池锌锰碱性干电池二次电池蓄电池铅酸蓄电池镍镉碱性蓄电池镍氢碱性蓄电池锂离子电池燃料电池氢氧燃料电池有机物燃料电池工作原理图G1、干电池—锌锰电池:Zn -2e-=Zn2+NH4Cl为电解液负极(Zn)
正极(C):MnO2作用:除去产生的H22NH4+ + 2e - === 2NH3 + H2?? ?H2 + 2MnO2 ===2 MnO(OH) 干电池1、最早使用的化学电池是锌锰电池,也是最普通的干电池。2、是一种一次性电池,放完电以后不能再使用,也就是内部发生的氧化还原反应是不可逆反应。3、缺点:电池在使用的过程中,锌会逐渐融解,最后内部糊状电解质会泄漏出来,使得电器被腐蚀。为了防止泄漏电解质,外壳用金属筒或者塑料筒。注意:使用完毕要及时从用电器中取出、不可久置、应保存在阴凉干燥处.碱性锌锰电池:电解液由NH4Cl换为KOH.2.充电电池:
充电电池又称二次电池,能够重复
使用至一定的周期。
铅蓄电池:最早使用的充电电池,
它是用硬橡胶或透明塑料制成长方形
外壳,在正极板上有一层棕褐色的
PbO2,负极板是海绵状的金属铅,
两极均浸入硫酸溶液中。充电电池——铅蓄电池 负极(Pb) 正极(PbO2) 电解质溶液(稀H2SO4)放电时:
负极:Pb+SO42--2e- = PbSO4正极:PbO2+4H++SO42-+2e- = PbSO4+2H2O总:Pb+PbO2+2H2SO4 2PbSO4+2H2O放电
充电 镍镉充电电池:它是一种体积少,具有残留性记忆的充电电池,可重复使用500次以上。它以Cd为负极,NiO(OH)为正极,
KOH为电解液。广泛用于收录机、无线对
讲机、电子闪光灯、电动剃须刀等,但有毒。
镍氢充电电池:无污染
锂离子电池:它是新一代可充电的绿色电池,现已成为笔记本电脑、移动电话、摄像机等低功耗电器的主流。3.燃料电池 燃料电池的特点:不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。 是一种高效、环境友好的发电装置。氢氧燃料电池1.氢氧燃料电池
(1)碱性介质正负两极都是铂电极或活性炭电极,有催化性能电解液一般为40%的KOH溶液2H2 + 4OH--4e- = 4H2O 正极:O2+2H2O+4e- = 4OH- 2H2 + O2 = 2H2O电池总反应式:负极:有水生成.
电解质溶液的PH将变小(2)酸性介质
正负两极仍是铂电极或活性炭电极,有催化性能
电解液为H2SO4等时,
负极:2H2 -4e- =4H+
正极:O2+4H++4e- =2H2O
总反应式: 2H2+O2 =2H2O
有水生成.电解质溶液的PH将增大1、燃料电池(氢氧燃料电池)
(1)碱性介质
负极:2H2+4OH--4e-=4H2O
正极:O2+2H2O+4e-=4OH-
总反应式:2H2+O2 =2H2O
(2)酸性介质
负极:2H2 -4e- =4H+
正极:O2+4H++4e- =2H2O
总反应式: 2H2+O2 =2H2O2其他燃料电池:
甲烷燃料电池:
该电池用金属铂片插入KOH溶液中作电极,
又在两极上分别通甲烷和氧气。
电极反应:
负极:CH4 + 10OH- - 8e-=CO32- + 7H2O
正极:2O2 + 4H2O + 8e-=8OH-
总反应:CH4 + 2O2 + 2KOH=K2CO3 + 3H2O电解液的PH将变小.
(或一种金属和另一种非金属导体)
2、电解质溶液。
3、电极用导线相联构成闭合回路。
4.自发的氧化还原反应.负极:电子流出的电极(较活泼的金属)
正极:电子流入的电极(较不活泼的金属、
石墨等)巩固练习如图装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的哪一组( ) A、A是锌,B是铜,C为稀H2SO4
B、A是铜,B是锌,C为稀硫酸
C、A是铁,B是银,C为AgNO3溶液
D、A是Ag,B是铁,C为AgNO3溶液 D+-活动与探究1
用铜片、锌片或铝片、纯碱溶液、白醋或水果等日常生活中的材料制作简易电池,并测试是否能产生电流。干电池蓄电池氢氧燃料电池锂电池化学电源的发展:一次电池干电池锌锰酸性干电池锌锰碱性干电池二次电池蓄电池铅酸蓄电池镍镉碱性蓄电池镍氢碱性蓄电池锂离子电池燃料电池氢氧燃料电池有机物燃料电池工作原理图G1、干电池—锌锰电池:Zn -2e-=Zn2+NH4Cl为电解液负极(Zn)
正极(C):MnO2作用:除去产生的H22NH4+ + 2e - === 2NH3 + H2?? ?H2 + 2MnO2 ===2 MnO(OH) 干电池1、最早使用的化学电池是锌锰电池,也是最普通的干电池。2、是一种一次性电池,放完电以后不能再使用,也就是内部发生的氧化还原反应是不可逆反应。3、缺点:电池在使用的过程中,锌会逐渐融解,最后内部糊状电解质会泄漏出来,使得电器被腐蚀。为了防止泄漏电解质,外壳用金属筒或者塑料筒。注意:使用完毕要及时从用电器中取出、不可久置、应保存在阴凉干燥处.碱性锌锰电池:电解液由NH4Cl换为KOH.2.充电电池:
充电电池又称二次电池,能够重复
使用至一定的周期。
铅蓄电池:最早使用的充电电池,
它是用硬橡胶或透明塑料制成长方形
外壳,在正极板上有一层棕褐色的
PbO2,负极板是海绵状的金属铅,
两极均浸入硫酸溶液中。充电电池——铅蓄电池 负极(Pb) 正极(PbO2) 电解质溶液(稀H2SO4)放电时:
负极:Pb+SO42--2e- = PbSO4正极:PbO2+4H++SO42-+2e- = PbSO4+2H2O总:Pb+PbO2+2H2SO4 2PbSO4+2H2O放电
充电 镍镉充电电池:它是一种体积少,具有残留性记忆的充电电池,可重复使用500次以上。它以Cd为负极,NiO(OH)为正极,
KOH为电解液。广泛用于收录机、无线对
讲机、电子闪光灯、电动剃须刀等,但有毒。
镍氢充电电池:无污染
锂离子电池:它是新一代可充电的绿色电池,现已成为笔记本电脑、移动电话、摄像机等低功耗电器的主流。3.燃料电池 燃料电池的特点:不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。 是一种高效、环境友好的发电装置。氢氧燃料电池1.氢氧燃料电池
(1)碱性介质正负两极都是铂电极或活性炭电极,有催化性能电解液一般为40%的KOH溶液2H2 + 4OH--4e- = 4H2O 正极:O2+2H2O+4e- = 4OH- 2H2 + O2 = 2H2O电池总反应式:负极:有水生成.
电解质溶液的PH将变小(2)酸性介质
正负两极仍是铂电极或活性炭电极,有催化性能
电解液为H2SO4等时,
负极:2H2 -4e- =4H+
正极:O2+4H++4e- =2H2O
总反应式: 2H2+O2 =2H2O
有水生成.电解质溶液的PH将增大1、燃料电池(氢氧燃料电池)
(1)碱性介质
负极:2H2+4OH--4e-=4H2O
正极:O2+2H2O+4e-=4OH-
总反应式:2H2+O2 =2H2O
(2)酸性介质
负极:2H2 -4e- =4H+
正极:O2+4H++4e- =2H2O
总反应式: 2H2+O2 =2H2O2其他燃料电池:
甲烷燃料电池:
该电池用金属铂片插入KOH溶液中作电极,
又在两极上分别通甲烷和氧气。
电极反应:
负极:CH4 + 10OH- - 8e-=CO32- + 7H2O
正极:2O2 + 4H2O + 8e-=8OH-
总反应:CH4 + 2O2 + 2KOH=K2CO3 + 3H2O电解液的PH将变小.
