元素周期律[下学期]
图片预览




文档简介
课件21张PPT。授课者 温州二高 黄秀娟 第一单元 核外电子排布与周期律元 素 周 期 律《镓的故事》 化学史话 1875年法国化学家布瓦博德朗发现了镓,并把
测得的关于镓的主要性质公布了。不久收到了俄国
化学家门捷列夫的来信,指出镓的比重不应该是4.7,
而是5.9-6.0…… 第二年他重新测定,结果镓的比重
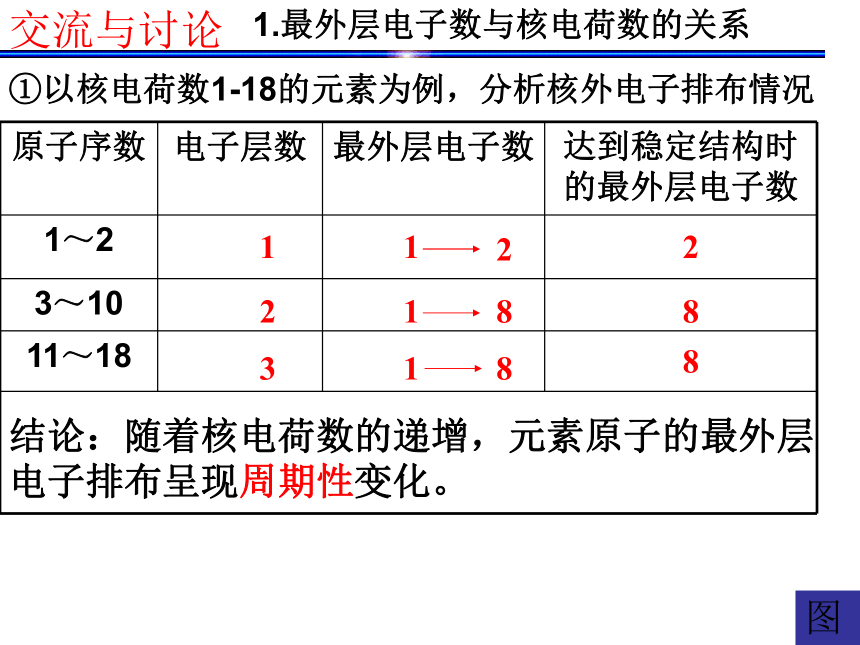
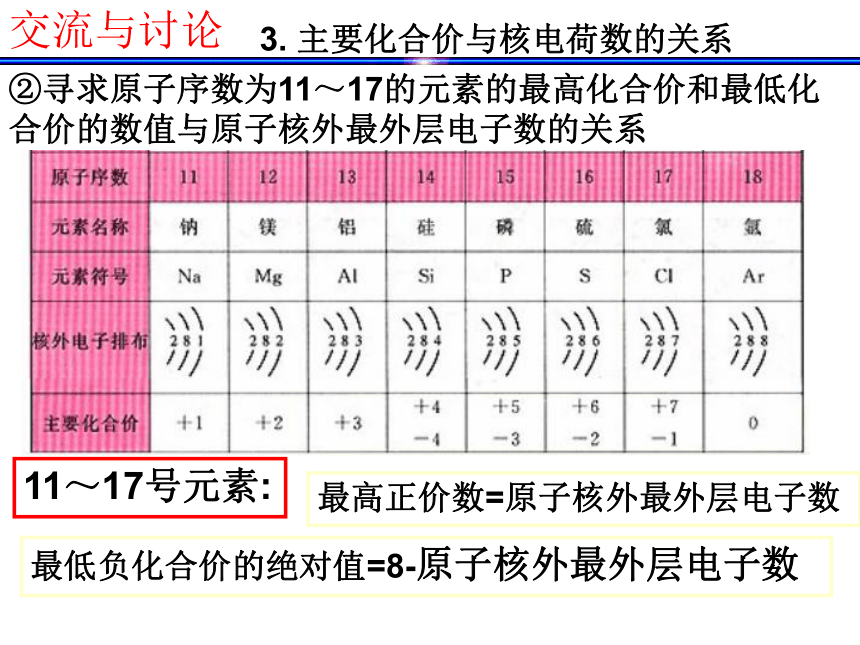
确实为5.94。 门捷列夫预言的依据是什么呢? 1.最外层电子数与核电荷数的关系123288图①以核电荷数1-18的元素为例,分析核外电子排布情况 交流与讨论结论:随着核电荷数的递增,元素原子的最外层
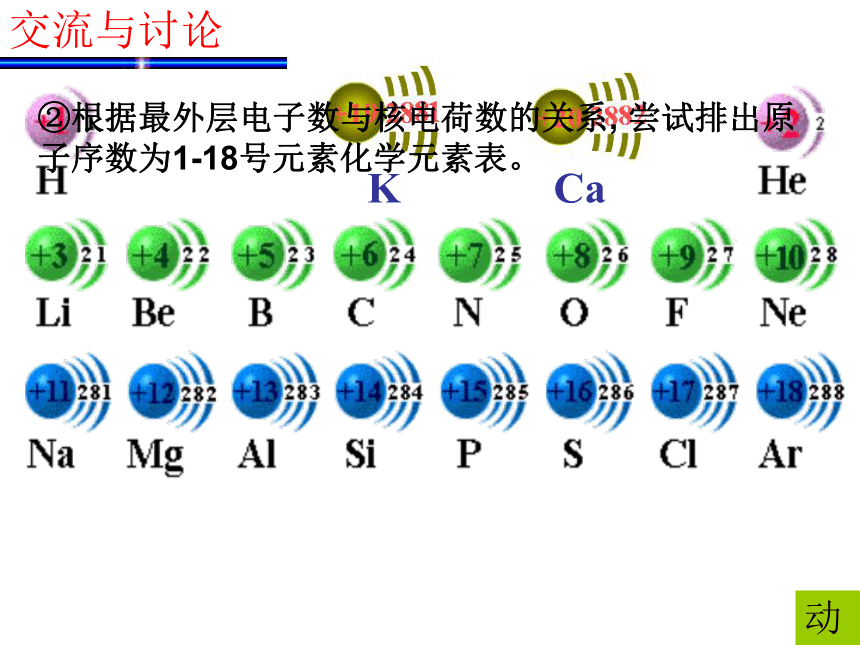
电子排布呈现周期性变化。KCa②根据最外层电子数与核电荷数的关系, 尝试排出原子序数为1-18号元素化学元素表。动交流与讨论 请画出原子半径、主要化合价与核电荷数的关系
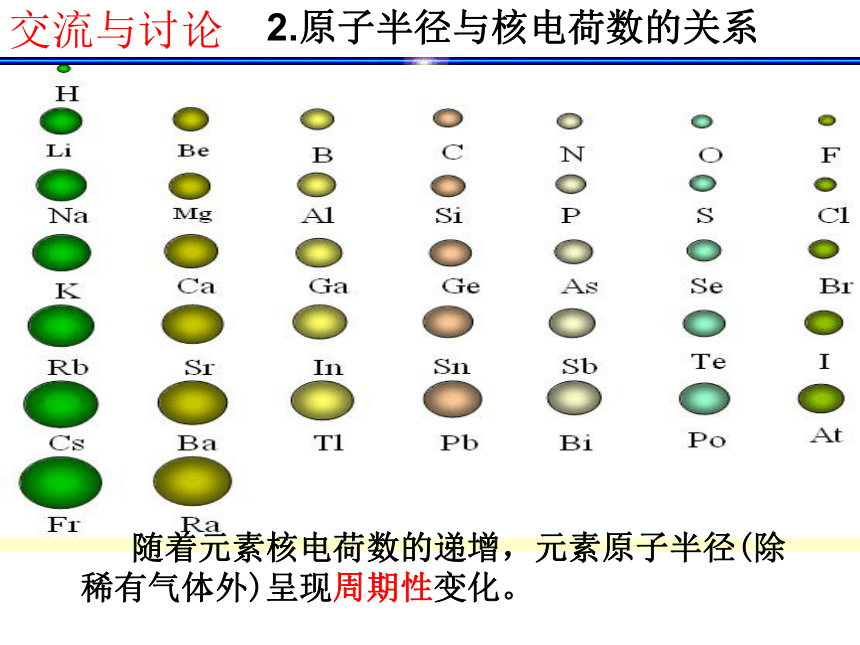
曲线,并得出结论。交流与讨论2.原子半径与核电荷数的关系 随着元素核电荷数的递增,元素原子半径(除稀有气体外)呈现周期性变化。交流与讨论结论:随着核电荷数的递增,元素化合价呈现
周期性变化。 3. 主要化合价与核电荷数的关系① 分析主要化合价与核电荷数的关系交流与讨论3. 主要化合价与核电荷数的关系②寻求原子序数为11~17的元素的最高化合价和最低化合价的数值与原子核外最外层电子数的关系最高正价数=原子核外最外层电子数最低负化合价的绝对值=8-原子核外最外层电子数11~17号元素:交流与讨论1.元素的性质呈周期性变化的本质是什么? 整理与归纳元素周期律:
元素的性质随着元素核电荷数的递增而呈周期性的变化的规律。2.元素的性质呈现出周期性的变化,那么这种
周而复始是不是又回到了原来的起点了呢?动分析史料①为什么门捷列夫依据原子量而不是化合价,或
者是物质的颜色等性质作为元素分类的依据呢?
②你能“看”出哪一种元素位置不正确的?请“试”着矫正它的位置? ③门捷列夫发现该元素的原子量错误,应为9。观察分析资料 归纳法(个别到一般)科学方法指导恩格斯高度评价: 元素的性质随着元素原子量的递增而呈周期性变化
——门捷列夫元素周期律的发现历程门捷列夫完成了科学史上的一个勋业。 通过本课的学习,
你有什么收获? 整合与反思元素
周期律练①根据你查找到的资料,说一说科学家是怎样逐步认识到元素周期律的实质的?
②你知道元素的性质还包括哪些?请根据元素周期律,探索它们的变化规律。作业请多指教,谢谢!巩固练习原子序数为1-18的元素,随着核电荷数的递增
不呈周期性变化的是( )
(A)原子量 (B)主要化合价
(C)原子半径(D)电子层数AD2.下列各组元素递变情况错误的是 ( )
(A)Li、Be、B 原子最外层电子数依次增多
(B) P、S、Cl 元素最高正化合价依次升高
(C)B、C、N、O、F原子半径依次增大
(D)Li、Na、K、Rb的金属性依次增强C回3.下列元素的原子半径依次减小的是( )
A. Na、Mg、Al B. N、O、F
C. P、Si、Al D. C、Si、Na4.下列有关元素周期律的叙述,正确的是( )
A. 元素周期律的本质是元素原子核外电子排布呈周期性变化
B. 元素周期律的本质是原子半径呈周期性变化
C. 元素周期律的本质是元素的性质随原子序数的递增呈周期性变化
D. 元素周期律的本质是元素的性质随原子量的递增而呈周期性变化ABA巩固练习回(1)最外层电子数与原子序数的关系回(3)元素化合价与原子序数的关系
Na K
Rb
测得的关于镓的主要性质公布了。不久收到了俄国
化学家门捷列夫的来信,指出镓的比重不应该是4.7,
而是5.9-6.0…… 第二年他重新测定,结果镓的比重
确实为5.94。 门捷列夫预言的依据是什么呢? 1.最外层电子数与核电荷数的关系123288图①以核电荷数1-18的元素为例,分析核外电子排布情况 交流与讨论结论:随着核电荷数的递增,元素原子的最外层
电子排布呈现周期性变化。KCa②根据最外层电子数与核电荷数的关系, 尝试排出原子序数为1-18号元素化学元素表。动交流与讨论 请画出原子半径、主要化合价与核电荷数的关系
曲线,并得出结论。交流与讨论2.原子半径与核电荷数的关系 随着元素核电荷数的递增,元素原子半径(除稀有气体外)呈现周期性变化。交流与讨论结论:随着核电荷数的递增,元素化合价呈现
周期性变化。 3. 主要化合价与核电荷数的关系① 分析主要化合价与核电荷数的关系交流与讨论3. 主要化合价与核电荷数的关系②寻求原子序数为11~17的元素的最高化合价和最低化合价的数值与原子核外最外层电子数的关系最高正价数=原子核外最外层电子数最低负化合价的绝对值=8-原子核外最外层电子数11~17号元素:交流与讨论1.元素的性质呈周期性变化的本质是什么? 整理与归纳元素周期律:
元素的性质随着元素核电荷数的递增而呈周期性的变化的规律。2.元素的性质呈现出周期性的变化,那么这种
周而复始是不是又回到了原来的起点了呢?动分析史料①为什么门捷列夫依据原子量而不是化合价,或
者是物质的颜色等性质作为元素分类的依据呢?
②你能“看”出哪一种元素位置不正确的?请“试”着矫正它的位置? ③门捷列夫发现该元素的原子量错误,应为9。观察分析资料 归纳法(个别到一般)科学方法指导恩格斯高度评价: 元素的性质随着元素原子量的递增而呈周期性变化
——门捷列夫元素周期律的发现历程门捷列夫完成了科学史上的一个勋业。 通过本课的学习,
你有什么收获? 整合与反思元素
周期律练①根据你查找到的资料,说一说科学家是怎样逐步认识到元素周期律的实质的?
②你知道元素的性质还包括哪些?请根据元素周期律,探索它们的变化规律。作业请多指教,谢谢!巩固练习原子序数为1-18的元素,随着核电荷数的递增
不呈周期性变化的是( )
(A)原子量 (B)主要化合价
(C)原子半径(D)电子层数AD2.下列各组元素递变情况错误的是 ( )
(A)Li、Be、B 原子最外层电子数依次增多
(B) P、S、Cl 元素最高正化合价依次升高
(C)B、C、N、O、F原子半径依次增大
(D)Li、Na、K、Rb的金属性依次增强C回3.下列元素的原子半径依次减小的是( )
A. Na、Mg、Al B. N、O、F
C. P、Si、Al D. C、Si、Na4.下列有关元素周期律的叙述,正确的是( )
A. 元素周期律的本质是元素原子核外电子排布呈周期性变化
B. 元素周期律的本质是原子半径呈周期性变化
C. 元素周期律的本质是元素的性质随原子序数的递增呈周期性变化
D. 元素周期律的本质是元素的性质随原子量的递增而呈周期性变化ABA巩固练习回(1)最外层电子数与原子序数的关系回(3)元素化合价与原子序数的关系
Na K
Rb
