化学反应的限度[下学期]
文档属性
| 名称 | 化学反应的限度[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 969.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-04-12 07:19:00 | ||
图片预览







文档简介
课件24张PPT。化 学 反 应 的 限 度二.化学反应的限度
1.定义:化学反应进行的最大程度。 反应物转化(或变化)的量
反应物起始的量
反应物的转化率= X100%
化学反应的限度越大,反应物的转化率就越大。可逆反应 在同一条件下既能向正反应方向又能向逆反应方向进行的化学反应。正反应:从左到右进行的反应
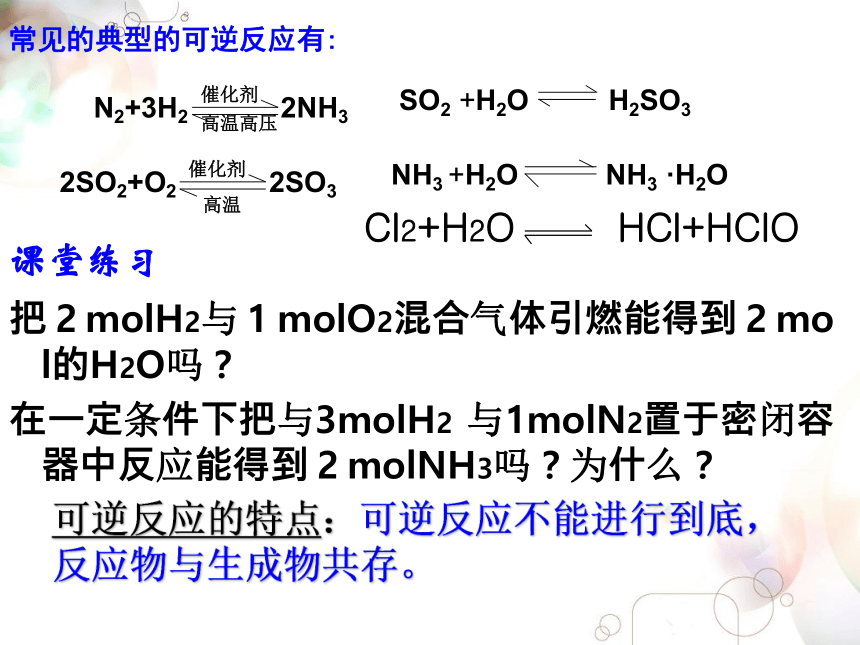
逆反应:从右到左进行的反应P47:思考与交流2.表示方法常见的典型的可逆反应有: SO2 +H2O H2SO3NH3 +H2O NH3 ·H2O
课堂练习
把2molH2与1molO2混合气体引燃能得到2mol的H2O吗?
在一定条件下把与3molH2 与1molN2置于密闭容器中反应能得到2molNH3吗?为什么?可逆反应的特点:可逆反应不能进行到底,反应物与生成物共存。Cl2+H2O HCl+HClO
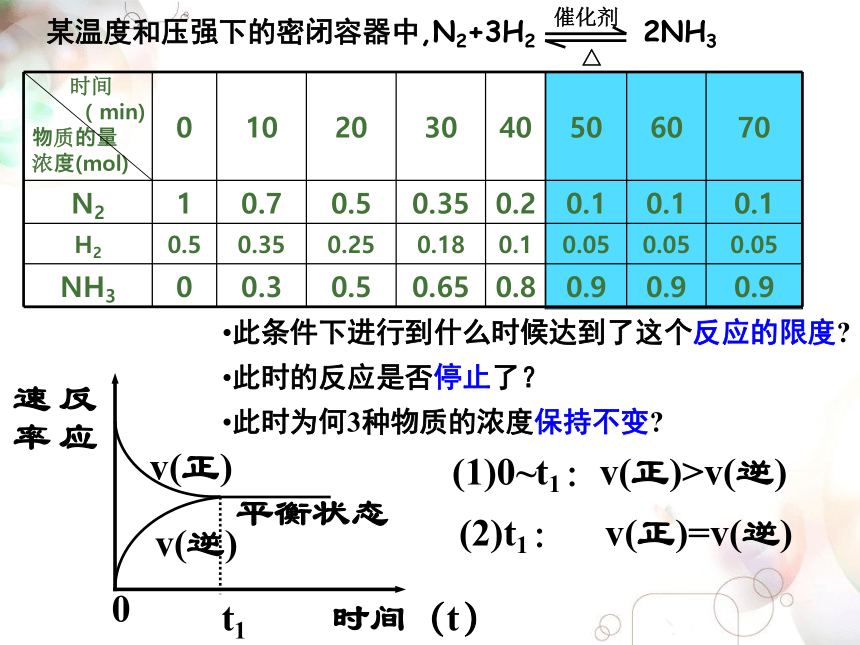
此条件下进行到什么时候达到了这个反应的限度?
此时的反应是否停止了?
此时为何3种物质的浓度保持不变? 某温度和压强下的密闭容器中,N2+3H2 2NH3(1)0~t1:v(正)>v(逆)(2)t1: v(正)=v(逆)平衡状态 化学平衡状态(1)概念:化学平衡状态就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应物和生成物的浓度保持不变的状态(2)特点:①化学平衡的研究对象是可逆反应
②平衡时正反应速率与逆反应速率相等,ν正=ν逆
③化学平衡是动态平衡ν正=ν逆≠0
④平衡时各组分的浓度保持不变
⑤当外界条件改变时,平衡一般要发生改变逆、等、动、定、变
此时:反应进行到了最大的程度,反应物的转化率最大。
-化学反应的限度-
影响因素:参与反应的物质的性质、浓度、温度、压强
催化剂只改变化学反应速率,不改变化学平衡状态。
随堂练习1
对化学反应限度的叙述不正确的是( )
A.任何可逆反应都有一定的限度
B.化学反应的限度是不可改变的
C.化学反应的限度与时间的长短无关
D.化学反应达到限度时,正逆反应的速率相等B随堂练习2
可逆反应达到平衡的重要特征( )
A.反应停止了
B.正、逆反应速率都为零
C.反应物和生成物的浓度相等
D.正、逆反应的速率相等D随堂练习3对于可逆反应M+N Q达到平衡时,
下列说法正确的是( ) A. M、N、Q三种物质的浓度一定相等
B. M、N全部变成了Q
C. M、N、Q的浓度都保持不变
D. 反应已经停止C随堂练习4
在已达到平衡的可逆反应2SO2+O2 2SO3中充入由18O组成的氧气一段时间后,18O原子( )
A.只存在于O2中 B.只存在于O2和SO3中
C.只存在于SO2和SO3中 D.SO2,SO3和O2中都存在催化剂D三.化学反应条件的控制
通过反应条件的控制,一方面可以控制_________,一方面可以控制_______化学反应速率化学反应的限度请同学们回归教材!一、浓度 - 时间图: 可用于:
1)写出化学反应方程式:
2)求反应物的转化率:A+2B 3CA的转化率=33.3%
B的转化率=66.7%1)写出化学反应方程式:
2)求反应物的转化率:例:练:5A 3B+2CA的转化率=62.5%1.在一定温度下,可逆反应 X(g) + 3Y (g) 2Z(g)达到平衡的标志是 ( )。
A.Z生成的速率与Z分解的速率相等
B.单位时间生成 a mol X,同时生成3a mol Y
C.X、Y、Z的浓度不再变化
D.X、Y、Z的分子数比为1:3:2[课堂练习]:A 、C【例1】 在一定温度下,可逆反应A(气)+3B(气) 2C(气)达到平衡的标志是 ( )
A. C的生成速率与C分解的速率相等
B. 单位时间内生成nmolA,同时生成3nmolB
C. A、B、C的浓度不再变化
D. A、B、C的分子数比为1:3:2AC【例2】 下列说法中可以充分说明反应: P(气)+Q(气) R(气)+S(气) , 在恒温下已达平衡状态的是( )
A. 反应容器内压强不随时间变化 B. P和S的生成速率相等
C. 反应容器内P、Q、R、S四者共存 D. 反应容器内总物质的量不随时间而 变化B【例3】下列说法可以证明反应N2+3H2 2NH3 已达平衡状态的是( )
A.1个N≡N键断裂的同时,有3个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成AC 【例4】在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应: A(固)+3B(气) 2C(气)+D(气)已达平衡状态的是 ( )
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.气体的总物质的量
BC【例5】 在一定温度下,下列叙述不是可逆反应A(气)+3B(气) 2C(气)+2D(固)达到平衡的标志的是 ( )
①C的生成 速率与C的分解速率相等
②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化
④A、B、C的分压强不再变化
⑤混合气体的总压强不再变化A⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成 3amolB
⑧A、B、C、D的分子数之比为1:3:2:2
A.②⑧ B.②⑤⑧
C.①③④⑦ D.②⑤⑥⑧
4、有关化学平衡计算
例6、把6mol A气体和5mol B气体混合放入4L密闭容器中,在一定条件下发生反应:3A(气)+B(气) 2C(气)+xD(气)经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol·(L·min)-1,下列说法中错误的是( )
A、x=2
B、B的转化率为20%
C、平衡时A的浓度为0.8mol·L-1
D、恒温达平衡时容器内压强为开始时85% 解析:本题是一道有关化学平衡的基础计算题,解题的关键是弄清各量的含义。
因n(D)=v(D)·V·t=0.1mol·(L·min)-1×
4L×5min=2mol,n(C):n(D)=2mol=1:1,所以x=2。
3A(气)+B(气) 2C(气)+2D(气)
起始量(mol) 6 5 0 0
变化量(mol) 3 1 2 2
平衡量(mol) 3 4 2 2答案:C、D练习:可逆反应 在 密闭容器中反应,达到平衡状态的标志是( )
1)单位时间里消耗2n mol NO2的同时生成n mol O2;
2)单位时间里生成 n mol O2 的同时生成 2n mol NO2;
3)单位时间里生成 n mol O2 的同时生成 2n mol NO;
4)混合气体的颜色不再发生变化的状态
5)混合气体的平均分子质量不再改变的状态
6)用NO2、 NO、 O2的物质的量浓度变化表示的
反应速率的比为2 : 2 : 1 的状态
A 1)4 )6) B 2)3)4) 5 )
C 2)4)5) D 1) 2) 3) 5) 6)
C能够说明 N2 + 3H2 2NH3反应在密闭容器中已达到平衡状态的是 :①容器内N2、H2、NH3三者共存
②容器内N2、H2、NH3三者浓度相等
③ 容器内N2、H2、NH3的浓度
比恰为1:3:2
④t min内生成1molNH3同时
消耗0.5molN2
⑤t min内,生成1molN2同时
消耗3molH2平衡状态的判断
⑥ 某时间内断裂3molH-H键的
同时,断裂6molN-H键
⑦容器内质量不随时间的变化
而变化
⑧容器内压强不随时间的变化
而变化
⑨容器内密度不再发生变化
⑩容器内的平均摩尔质量不再
发生变化
1.定义:化学反应进行的最大程度。 反应物转化(或变化)的量
反应物起始的量
反应物的转化率= X100%
化学反应的限度越大,反应物的转化率就越大。可逆反应 在同一条件下既能向正反应方向又能向逆反应方向进行的化学反应。正反应:从左到右进行的反应
逆反应:从右到左进行的反应P47:思考与交流2.表示方法常见的典型的可逆反应有: SO2 +H2O H2SO3NH3 +H2O NH3 ·H2O
课堂练习
把2molH2与1molO2混合气体引燃能得到2mol的H2O吗?
在一定条件下把与3molH2 与1molN2置于密闭容器中反应能得到2molNH3吗?为什么?可逆反应的特点:可逆反应不能进行到底,反应物与生成物共存。Cl2+H2O HCl+HClO
此条件下进行到什么时候达到了这个反应的限度?
此时的反应是否停止了?
此时为何3种物质的浓度保持不变? 某温度和压强下的密闭容器中,N2+3H2 2NH3(1)0~t1:v(正)>v(逆)(2)t1: v(正)=v(逆)平衡状态 化学平衡状态(1)概念:化学平衡状态就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应物和生成物的浓度保持不变的状态(2)特点:①化学平衡的研究对象是可逆反应
②平衡时正反应速率与逆反应速率相等,ν正=ν逆
③化学平衡是动态平衡ν正=ν逆≠0
④平衡时各组分的浓度保持不变
⑤当外界条件改变时,平衡一般要发生改变逆、等、动、定、变
此时:反应进行到了最大的程度,反应物的转化率最大。
-化学反应的限度-
影响因素:参与反应的物质的性质、浓度、温度、压强
催化剂只改变化学反应速率,不改变化学平衡状态。
随堂练习1
对化学反应限度的叙述不正确的是( )
A.任何可逆反应都有一定的限度
B.化学反应的限度是不可改变的
C.化学反应的限度与时间的长短无关
D.化学反应达到限度时,正逆反应的速率相等B随堂练习2
可逆反应达到平衡的重要特征( )
A.反应停止了
B.正、逆反应速率都为零
C.反应物和生成物的浓度相等
D.正、逆反应的速率相等D随堂练习3对于可逆反应M+N Q达到平衡时,
下列说法正确的是( ) A. M、N、Q三种物质的浓度一定相等
B. M、N全部变成了Q
C. M、N、Q的浓度都保持不变
D. 反应已经停止C随堂练习4
在已达到平衡的可逆反应2SO2+O2 2SO3中充入由18O组成的氧气一段时间后,18O原子( )
A.只存在于O2中 B.只存在于O2和SO3中
C.只存在于SO2和SO3中 D.SO2,SO3和O2中都存在催化剂D三.化学反应条件的控制
通过反应条件的控制,一方面可以控制_________,一方面可以控制_______化学反应速率化学反应的限度请同学们回归教材!一、浓度 - 时间图: 可用于:
1)写出化学反应方程式:
2)求反应物的转化率:A+2B 3CA的转化率=33.3%
B的转化率=66.7%1)写出化学反应方程式:
2)求反应物的转化率:例:练:5A 3B+2CA的转化率=62.5%1.在一定温度下,可逆反应 X(g) + 3Y (g) 2Z(g)达到平衡的标志是 ( )。
A.Z生成的速率与Z分解的速率相等
B.单位时间生成 a mol X,同时生成3a mol Y
C.X、Y、Z的浓度不再变化
D.X、Y、Z的分子数比为1:3:2[课堂练习]:A 、C【例1】 在一定温度下,可逆反应A(气)+3B(气) 2C(气)达到平衡的标志是 ( )
A. C的生成速率与C分解的速率相等
B. 单位时间内生成nmolA,同时生成3nmolB
C. A、B、C的浓度不再变化
D. A、B、C的分子数比为1:3:2AC【例2】 下列说法中可以充分说明反应: P(气)+Q(气) R(气)+S(气) , 在恒温下已达平衡状态的是( )
A. 反应容器内压强不随时间变化 B. P和S的生成速率相等
C. 反应容器内P、Q、R、S四者共存 D. 反应容器内总物质的量不随时间而 变化B【例3】下列说法可以证明反应N2+3H2 2NH3 已达平衡状态的是( )
A.1个N≡N键断裂的同时,有3个H-H键形成
B.1个N≡N键断裂的同时,有3个H-H键断裂
C.1个N≡N键断裂的同时,有6个N-H键断裂
D.1个N≡N键断裂的同时,有6个N-H键形成AC 【例4】在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应: A(固)+3B(气) 2C(气)+D(气)已达平衡状态的是 ( )
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.气体的总物质的量
BC【例5】 在一定温度下,下列叙述不是可逆反应A(气)+3B(气) 2C(气)+2D(固)达到平衡的标志的是 ( )
①C的生成 速率与C的分解速率相等
②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化
④A、B、C的分压强不再变化
⑤混合气体的总压强不再变化A⑥混合气体的物质的量不再变化
⑦单位时间内消耗amolA,同时生成 3amolB
⑧A、B、C、D的分子数之比为1:3:2:2
A.②⑧ B.②⑤⑧
C.①③④⑦ D.②⑤⑥⑧
4、有关化学平衡计算
例6、把6mol A气体和5mol B气体混合放入4L密闭容器中,在一定条件下发生反应:3A(气)+B(气) 2C(气)+xD(气)经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol·(L·min)-1,下列说法中错误的是( )
A、x=2
B、B的转化率为20%
C、平衡时A的浓度为0.8mol·L-1
D、恒温达平衡时容器内压强为开始时85% 解析:本题是一道有关化学平衡的基础计算题,解题的关键是弄清各量的含义。
因n(D)=v(D)·V·t=0.1mol·(L·min)-1×
4L×5min=2mol,n(C):n(D)=2mol=1:1,所以x=2。
3A(气)+B(气) 2C(气)+2D(气)
起始量(mol) 6 5 0 0
变化量(mol) 3 1 2 2
平衡量(mol) 3 4 2 2答案:C、D练习:可逆反应 在 密闭容器中反应,达到平衡状态的标志是( )
1)单位时间里消耗2n mol NO2的同时生成n mol O2;
2)单位时间里生成 n mol O2 的同时生成 2n mol NO2;
3)单位时间里生成 n mol O2 的同时生成 2n mol NO;
4)混合气体的颜色不再发生变化的状态
5)混合气体的平均分子质量不再改变的状态
6)用NO2、 NO、 O2的物质的量浓度变化表示的
反应速率的比为2 : 2 : 1 的状态
A 1)4 )6) B 2)3)4) 5 )
C 2)4)5) D 1) 2) 3) 5) 6)
C能够说明 N2 + 3H2 2NH3反应在密闭容器中已达到平衡状态的是 :①容器内N2、H2、NH3三者共存
②容器内N2、H2、NH3三者浓度相等
③ 容器内N2、H2、NH3的浓度
比恰为1:3:2
④t min内生成1molNH3同时
消耗0.5molN2
⑤t min内,生成1molN2同时
消耗3molH2平衡状态的判断
⑥ 某时间内断裂3molH-H键的
同时,断裂6molN-H键
⑦容器内质量不随时间的变化
而变化
⑧容器内压强不随时间的变化
而变化
⑨容器内密度不再发生变化
⑩容器内的平均摩尔质量不再
发生变化
