金属的化学性质[下学期]
文档属性
| 名称 | 金属的化学性质[下学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 339.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-04-16 00:00:00 | ||
图片预览






文档简介
课件14张PPT。金属的化学性质
课题 2课前 小练: 1、描述下列反应的实验现象
(1)铁在氧气中燃烧:
剧烈反应,放出大量的热 ,发出耀眼的白光。以上三个反应的剧烈程度一样吗?有什么不同?剧烈反应,放出大量的热,火星四射,有黑色的物质生成。结论:活泼性:镁>铝>铁(2)铝在氧气中燃烧:(3)镁在空气中燃烧:剧烈反应,放出大量的热 ,发出耀眼的白光。常温下:镁、铝能跟空气中的氧气反应,而铁在常温 下不与氧气发生反应,在高温下才与氧气发生反应俗话说:真金不怕火炼,说明了金在高温下也不能与氧气发生反应。根据以上根据上述事实,我们可判断出Fe Al Mg Au等金属的活泼程度,即金属活动性。镁、铝比较活泼,铁次之,金最不活泼。 铝的化学性质很活泼,为什么通常铝制品可以稳定的存在,不容易被腐蚀?
铝制品耐腐蚀是由于铝可和空气中的氧气在其表面生成一层致密的氧化铝薄膜,从而阻止铝的进一步氧化之故。 问:答:写出铝在空气中的反应
4Al+3O2 = 2Al2O3
连接生活?明 确 1、金属的活泼性并不是完全相同,而是有强有弱 2、与氧气反应的难易可以判断
金属的活泼性
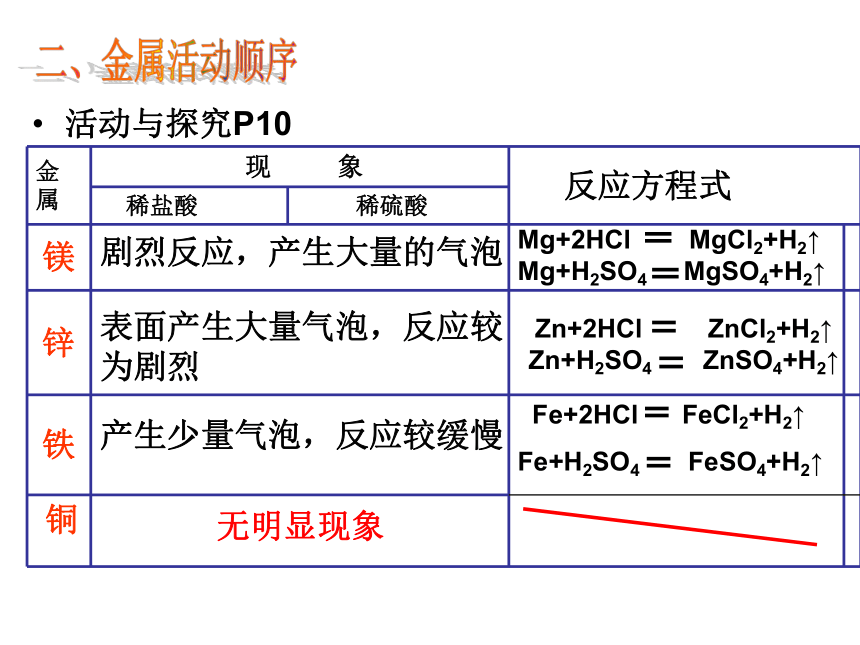
二、金属活动顺序活动与探究P10ZnFeCuMg向下列装有不同金属的四支试管中滴加稀盐酸(1)观察反应现象,这几种金属哪些能与盐酸酸反应,哪些不能?反应的剧烈程度谁最强?
(2)从这个探究中你能得到什么结论?二、金属活动顺序活动与探究P10剧烈反应,产生大量的气泡
表面产生大量气泡,反应较为剧烈
产生少量气泡,反应较缓慢
无明显现象金属的分类图8-13金属与盐酸的反应 P11活 泼 金 属不 活 泼 金属结论:金属的活泼性顺序:Mg >Zn>Fe>Cu1、判断下面的金属,按照它们的金属活动性顺序由强到弱排列( )
A.Fe>Mg>Al>Ag B. Ag>Al>Fe>Mg
C. Mg>Al>Fe>Ag D. Mg>Al>Ag>Fe
2、X、Y、Z三种金属中,X、Y都能与盐酸反应,但Y与盐酸反应比X与盐酸反应剧烈,Z不与盐酸反应,试判断X、Y、Z三种金属的活动行顺序由强弱是( )
A.Y>X>Z B.Y>Z>X C.Z>Y>X D.X>Y>Z
3、家庭常用的铝制品为什么具有良好的抗腐蚀性能?
答:
CA铝在空气中与氧气反应,其表面生成一层致密的氧化铝(Al2O3)薄膜,从而阻止铝进一步氧化,因此,铝具有很好的抗腐蚀性能。Mg + 2HCl MgCl2 + H2↑
Zn + 2HCl ZnCl2 + H2↑
Fe + 2HCl FeCl2 + H2↑ 单质化合物单质化合物以上几个反应有什么特点: 它们都是由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应 这 种 置换反应:三、置换反应:X学完本课题你应该知道:
1、金属与氧气的反应
———反应条件要求越低,金属的活泼性越强
2、金属与酸的反应
———能与酸反应、反应越剧烈金属的活泼性越强 3、由一种单质与一种化合物反应,生成另一种单质 和另一种化合物的反应叫置换反应。金属与盐酸、稀硫酸的反应等都属于置换反应。(1)写出铁、镁、铝分别与稀盐酸、稀硫酸反应的化学方程式
(2) P14 3、4、8
课后练习:谢谢指导!
课题 2课前 小练: 1、描述下列反应的实验现象
(1)铁在氧气中燃烧:
剧烈反应,放出大量的热 ,发出耀眼的白光。以上三个反应的剧烈程度一样吗?有什么不同?剧烈反应,放出大量的热,火星四射,有黑色的物质生成。结论:活泼性:镁>铝>铁(2)铝在氧气中燃烧:(3)镁在空气中燃烧:剧烈反应,放出大量的热 ,发出耀眼的白光。常温下:镁、铝能跟空气中的氧气反应,而铁在常温 下不与氧气发生反应,在高温下才与氧气发生反应俗话说:真金不怕火炼,说明了金在高温下也不能与氧气发生反应。根据以上根据上述事实,我们可判断出Fe Al Mg Au等金属的活泼程度,即金属活动性。镁、铝比较活泼,铁次之,金最不活泼。 铝的化学性质很活泼,为什么通常铝制品可以稳定的存在,不容易被腐蚀?
铝制品耐腐蚀是由于铝可和空气中的氧气在其表面生成一层致密的氧化铝薄膜,从而阻止铝的进一步氧化之故。 问:答:写出铝在空气中的反应
4Al+3O2 = 2Al2O3
连接生活?明 确 1、金属的活泼性并不是完全相同,而是有强有弱 2、与氧气反应的难易可以判断
金属的活泼性
二、金属活动顺序活动与探究P10ZnFeCuMg向下列装有不同金属的四支试管中滴加稀盐酸(1)观察反应现象,这几种金属哪些能与盐酸酸反应,哪些不能?反应的剧烈程度谁最强?
(2)从这个探究中你能得到什么结论?二、金属活动顺序活动与探究P10剧烈反应,产生大量的气泡
表面产生大量气泡,反应较为剧烈
产生少量气泡,反应较缓慢
无明显现象金属的分类图8-13金属与盐酸的反应 P11活 泼 金 属不 活 泼 金属结论:金属的活泼性顺序:Mg >Zn>Fe>Cu1、判断下面的金属,按照它们的金属活动性顺序由强到弱排列( )
A.Fe>Mg>Al>Ag B. Ag>Al>Fe>Mg
C. Mg>Al>Fe>Ag D. Mg>Al>Ag>Fe
2、X、Y、Z三种金属中,X、Y都能与盐酸反应,但Y与盐酸反应比X与盐酸反应剧烈,Z不与盐酸反应,试判断X、Y、Z三种金属的活动行顺序由强弱是( )
A.Y>X>Z B.Y>Z>X C.Z>Y>X D.X>Y>Z
3、家庭常用的铝制品为什么具有良好的抗腐蚀性能?
答:
CA铝在空气中与氧气反应,其表面生成一层致密的氧化铝(Al2O3)薄膜,从而阻止铝进一步氧化,因此,铝具有很好的抗腐蚀性能。Mg + 2HCl MgCl2 + H2↑
Zn + 2HCl ZnCl2 + H2↑
Fe + 2HCl FeCl2 + H2↑ 单质化合物单质化合物以上几个反应有什么特点: 它们都是由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应 这 种 置换反应:三、置换反应:X学完本课题你应该知道:
1、金属与氧气的反应
———反应条件要求越低,金属的活泼性越强
2、金属与酸的反应
———能与酸反应、反应越剧烈金属的活泼性越强 3、由一种单质与一种化合物反应,生成另一种单质 和另一种化合物的反应叫置换反应。金属与盐酸、稀硫酸的反应等都属于置换反应。(1)写出铁、镁、铝分别与稀盐酸、稀硫酸反应的化学方程式
(2) P14 3、4、8
课后练习:谢谢指导!
同课章节目录
