离子晶体[上学期]
图片预览



文档简介
课件27张PPT。晶体的类型与性质晶体的概述什么叫晶体? 构成晶体微粒之间的作用力。作用力越强,晶体的熔沸点越高,晶体的硬度越大。具有规则几何外形的固体叫晶体。
晶体中的微粒按一定的规则排列。决定晶体物理性质的因素是什么?晶体的类型有哪些?离子晶体
分子晶体
原子晶体
金属晶体根据晶体的粒子
种类和粒子间的
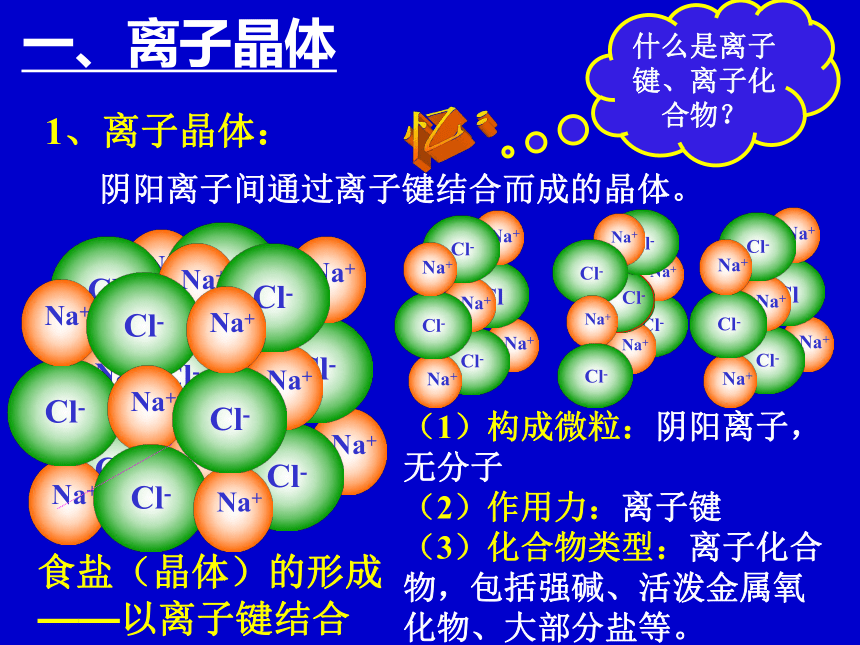
相互作用不同一、离子晶体1、离子晶体:阴阳离子间通过离子键结合而成的晶体。什么是离子键、离子化合物?忆:(1)构成微粒:阴阳离子,无分子
(2)作用力:离子键
(3)化合物类型:离子化合物,包括强碱、活泼金属氧化物、大部分盐等。食盐(晶体)的形成
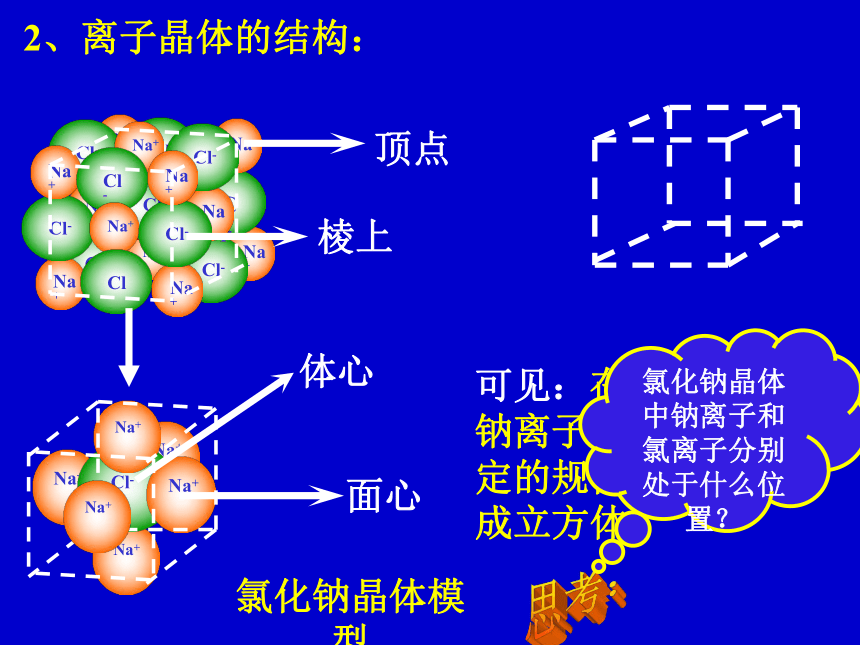
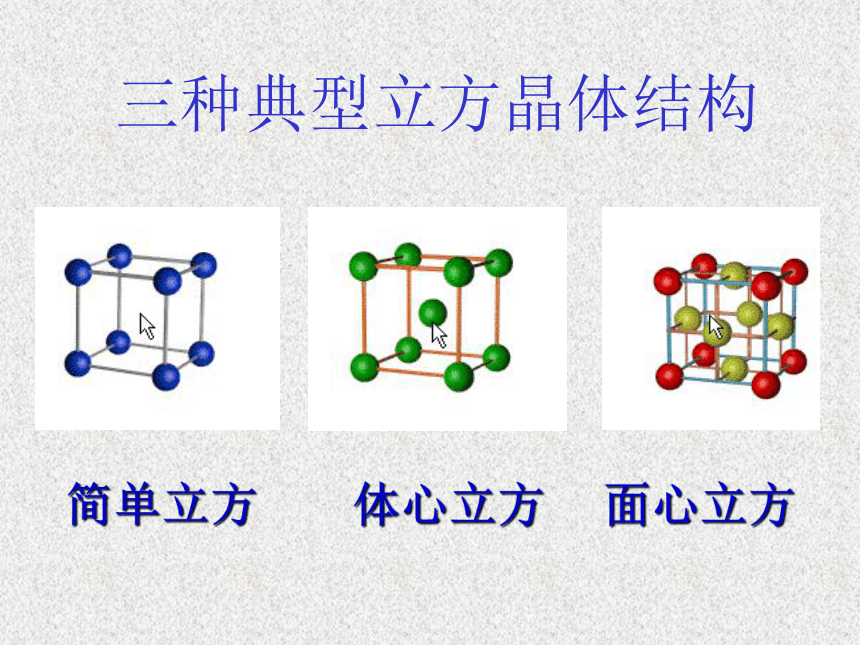
——以离子键结合面心棱上顶点思考:2、离子晶体的结构:氯化钠晶体模型体心可见:在NaCl晶体中,钠离子、氯离子按一定的规律在空间排列成立方体。氯化钠晶体中钠离子和氯离子分别处于什么位置?晶体中最小单元 ——晶胞相关认识晶体结构中具有代表性的最小重复单元——晶格2、离子晶体的结构:氯化钠晶体模型三种典型立方晶体结构简单立方体心立方面心立方思考:
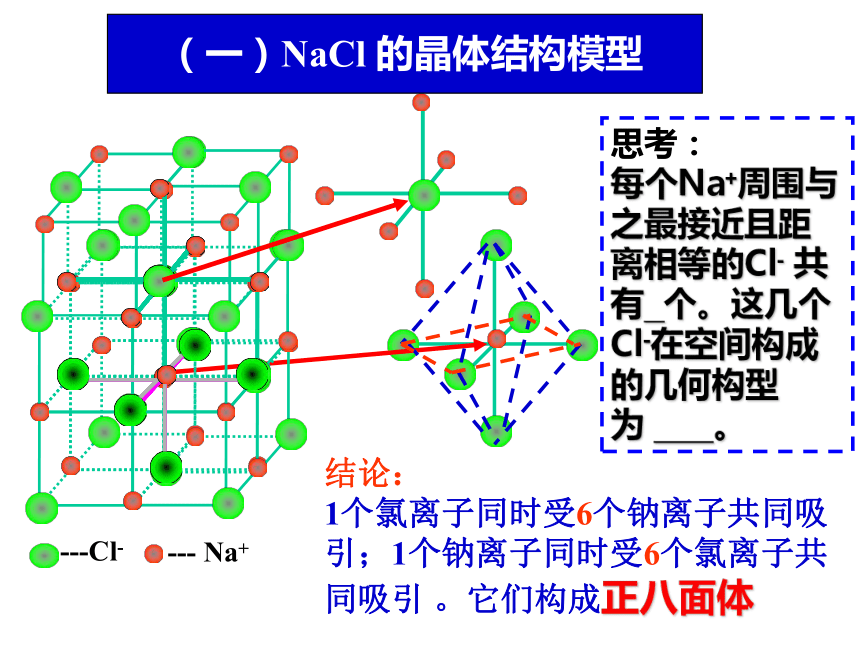
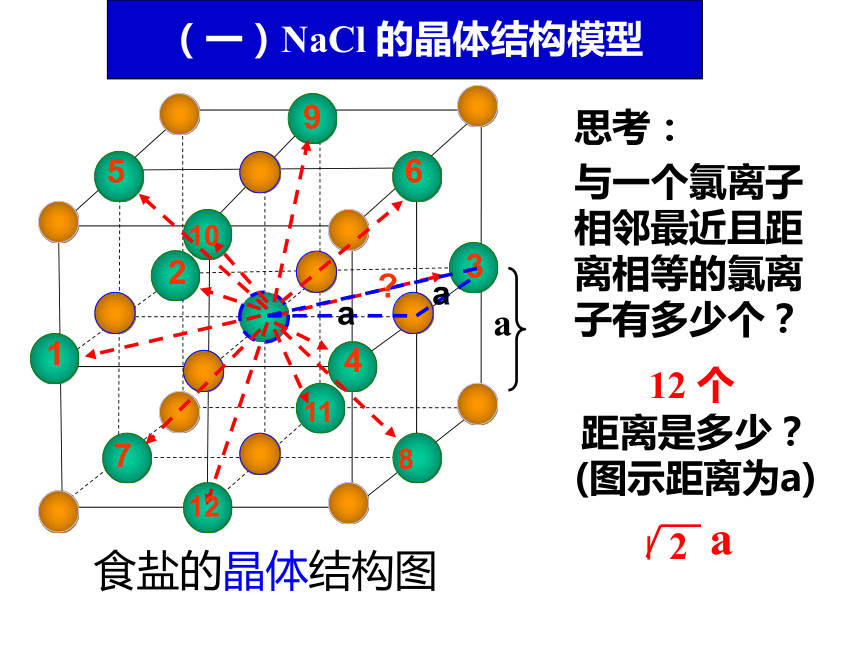
每个Na+周围与之最接近且距离相等的Cl- 共有 个。这几个Cl-在空间构成的几何构型为 。 (一)NaCl 的晶体结构模型结论:
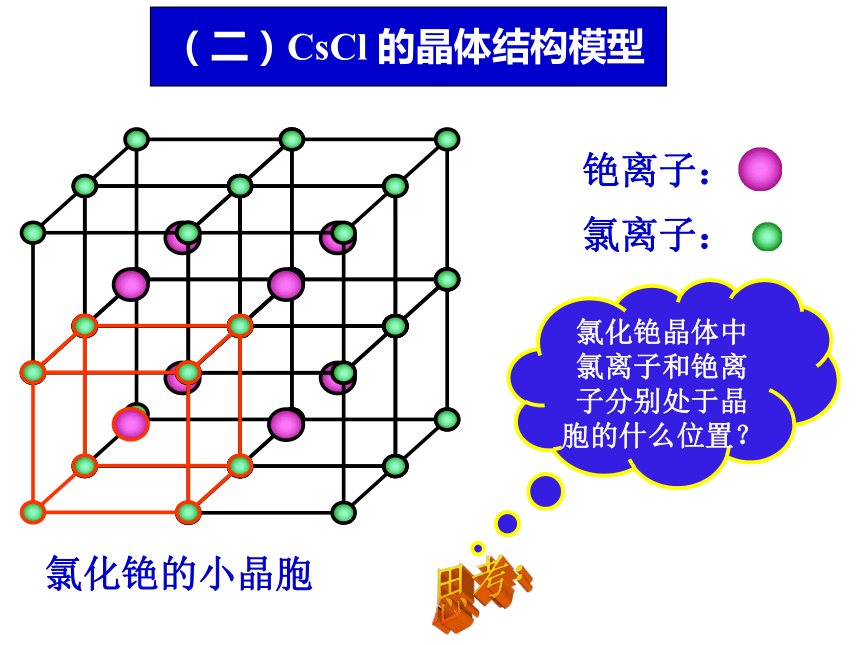
1个氯离子同时受6个钠离子共同吸引;1个钠离子同时受6个氯离子共同吸引 。它们构成正八面体与一个氯离子相邻最近且距离相等的氯离子有多少个?食盐的晶体结构图 距离是多少?(图示距离为a)思考:a12 个(一)NaCl 的晶体结构模型氯化铯晶体中氯离子和铯离子分别处于晶胞的什么位置?(二)CsCl 的晶体结构模型思考:(二)CsCl 的晶体结构模型 思考:1.在氯化铯晶体中,每个Cs+周围与之最接近且距离相等的Cl-共有 ;这几个Cl-在空间构成的几何构型为 。8个立方体2、与铯离子等距离且最近的铯离子有几个?左下 右前后上 在每个Cs+周围距离相等且最近的Cs+共有 ;这几个Cs 在空间构成的几何构型 。 6个正八面体晶胞中微粒数的计算处于晶胞内部、顶点上、棱上、面上的离子分别被多少个晶胞共用?思考:晶胞内部:
面上:
棱上:
顶点上:1个晶胞2个晶胞共用4个晶胞共用8个晶胞共用位于顶点的微粒,晶胞完全拥有其1/8。
位于面心的微粒,晶胞完全拥有其1/2。
位于棱上的微粒,晶胞完全拥有其1/4。
位于体心上的微粒,微粒完全属于该晶胞。结论: 例.在氯化钠晶胞中,实际的钠离子和氯离子各有多少个?写出它的化学式。晶胞中的钠离子数氯离子数即钠离子与氯离子个数比为4:4=1:1,
故氯化钠的化学式为NaCl N总=N内+N面×1/2+N棱×1/4+N顶点×1/8晶胞中微粒数及化学式的计算1.根据离子晶体的晶胞结构,判断下列离子
晶体的化学式:(A表示阳离子)AB化学式:AB2. 写出下列离子晶体的化学式 该晶体的化学式为
A3B (或BA3) 3、离子晶体的物理性质:离子晶体一般拥有较高的熔沸点(1)硬度:3、离子晶体的物理性质:离子晶体一般拥有较高的硬度(1)硬度:(2)溶沸点:离子晶体一般拥有较高的溶沸点3、离子晶体的物理性质:离子晶体一般拥有较高的熔沸点离子晶体一般拥有较高的硬度为什么离子晶体一般拥有较高的硬度
和熔沸点呢?思考:构成离子晶体的粒子是阴阳离子,离子排列紧密有序;
阴阳离子之间的作用是强烈的离子键,
所以离子晶体一般拥有较高的熔沸点。(1)硬度:(2)溶沸点:3、离子晶体的物理性质:离子晶体一般拥有较高的熔沸点离子晶体一般拥有较高的硬度(1)硬度:(2)溶沸点:离子晶体的熔沸点比较规律:一般来说:
1、阴阳离子半径越小,离子键就越强烈,溶沸点越高。2、阴阳离子电荷数越多,离子键就越强烈,溶沸点越高。熔沸点: NaF > NaCl> NaBr> NaI;熔沸点:NaCl >CsCl熔沸点:MgO>NaCl3、离子晶体的物理性质:离子晶体一般拥有较高的熔沸点离子晶体一般拥有较高的硬度(1)硬度:(2)溶沸点:离子晶体的熔沸点比较规律:一般来说:
1、阴阳离子半径越小,离子键就越强烈,溶沸点越高。2、阴阳离子电荷数越多,离子键就越强烈,溶沸点越高。(3)导电性:当离子晶体为固体时不能导电,熔化或溶于水后可以导电。(4)溶解性:离子晶体大多数能溶于水。阴阳离子离子键较大较高固体不导电,熔化或
溶于水后可导电。多数易溶于水大多数盐、金属氧化物、强碱等小结:课堂练习:1、下列物质中,属于离子晶体的是( );只含离子键的离子晶体是( ); 含极性共价键的离子晶体是( );含非极性共价键的离子晶体是( )。
KBr 、 NaOH、 HCl、 CO2、 NH4Cl、 I2 、 Na2O2、CCl4、N2、CaO、H2S、H2O2、HNO3、Na2SO4 离子晶体:KBr 、 NaOH、 NH4Cl、 Na2O2、
CaO、Na2SO4 只含离子键的离子晶体:KBr 、CaO含极性共价键的离子晶体:NaOH、 NH4Cl、 Na2SO4 含非极性共价键的离子晶体:Na2O2 课堂练习:2、下列说法正确的是( )
A、离子晶体中只含离子键。
B、不同元素组成的多原子分子里的化学键一定是极 性键。
C、共价化合物分子里一定不含离子键。
D、非极性键只存在于双原子单质分子中。C3、在一个氯化铯晶胞内存在 个Cl- ,在一个氯化铯晶胞内存在 个Cs+,与Cl-距离最近且相等的Cs+有 个, Cl-有 个。11课堂练习:864、如右图所示的晶体结构是一种具有优良压电、铁电、电光等功能的晶体材料的晶胞。
(1)晶体内与每个“Ti”紧邻的O原子数为 个? (2)晶体的化学式为( )
A、BaTi8O12 B、BaTi4O9
C、BaTiO3 D、BaTi2O3 6C课堂练习:5、若已知NaCl的密度为 ,则NaCl晶体中Na+与Na+的最短距离是多少?∴ Na+ 与Na+之间的最短距离为课堂练习:氯离子钠离子再见!谢谢指导!
晶体中的微粒按一定的规则排列。决定晶体物理性质的因素是什么?晶体的类型有哪些?离子晶体
分子晶体
原子晶体
金属晶体根据晶体的粒子
种类和粒子间的
相互作用不同一、离子晶体1、离子晶体:阴阳离子间通过离子键结合而成的晶体。什么是离子键、离子化合物?忆:(1)构成微粒:阴阳离子,无分子
(2)作用力:离子键
(3)化合物类型:离子化合物,包括强碱、活泼金属氧化物、大部分盐等。食盐(晶体)的形成
——以离子键结合面心棱上顶点思考:2、离子晶体的结构:氯化钠晶体模型体心可见:在NaCl晶体中,钠离子、氯离子按一定的规律在空间排列成立方体。氯化钠晶体中钠离子和氯离子分别处于什么位置?晶体中最小单元 ——晶胞相关认识晶体结构中具有代表性的最小重复单元——晶格2、离子晶体的结构:氯化钠晶体模型三种典型立方晶体结构简单立方体心立方面心立方思考:
每个Na+周围与之最接近且距离相等的Cl- 共有 个。这几个Cl-在空间构成的几何构型为 。 (一)NaCl 的晶体结构模型结论:
1个氯离子同时受6个钠离子共同吸引;1个钠离子同时受6个氯离子共同吸引 。它们构成正八面体与一个氯离子相邻最近且距离相等的氯离子有多少个?食盐的晶体结构图 距离是多少?(图示距离为a)思考:a12 个(一)NaCl 的晶体结构模型氯化铯晶体中氯离子和铯离子分别处于晶胞的什么位置?(二)CsCl 的晶体结构模型思考:(二)CsCl 的晶体结构模型 思考:1.在氯化铯晶体中,每个Cs+周围与之最接近且距离相等的Cl-共有 ;这几个Cl-在空间构成的几何构型为 。8个立方体2、与铯离子等距离且最近的铯离子有几个?左下 右前后上 在每个Cs+周围距离相等且最近的Cs+共有 ;这几个Cs 在空间构成的几何构型 。 6个正八面体晶胞中微粒数的计算处于晶胞内部、顶点上、棱上、面上的离子分别被多少个晶胞共用?思考:晶胞内部:
面上:
棱上:
顶点上:1个晶胞2个晶胞共用4个晶胞共用8个晶胞共用位于顶点的微粒,晶胞完全拥有其1/8。
位于面心的微粒,晶胞完全拥有其1/2。
位于棱上的微粒,晶胞完全拥有其1/4。
位于体心上的微粒,微粒完全属于该晶胞。结论: 例.在氯化钠晶胞中,实际的钠离子和氯离子各有多少个?写出它的化学式。晶胞中的钠离子数氯离子数即钠离子与氯离子个数比为4:4=1:1,
故氯化钠的化学式为NaCl N总=N内+N面×1/2+N棱×1/4+N顶点×1/8晶胞中微粒数及化学式的计算1.根据离子晶体的晶胞结构,判断下列离子
晶体的化学式:(A表示阳离子)AB化学式:AB2. 写出下列离子晶体的化学式 该晶体的化学式为
A3B (或BA3) 3、离子晶体的物理性质:离子晶体一般拥有较高的熔沸点(1)硬度:3、离子晶体的物理性质:离子晶体一般拥有较高的硬度(1)硬度:(2)溶沸点:离子晶体一般拥有较高的溶沸点3、离子晶体的物理性质:离子晶体一般拥有较高的熔沸点离子晶体一般拥有较高的硬度为什么离子晶体一般拥有较高的硬度
和熔沸点呢?思考:构成离子晶体的粒子是阴阳离子,离子排列紧密有序;
阴阳离子之间的作用是强烈的离子键,
所以离子晶体一般拥有较高的熔沸点。(1)硬度:(2)溶沸点:3、离子晶体的物理性质:离子晶体一般拥有较高的熔沸点离子晶体一般拥有较高的硬度(1)硬度:(2)溶沸点:离子晶体的熔沸点比较规律:一般来说:
1、阴阳离子半径越小,离子键就越强烈,溶沸点越高。2、阴阳离子电荷数越多,离子键就越强烈,溶沸点越高。熔沸点: NaF > NaCl> NaBr> NaI;熔沸点:NaCl >CsCl熔沸点:MgO>NaCl3、离子晶体的物理性质:离子晶体一般拥有较高的熔沸点离子晶体一般拥有较高的硬度(1)硬度:(2)溶沸点:离子晶体的熔沸点比较规律:一般来说:
1、阴阳离子半径越小,离子键就越强烈,溶沸点越高。2、阴阳离子电荷数越多,离子键就越强烈,溶沸点越高。(3)导电性:当离子晶体为固体时不能导电,熔化或溶于水后可以导电。(4)溶解性:离子晶体大多数能溶于水。阴阳离子离子键较大较高固体不导电,熔化或
溶于水后可导电。多数易溶于水大多数盐、金属氧化物、强碱等小结:课堂练习:1、下列物质中,属于离子晶体的是( );只含离子键的离子晶体是( ); 含极性共价键的离子晶体是( );含非极性共价键的离子晶体是( )。
KBr 、 NaOH、 HCl、 CO2、 NH4Cl、 I2 、 Na2O2、CCl4、N2、CaO、H2S、H2O2、HNO3、Na2SO4 离子晶体:KBr 、 NaOH、 NH4Cl、 Na2O2、
CaO、Na2SO4 只含离子键的离子晶体:KBr 、CaO含极性共价键的离子晶体:NaOH、 NH4Cl、 Na2SO4 含非极性共价键的离子晶体:Na2O2 课堂练习:2、下列说法正确的是( )
A、离子晶体中只含离子键。
B、不同元素组成的多原子分子里的化学键一定是极 性键。
C、共价化合物分子里一定不含离子键。
D、非极性键只存在于双原子单质分子中。C3、在一个氯化铯晶胞内存在 个Cl- ,在一个氯化铯晶胞内存在 个Cs+,与Cl-距离最近且相等的Cs+有 个, Cl-有 个。11课堂练习:864、如右图所示的晶体结构是一种具有优良压电、铁电、电光等功能的晶体材料的晶胞。
(1)晶体内与每个“Ti”紧邻的O原子数为 个? (2)晶体的化学式为( )
A、BaTi8O12 B、BaTi4O9
C、BaTiO3 D、BaTi2O3 6C课堂练习:5、若已知NaCl的密度为 ,则NaCl晶体中Na+与Na+的最短距离是多少?∴ Na+ 与Na+之间的最短距离为课堂练习:氯离子钠离子再见!谢谢指导!
