分子晶体[下学期]
图片预览






文档简介
课件14张PPT。第一节 离子晶体、分子晶体和原子晶体1二、分子晶体(1)分子间作用力又称_________________力。
分子间作用力存在于_____________之间。
(2)影响因素
①分子的极性
②组成和结构相似的:___________________。范德瓦耳斯分子相对分子质量的大小1分子晶体分子晶体的物理性质:定义:实例:如干冰形成分子晶体的物质: 熔、沸点低,硬度小,在水
中的溶解度存在很大的差异。H2、Cl2、He 、HCl 、H2O、CO2等 分子间通过分子间作用力相结合的晶体,
叫做分子晶体。 1范德华力共价键干冰的晶体结构示意图1[例1]在干冰晶体中每个CO2分子周围紧邻的
CO2分子有___________个.121[例2]共价键、离子键和范德瓦耳斯力是构成物质粒子间的不同作用
方式,下列物质中,只含有上述一种作用的是 ( )
A.干冰 B.氯化钠
C.氢氧化钠 D.碘 B[例3]在解释下列物质性质的变化规律与物质结构间的因果关系时,
与键能无关的变化规律是( )
A.HF、HCI、HBr、HI的热稳定性依次减弱
B.NaF、NaCl、NaBr、NaI的熔点依次减低
C.F2、C12、Br2、I2的熔、沸点逐渐升高
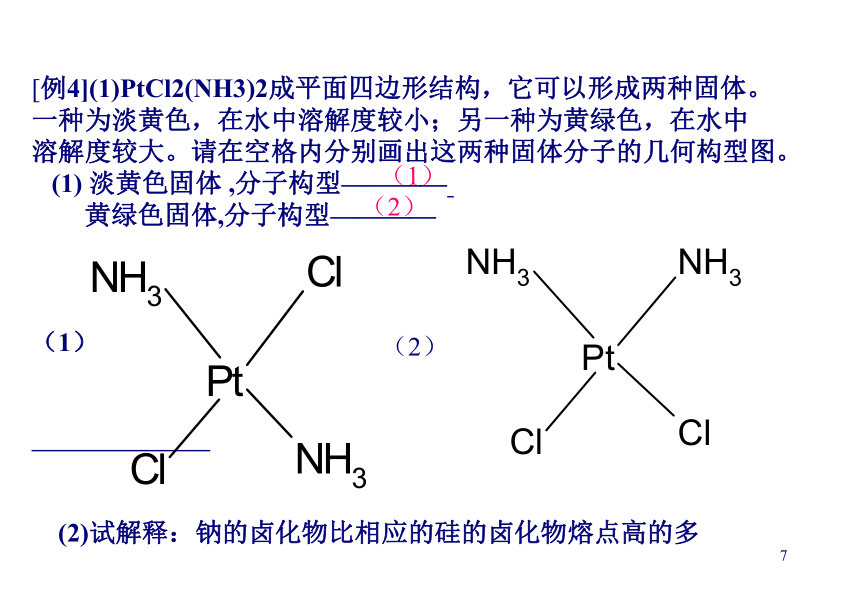
D.H2S的熔沸点小于H2O的熔、沸点 CD1[例4](1)PtCl2(NH3)2成平面四边形结构,它可以形成两种固体。
一种为淡黄色,在水中溶解度较小;另一种为黄绿色,在水中
溶解度较大。请在空格内分别画出这两种固体分子的几何构型图。
(1) 淡黄色固体 ,分子构型————
黄绿色固体,分子构型————
(1)
(2)试解释:钠的卤化物比相应的硅的卤化物熔点高的多(2)(1)(2)1小结
1.离子间通过离子键结合而成的晶体叫做离子晶体。构成离子
晶体的微粒是阴阳离子。离子键较强烈,所以离子晶体具有较高
的熔点和沸点。
2.分子间通过分子作用力相结合的晶体叫分子晶体。构成分子
晶体的微粒是分子。分子晶体中,由于分子间作用力较弱,因此,
分子晶体一般硬度较小,熔、沸点较低。
3.一般来说,对于组成和结构相似的物质,分子间作用力随着
相对分子质量增加而增大,物质的熔点、沸点也升高。例如:
F24.组成相似的分子,极性分子的熔、沸点大于非极性分子,
如:SO2>CO2 15.影响分子间作用力的因素:
①分子的极性
②相对分子质量的大小。
这里所说的分子的极性,一般指极性特别强的,即第二周期的
几种活泼非金属的氢化物:HF、H20、NH3。
其他组成和结构相似物质分子间作用力的大小,则要看其相对
分子质量的大小。
相对分子质量大的分子,分子间作用力越强。
1111 这是因为它们的分子之间存在着一种比分子间作用力稍强的相互作用,使得它们只有在较高的温度下才能汽化。这种物质的分子间存在的相互作用叫做氢键。为什么会产生这种氢键呢? 这是因为H原子与另外一个分子中带负电的原子相互吸引。阅读P41氢键的形成氢键共价键1
分子间作用力存在于_____________之间。
(2)影响因素
①分子的极性
②组成和结构相似的:___________________。范德瓦耳斯分子相对分子质量的大小1分子晶体分子晶体的物理性质:定义:实例:如干冰形成分子晶体的物质: 熔、沸点低,硬度小,在水
中的溶解度存在很大的差异。H2、Cl2、He 、HCl 、H2O、CO2等 分子间通过分子间作用力相结合的晶体,
叫做分子晶体。 1范德华力共价键干冰的晶体结构示意图1[例1]在干冰晶体中每个CO2分子周围紧邻的
CO2分子有___________个.121[例2]共价键、离子键和范德瓦耳斯力是构成物质粒子间的不同作用
方式,下列物质中,只含有上述一种作用的是 ( )
A.干冰 B.氯化钠
C.氢氧化钠 D.碘 B[例3]在解释下列物质性质的变化规律与物质结构间的因果关系时,
与键能无关的变化规律是( )
A.HF、HCI、HBr、HI的热稳定性依次减弱
B.NaF、NaCl、NaBr、NaI的熔点依次减低
C.F2、C12、Br2、I2的熔、沸点逐渐升高
D.H2S的熔沸点小于H2O的熔、沸点 CD1[例4](1)PtCl2(NH3)2成平面四边形结构,它可以形成两种固体。
一种为淡黄色,在水中溶解度较小;另一种为黄绿色,在水中
溶解度较大。请在空格内分别画出这两种固体分子的几何构型图。
(1) 淡黄色固体 ,分子构型————
黄绿色固体,分子构型————
(1)
(2)试解释:钠的卤化物比相应的硅的卤化物熔点高的多(2)(1)(2)1小结
1.离子间通过离子键结合而成的晶体叫做离子晶体。构成离子
晶体的微粒是阴阳离子。离子键较强烈,所以离子晶体具有较高
的熔点和沸点。
2.分子间通过分子作用力相结合的晶体叫分子晶体。构成分子
晶体的微粒是分子。分子晶体中,由于分子间作用力较弱,因此,
分子晶体一般硬度较小,熔、沸点较低。
3.一般来说,对于组成和结构相似的物质,分子间作用力随着
相对分子质量增加而增大,物质的熔点、沸点也升高。例如:
F2
如:SO2>CO2 15.影响分子间作用力的因素:
①分子的极性
②相对分子质量的大小。
这里所说的分子的极性,一般指极性特别强的,即第二周期的
几种活泼非金属的氢化物:HF、H20、NH3。
其他组成和结构相似物质分子间作用力的大小,则要看其相对
分子质量的大小。
相对分子质量大的分子,分子间作用力越强。
1111 这是因为它们的分子之间存在着一种比分子间作用力稍强的相互作用,使得它们只有在较高的温度下才能汽化。这种物质的分子间存在的相互作用叫做氢键。为什么会产生这种氢键呢? 这是因为H原子与另外一个分子中带负电的原子相互吸引。阅读P41氢键的形成氢键共价键1
