离子晶体[下学期]
图片预览






文档简介
课件23张PPT。离 子 晶 体 化学家单斯诺在玩水晶时,不小心把水晶打烂了,当他很心痛地弯腰捡起打碎了的水晶时,惊奇地发现,破碎了的水晶碎片都是一样的,具有固定的角度,这就是著名的晶面角守恒定理。 讨论总结:
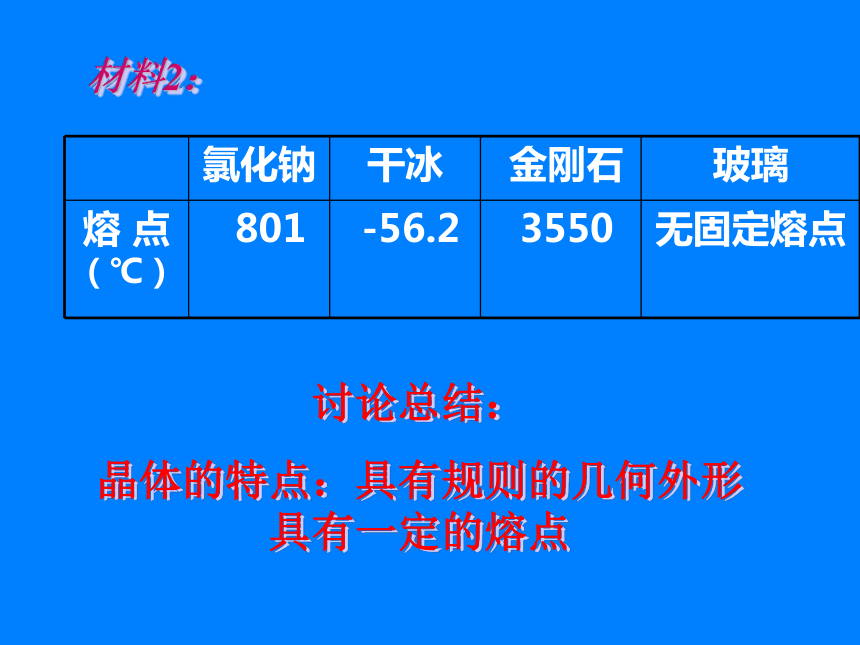
晶体的特点:具有规则的几何外形 具有一定的熔点
材料1:化学家单斯诺在玩水晶时,不小心把水晶打烂了,当他很心痛地弯腰捡起打碎了的水晶时,惊奇地发现,破碎了的水晶碎片都是一样的,具有固定的角度,这就是著名的晶面角守恒定理。 材料2:讨论总结:
晶体的特点:具有规则的几何外形 具有一定的熔点晶体的概念什么叫晶体:通过结晶过程形成的具有规则几何外形的固体叫晶体。晶体为什么具有规则的几何外形呢?构成晶体的微粒有规则排列的结果.晶体的分类:根据构成晶体的微粒和微粒间的作用.离子晶体、分子晶体、原子晶体、金属晶体晶体类型
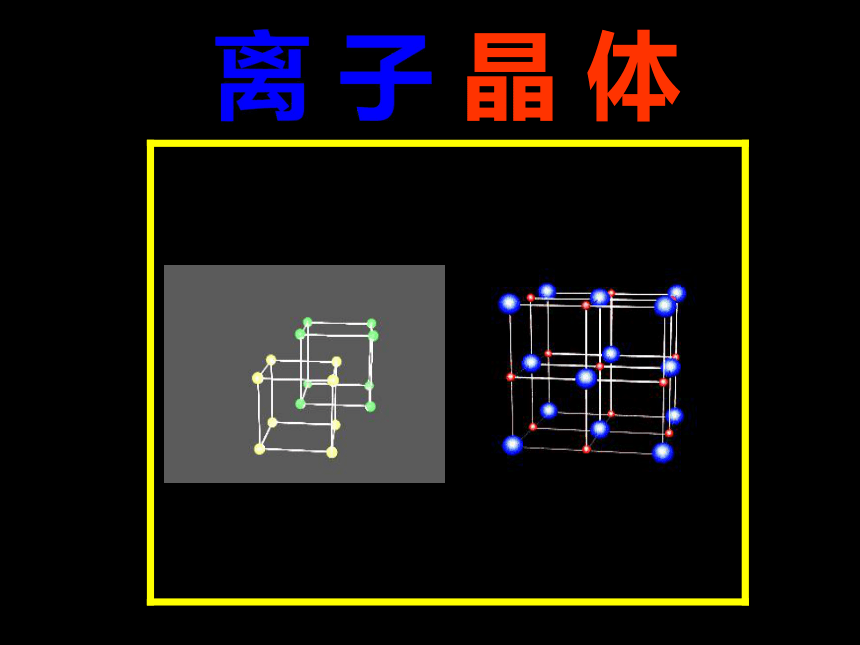
离子晶体
离子键
离子
较高
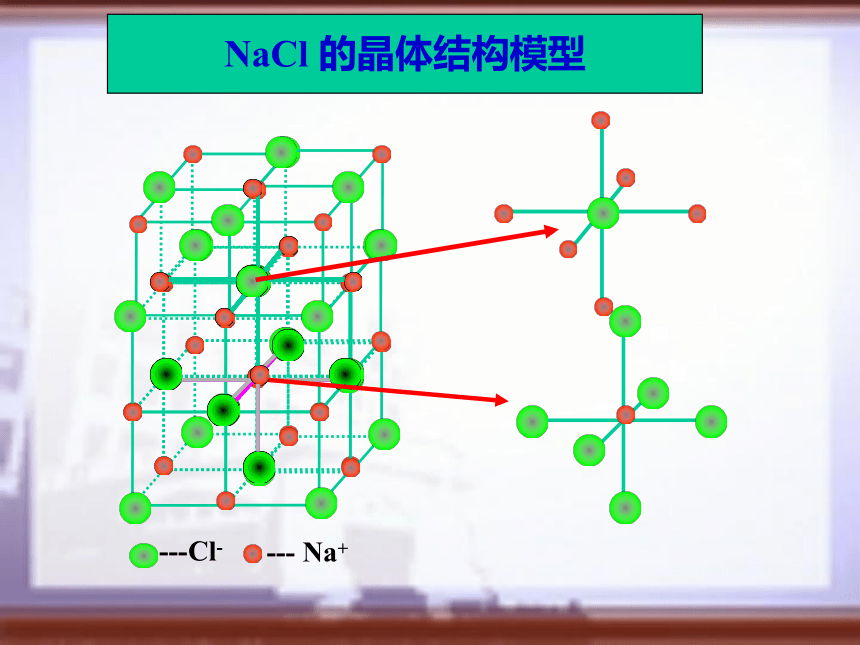
NaCl、CsCl微粒作用力熔沸点典型实例一、离子晶体的空间结构1、NaCl的晶体结构示意图NaCl 的晶体结构模型CsCl 的晶体结构模型2、CsCl的晶体结构示意图CsCl 的晶体结构模型离 子 晶 体离子晶体
离子晶体的特点
哪些物质属于离子晶体
离子间通过离子键结合而成的晶体。
①无单个分子存在;NaCl不表示分子式。
②熔沸点较高,硬度较大,难挥发难压缩。
③水溶液或者熔融状态下能导电。
强碱、部分金属氧化物、绝大部分盐类。二、离子晶体结构的计算(一).晶体中结构单元微粒实际数目的
计算、离子晶体化学式的确定位于顶点的微粒,晶胞完全拥有其1/8。
位于面心的微粒,晶胞完全拥有其1/2。
位于棱上的微粒,晶胞完全拥有其1/4。
位于体心上的微粒,微粒完全属于该晶胞。晶胞中的氯离子数=12× +1=4 钠离子数 = 8× + 6× = 4。 即钠离子与氯离子个数比为4:4=1:1,
故氯化钠的化学式为NaCl 1.根据离子晶体的晶胞结构,判断下列离子
晶体的化学式:(A表示阳离子)AB化学式:AB2. 写出下列离子晶体的化学式YXCaOTi该晶体的化学式为
XY2(或Y2X) 该晶体的化学式为
CaTiO33.1987年2月,朱经武(Paul Chu)
教授等发现钇钡铜氧化合物在90K温
度下具有超导性。若该化合物晶体的
晶胞结构如图所示,则该化合物的化
学式可能是 。
A.YBa2CuO7-X B.YBa2Cu2O7-X
C.YBa2Cu3O7-X D.YBa2Cu4O7-X C4.最近发现一种由钛原子和碳原子构成的气态团簇分
子,如右图所示:
顶点和面心的原子是钛原子,
棱的中心和体心的原子是碳原子,
它的化学式是( )Ti14C13(二)晶体中距离最近的微粒数的计算: 例2.在氯化钠晶体(如图)中,与氯离子距离最近的钠离
子有 个;与氯离子距离最近的氯离子_ 个。我们可以选定中心的氯离子作为基准,则与氯离子距离最近的钠离子位于立方体六个面的面心上,他们之间的最近距离为a/2 氯离子间的最近距离为 ,共有12个 设立方体的边长为a,612(四).综合计算 例4:(99年全国高考题)中学教材图示了氯化钠的
晶体结构,它向三维空间伸得到完美的晶体。
NiO(氧化镍)晶体的结构与氯化钠相同,
Ni2+与最近距离的O2-为a × 10-8cm,计算晶
体的密度。(NiO的摩尔质量为74.7g/mol)我们可以选取最小的立方体,这个立方体中Ni2+和O2-的其体积为(a×10-8cm)3,个数均为4×1/8=1/2,则1mol氧化镍晶体其体积应为
2NA(a×10-8cm)3,质量为74.7g,
故氧化镍晶体的密度为三种典型立方晶体结构简单立方体心立方面心立方求晶体中粒子个数比的方法是:(1)处于顶点的粒子,同时为8个晶胞所共用,每个粒子有1/8属于该晶胞;(2)处于棱上的粒子,同时为4个晶胞所共用,每个粒子有1/4属于该晶胞;(3)处于面上的粒子,同时为2个晶胞所共用,每个粒子有1/2属于该晶胞;(4)处于晶胞内部的粒子,则完全属于该晶胞;
晶体的特点:具有规则的几何外形 具有一定的熔点
材料1:化学家单斯诺在玩水晶时,不小心把水晶打烂了,当他很心痛地弯腰捡起打碎了的水晶时,惊奇地发现,破碎了的水晶碎片都是一样的,具有固定的角度,这就是著名的晶面角守恒定理。 材料2:讨论总结:
晶体的特点:具有规则的几何外形 具有一定的熔点晶体的概念什么叫晶体:通过结晶过程形成的具有规则几何外形的固体叫晶体。晶体为什么具有规则的几何外形呢?构成晶体的微粒有规则排列的结果.晶体的分类:根据构成晶体的微粒和微粒间的作用.离子晶体、分子晶体、原子晶体、金属晶体晶体类型
离子晶体
离子键
离子
较高
NaCl、CsCl微粒作用力熔沸点典型实例一、离子晶体的空间结构1、NaCl的晶体结构示意图NaCl 的晶体结构模型CsCl 的晶体结构模型2、CsCl的晶体结构示意图CsCl 的晶体结构模型离 子 晶 体离子晶体
离子晶体的特点
哪些物质属于离子晶体
离子间通过离子键结合而成的晶体。
①无单个分子存在;NaCl不表示分子式。
②熔沸点较高,硬度较大,难挥发难压缩。
③水溶液或者熔融状态下能导电。
强碱、部分金属氧化物、绝大部分盐类。二、离子晶体结构的计算(一).晶体中结构单元微粒实际数目的
计算、离子晶体化学式的确定位于顶点的微粒,晶胞完全拥有其1/8。
位于面心的微粒,晶胞完全拥有其1/2。
位于棱上的微粒,晶胞完全拥有其1/4。
位于体心上的微粒,微粒完全属于该晶胞。晶胞中的氯离子数=12× +1=4 钠离子数 = 8× + 6× = 4。 即钠离子与氯离子个数比为4:4=1:1,
故氯化钠的化学式为NaCl 1.根据离子晶体的晶胞结构,判断下列离子
晶体的化学式:(A表示阳离子)AB化学式:AB2. 写出下列离子晶体的化学式YXCaOTi该晶体的化学式为
XY2(或Y2X) 该晶体的化学式为
CaTiO33.1987年2月,朱经武(Paul Chu)
教授等发现钇钡铜氧化合物在90K温
度下具有超导性。若该化合物晶体的
晶胞结构如图所示,则该化合物的化
学式可能是 。
A.YBa2CuO7-X B.YBa2Cu2O7-X
C.YBa2Cu3O7-X D.YBa2Cu4O7-X C4.最近发现一种由钛原子和碳原子构成的气态团簇分
子,如右图所示:
顶点和面心的原子是钛原子,
棱的中心和体心的原子是碳原子,
它的化学式是( )Ti14C13(二)晶体中距离最近的微粒数的计算: 例2.在氯化钠晶体(如图)中,与氯离子距离最近的钠离
子有 个;与氯离子距离最近的氯离子_ 个。我们可以选定中心的氯离子作为基准,则与氯离子距离最近的钠离子位于立方体六个面的面心上,他们之间的最近距离为a/2 氯离子间的最近距离为 ,共有12个 设立方体的边长为a,612(四).综合计算 例4:(99年全国高考题)中学教材图示了氯化钠的
晶体结构,它向三维空间伸得到完美的晶体。
NiO(氧化镍)晶体的结构与氯化钠相同,
Ni2+与最近距离的O2-为a × 10-8cm,计算晶
体的密度。(NiO的摩尔质量为74.7g/mol)我们可以选取最小的立方体,这个立方体中Ni2+和O2-的其体积为(a×10-8cm)3,个数均为4×1/8=1/2,则1mol氧化镍晶体其体积应为
2NA(a×10-8cm)3,质量为74.7g,
故氧化镍晶体的密度为三种典型立方晶体结构简单立方体心立方面心立方求晶体中粒子个数比的方法是:(1)处于顶点的粒子,同时为8个晶胞所共用,每个粒子有1/8属于该晶胞;(2)处于棱上的粒子,同时为4个晶胞所共用,每个粒子有1/4属于该晶胞;(3)处于面上的粒子,同时为2个晶胞所共用,每个粒子有1/2属于该晶胞;(4)处于晶胞内部的粒子,则完全属于该晶胞;
