晶体类型与性质[上学期]
文档属性
| 名称 | 晶体类型与性质[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 275.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-09-24 00:00:00 | ||
图片预览




文档简介
课件21张PPT。晶体类型与性质胡友谊[学法指导]
在学习中要加强对化学键中的非极性键、极性键、离子键、晶体类型及结构的认识与理解;在掌握微粒半径递变规律的基础上,分析离子晶体、原子晶体、分子晶体的熔点、沸点等物理性质的变化规律;并在认识晶体的空间结构的过程中,培养空间想象能力及思维的严密性和抽象性。
同时,关于晶体空间结构的问题,很容易与数学等学科知识结合起来,在综合题的命题方法具有广阔的空间,因此,一定要把握基础、领会实质,建立同类题的解题策略和相应的思维模式。
指出下列物质中所含化学键的类型、固态时属于什么晶体?
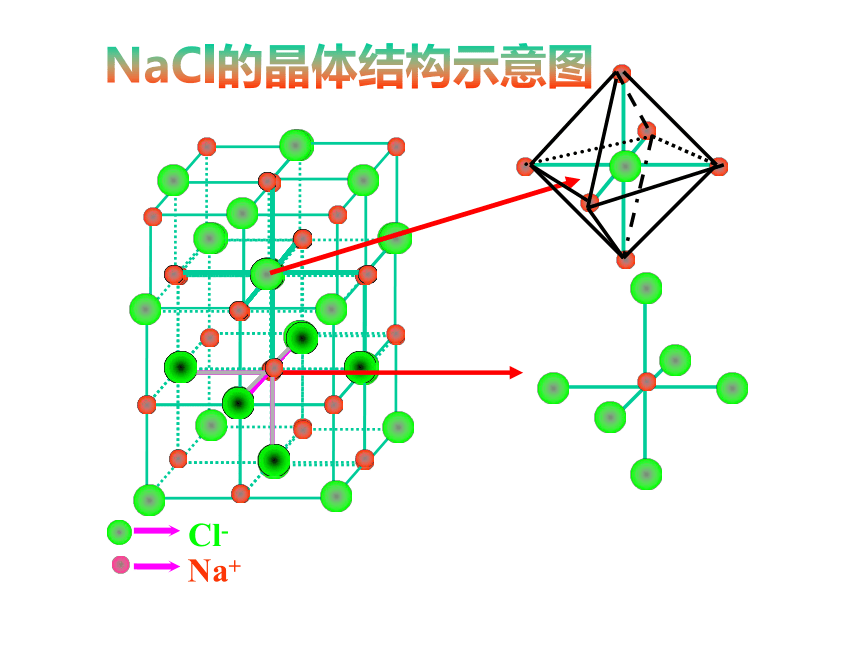
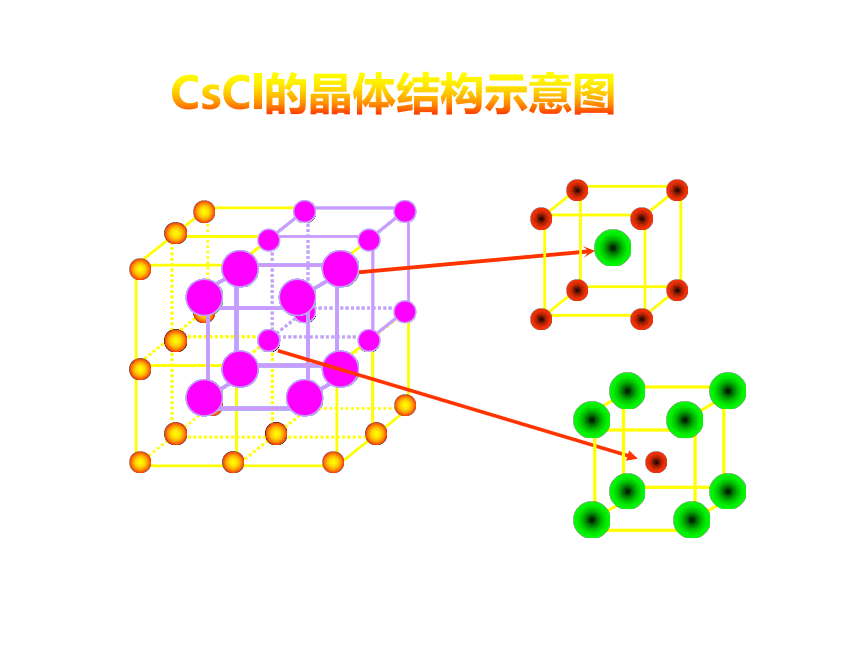
KF、CaCl2、NaOH、NH4ClNaCl的晶体结构示意图CsCl的晶体结构示意图定义:一、离子晶体实例:食盐、氯化铯物理性质:形成离子晶体的物质: 像氯化钠、氯化铯这样离子间通过
离子键结合而成的晶体叫做离子晶体。 具有较高的熔沸点,在熔融状态或水溶液中能
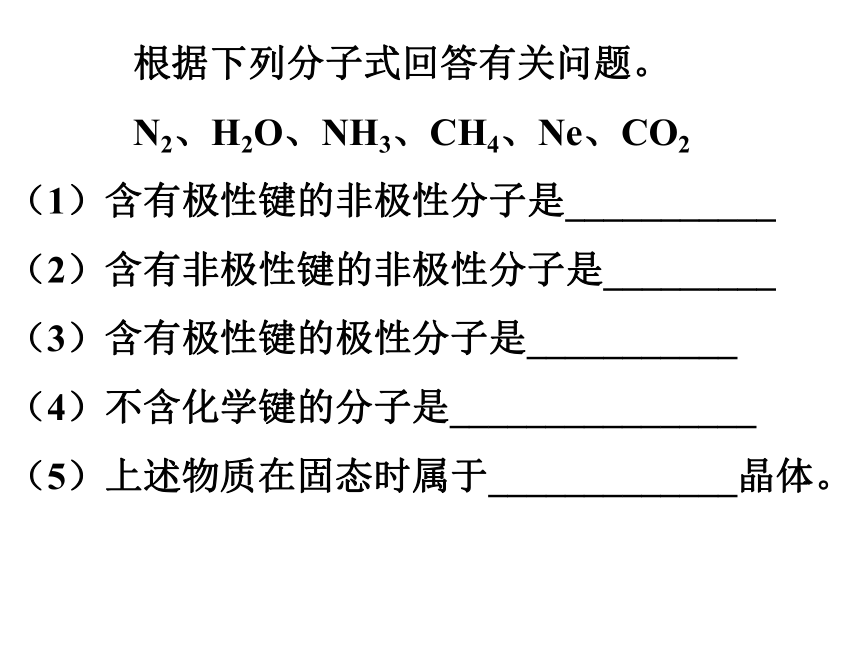
导电,有些离子晶体溶于水,有些难溶于水CaO NaOH CuSO4 NH4Cl Na2O2等 根据下列分子式回答有关问题。
N2、H2O、NH3、CH4、Ne、CO2
(1)含有极性键的非极性分子是___________
(2)含有非极性键的非极性分子是_________
(3)含有极性键的极性分子是___________
(4)不含化学键的分子是________________
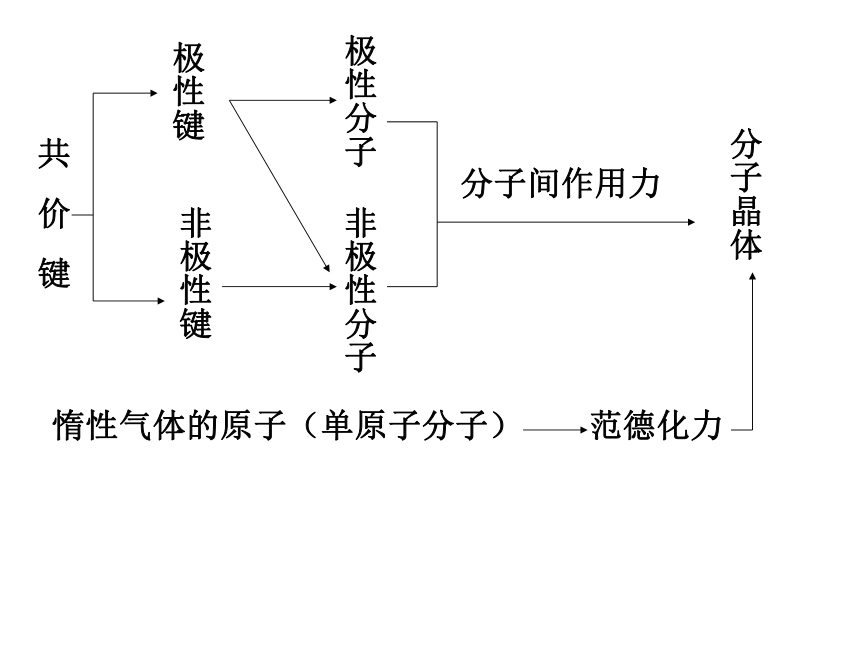
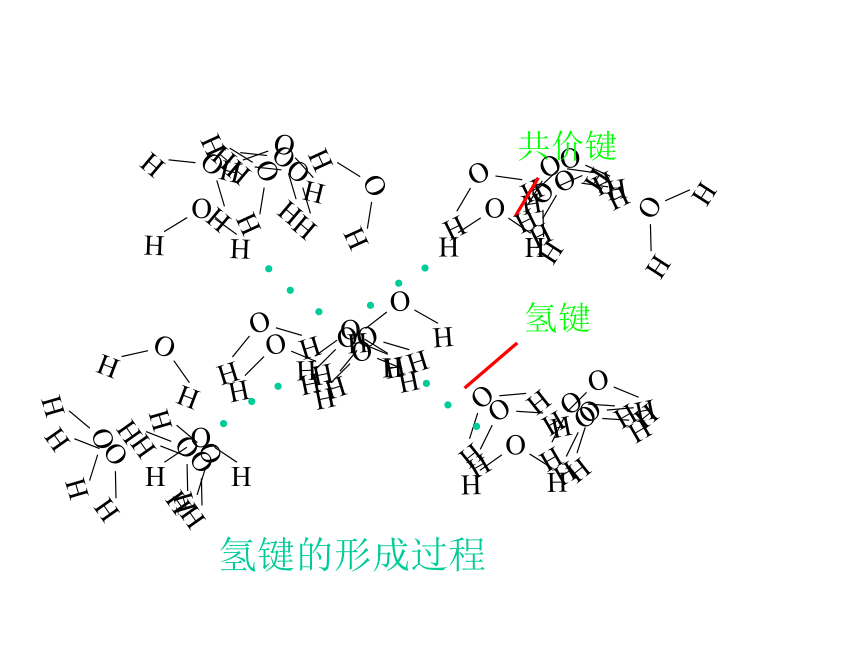
(5)上述物质在固态时属于_____________晶体。氢键的形成过程氢键共价键 二、分子晶体分子间作用力和氢键:
分子晶体:分子晶体的物理性质:定义:实例:如干冰形成分子晶体的物质:分子间作用力和氢键对一些物质的熔、沸点的关系 熔、沸点低,硬度小,在水
中的溶解度存在很大的差异。H2、Cl2、He 、HCl 、H2O、CO2等(氢键的形成过程) 分子间通过分子间作用力相
结合的晶体,叫做分子晶体。109.5o金刚石的晶体结构示意图共价键180o109.5oSio二氧化硅的晶体结构示意图共价键三、原子晶体定义:实例:原子晶体的物理性质:如二氧化硅晶体、金刚石常见的原子晶体:熔沸点很高,硬度很大,难溶于水,一般不导电。金刚石、金刚砂(SiC)、晶体硅、石英(SiO2) 这种相邻原子通过共价键结合而形成
空间网状结构的晶体,叫做原子晶体。化学键共价键(相邻原子以共价键结合成空间网状结构)原子晶体四、金属晶体定义:实例:金属晶体的物理性质:铜、镁有的熔沸点很高、有的熔沸点很低,有的硬度很大有的
很小,导电。 金属原子通过金属键形成的晶体称为金属晶体。金属晶体 紧密堆积A1堆积A3堆积A2堆积溶解性阴、阳离子分子原子阳离子、自由电子小结离子键范德华力共价键金属键略硬而脆硬度小硬度高相对高低高不导电不导电易溶可溶不溶导电不溶根据物质的物理性质判断晶体的类型 (1)在常温下呈气态或液态的物质,其晶体应属于分子晶体(Hg除外),如H2O、H2等。对于稀有气体,虽然构成物质的微粒为原子,但应看作单原子分子,因为微粒间的相互作用力是范德华力,而非共价键。 (2)在熔融状态下能导电的晶体(化合物)是离子晶体。如:NaCl熔融后电离出Na+和Cl-,能自由移动,所以能导电。 (3)有较高的熔、沸点,硬度大,并且难溶于水的物质大多为原子晶体,如晶体硅、二氧化硅、金刚石等。 (4)易升华的物质大多为分子晶体。 物质的熔沸点比较及规律 (1)不同类型的晶体,一般来讲,熔沸点按原子晶体>离子晶体>分子晶体。 (2)由共价键形成的原子晶体中,原子半径越小的,键长越短,键能越大,晶体的熔、沸点越高。如熔点:金刚石>石英>碳化硅>晶体硅。 (3)离子晶体比较离子键的强弱。一般地说,阴、阳离子的电荷数越多,离子半径越小,则离子间的作用就越强,其离子晶体的熔沸点就越高,如熔点:MgO>CaO>NaCl>CsCl。 (4)分子晶体:组成和结构相似的物质,相对分子质量越大,熔沸点越高;如Cl2N2。
KF、CaCl2、NaOH、NH4ClNaCl的晶体结构示意图CsCl的晶体结构示意图定义:一、离子晶体实例:食盐、氯化铯物理性质:形成离子晶体的物质: 像氯化钠、氯化铯这样离子间通过
离子键结合而成的晶体叫做离子晶体。 具有较高的熔沸点,在熔融状态或水溶液中能
导电,有些离子晶体溶于水,有些难溶于水CaO NaOH CuSO4 NH4Cl Na2O2等 根据下列分子式回答有关问题。
N2、H2O、NH3、CH4、Ne、CO2
(1)含有极性键的非极性分子是___________
(2)含有非极性键的非极性分子是_________
(3)含有极性键的极性分子是___________
(4)不含化学键的分子是________________
(5)上述物质在固态时属于_____________晶体。氢键的形成过程氢键共价键 二、分子晶体分子间作用力和氢键:
分子晶体:分子晶体的物理性质:定义:实例:如干冰形成分子晶体的物质:分子间作用力和氢键对一些物质的熔、沸点的关系 熔、沸点低,硬度小,在水
中的溶解度存在很大的差异。H2、Cl2、He 、HCl 、H2O、CO2等(氢键的形成过程) 分子间通过分子间作用力相
结合的晶体,叫做分子晶体。109.5o金刚石的晶体结构示意图共价键180o109.5oSio二氧化硅的晶体结构示意图共价键三、原子晶体定义:实例:原子晶体的物理性质:如二氧化硅晶体、金刚石常见的原子晶体:熔沸点很高,硬度很大,难溶于水,一般不导电。金刚石、金刚砂(SiC)、晶体硅、石英(SiO2) 这种相邻原子通过共价键结合而形成
空间网状结构的晶体,叫做原子晶体。化学键共价键(相邻原子以共价键结合成空间网状结构)原子晶体四、金属晶体定义:实例:金属晶体的物理性质:铜、镁有的熔沸点很高、有的熔沸点很低,有的硬度很大有的
很小,导电。 金属原子通过金属键形成的晶体称为金属晶体。金属晶体 紧密堆积A1堆积A3堆积A2堆积溶解性阴、阳离子分子原子阳离子、自由电子小结离子键范德华力共价键金属键略硬而脆硬度小硬度高相对高低高不导电不导电易溶可溶不溶导电不溶根据物质的物理性质判断晶体的类型 (1)在常温下呈气态或液态的物质,其晶体应属于分子晶体(Hg除外),如H2O、H2等。对于稀有气体,虽然构成物质的微粒为原子,但应看作单原子分子,因为微粒间的相互作用力是范德华力,而非共价键。 (2)在熔融状态下能导电的晶体(化合物)是离子晶体。如:NaCl熔融后电离出Na+和Cl-,能自由移动,所以能导电。 (3)有较高的熔、沸点,硬度大,并且难溶于水的物质大多为原子晶体,如晶体硅、二氧化硅、金刚石等。 (4)易升华的物质大多为分子晶体。 物质的熔沸点比较及规律 (1)不同类型的晶体,一般来讲,熔沸点按原子晶体>离子晶体>分子晶体。 (2)由共价键形成的原子晶体中,原子半径越小的,键长越短,键能越大,晶体的熔、沸点越高。如熔点:金刚石>石英>碳化硅>晶体硅。 (3)离子晶体比较离子键的强弱。一般地说,阴、阳离子的电荷数越多,离子半径越小,则离子间的作用就越强,其离子晶体的熔沸点就越高,如熔点:MgO>CaO>NaCl>CsCl。 (4)分子晶体:组成和结构相似的物质,相对分子质量越大,熔沸点越高;如Cl2
