晶体结构[上学期]
图片预览











文档简介
课件55张PPT。高三化学复习执教人:周官华物质结构金 刚 石 晶 体 结 构1、原子的组成一、原子结构1、原子的组成一、原子结构决定元素的性质
运动特征
分层排布1、三种关系质子数(Z)=核外电子数=核电荷数=原子序数质量数(A)=质子数(Z) +中子数(N) -表示核电荷数这Z,质量数为A的一个 原子对于阴离子:Z=核外电子数-电荷数
对于阳离子:Z=核外电子数+电荷数结构相同的微粒,从电子总数相等找对应关系课堂练习1、? 氢原子的电子云图中的表示的意义是?( )
A 一个小黑点表示一个电子 B 黑点的多少表示电子个数的多少
C 表示电子运动的轨迹 D 表示电子在核外空间出现机会的多少
2、? aXn-和 b Ym+两种离子,其电子层结构相同。下列关系式或化学式正确的是( )
A a+n=m-b B b-a=n+m
C 氧化物为YOm D 氢化物为HnX或XHn DBD3.含有相同质子数和电子数的两种微粒之间的关系不正确的是:( )
A.它们可能是同位素 B.可能是不同的分子
C.可能是不同的离子 D.可能是一种分子和一种离子D课堂练习4某元素的阳离子Rn+,核外电子数有X个,质量数A,则原子里的中子是( )
5 3.0克RO32-,电子数比质子数多0.1mol,则R的相对原子质量( )A-(X+N)122、判断原子结构的要点
(1)等式
①质量关系:A=Z+N
②电性关系
③同位素之间:Z相同,N不同
④ 主族元素:最高正价=最外层电子数;最高正价+|最低负价| =8
⑤元素的相对原子质量
元素的近似相对原子质量
一、原子结构5、判断原子结构的要点
(2)特征离子结构
①最外层电子数≥3,必是主族元素
最外层电子数为1-2,可能是IA、IIA、副族、He和某些离子(H-)
②次外层电子数为2个,可能是第二周期元素或第三周期元素的阳离子
③1H+就是质子
④ 自然界中非金属性最强的元素是F,金属性最强的是Cs.一、原子结构5、判断原子结构的要点
(3)注意
①相对原子质量≠ 质量数≠元素的相对原子质量≠摩尔质量
②同位素与同素异形体之间的区别
一、原子结构⑷、元素和同位素(1)元素具有相同核电荷数的一类原子的总称(2)同位素质子数相同,中子数不同的同一种
元素的不同种原子互称同位素6、下列属于原子的是_______,属于阴离子的是_________,属于同种元素的是______,属于同位素的是_____,属于同种物质的是_________(在(1)-(5)中数字依次表示质子数、中子数、核外电子数)
(1)26,30,26 (2)35,46,35
(3)26,30,24 (4)35,44,36
(5)35,44,35 (6)+19 2 8 8
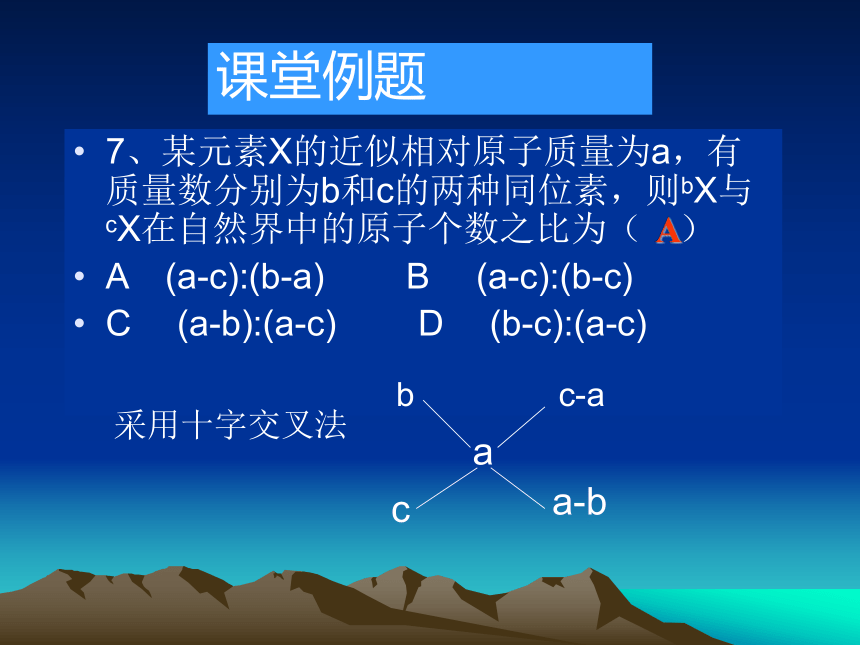
(7)二氧化碳,干冰 (8)水,重水课堂例题7、某元素X的近似相对原子质量为a,有质量数分别为b和c的两种同位素,则bX与cX在自然界中的原子个数之比为( )
A (a-c):(b-a) B (a-c):(b-c)
C (a-b):(a-c) D (b-c):(a-c) 课堂例题A采用十字交叉法 8[投影练习]有关 Cl-粒子,回答下列问题:?
(1)所含质子数 ;中子数 ,电子数
;质量数 。
?(2)该粒子的结构示意图 ;电子式 。?
(3)它与 Cl、 Cl之间的关系是 。?
(4)它与 Cl的半径大小的关系是 。?
(5)已知Cl元素的相对原子质量为35.5,可知 Cl、
Cl原子在自然界的原子质量分数之比为 。课堂练习17 1818 35注意结构示意图和电子式的区别9、我国科学院近代物理研究所最近合成了 91239Pa原子。下列说法不正确的是( )
A、该原子是一种金属原子
B、该原子核内质子数与中子数之差为57
C、合成该原子就是合成了一种新的元素
D、这种原子具有放射性
课堂例题C10、[投影例题]R原子的核内质子数为m,中子数为n,则下列叙述错误的是( )?
A.这种元素的相对原子质量为m+n?
B.不能由此确定该元素的相对原子质量?
C.其原子质量与C原子质量之比约为:(m+n)∶12?
D.原子核内中子数为n的原子可能是R原子的同位素 课堂例题A课堂例题11、下列说法中不正确的是( )
①质子数相同的粒子一定属于同种元素 ②同位素的性质几乎完全相同 ③质子数相同,电子数也相同的粒子,不可能一种是分子,一种是离子 ④电子数相同的粒子不一定是同一种元素 ⑤一种元素只能有一种质量数 ⑥某种元素的相对原子质量取整数,就是其质量数
A、①②③④ B、 ③④⑤⑥
C、 ②③⑤⑥ D、 ①②⑤⑥D6、核外电子的排布一、原子结构(1)电子层名称 K L M N O P 。。。
(2)表示:原子(离子)结构示意图
(3)价电子
(4)排布规律
①能量最低原则
②2n2规则
③限制:最外层;次外层;倒数第三层课堂练习12、下列数字为几种元素的核电荷数,其中原子核外最外层电子数最多的是( )
A、8 B、14 C、20 D、34
AD课堂练习1~20号元素粒子结构的特点
13.今有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰为A原子L层电子数的2倍。A和B分别是( ) (A) Si和Al (B) N和P (C) F和Cl (D) C和Al D6、核外电子的排布一、原子结构(5)特定电子数的微粒
10e:简单原子(离子):
分子(氢化物):
复杂离子:
18e:简单原子(离子):
分子(氢化物):
9+9型:
复杂离子:课堂例题答案(1)SH- (2)H2O2,PH3 (3)SiH4,CH3F,NH2OH
(4)CH3OH,N2H4 (5)CH3NH2 (6)CH3CH3
(7)NH4F (电子式略)14、按要求写出下列微粒的电子式。
(1)由2个原子核和18个电子组成的阴离子:
(2)由4个原子核和18个电子组成的化合物:
(3)由5个原子核和18个电子组成的化合物:
(4)由6个原子核和18个电子组成的化合物:
(5)由7个原子核和18个电子组成的化合物:
(6)由8个原子核和18个电子组成的化合物:
(7)在短周期元素中,由三种元素组成的既有离子键、共价键的配位键且阴、阳离子含电子总数相等的是:SH-H2O2,PH3 SiH4,CH3F,NH2OHCH3OH,N2H4CH3NH2CH3CH3
NH4F课堂例题15、有几种微粒的电子层结构如下所示
(1)某电中性的原子,一般不与其它元素的原子反应,这种微粒符号是___________
(2)某微粒的盐溶液,能使溴水褪色,并出现浑浊,这种微粒符号是___________
(3)某微粒氧化性甚弱,但得电子后还原性强,且这种原子最外层只有一个电子,这种微粒符号是________
(4)某微粒还原性虽弱,但失电子后形成的原子氧化性强,且这种原子得一个电子即达稳定结构,这种微粒符号是___________288ArK+Cl-S2-本节课到此为止
再见1、化学键
定义:分子中或晶体中相邻的两个或多个原子之间强烈的相互作用。二、分子结构(1)概念二、分子结构(1)概念
(2)常见物质的键角二、分子结构P4:60o H2S:92o
H2O:104.5o NH3:107o18’
CH4、CCl4、金刚石、Si、SiH4:109o28’
C2H4、BF3、苯、石墨:120o
CO2、CS2、C2H2:180o (3)化学键的知识点滴
①只有非极性键的物质:
②只有极性键的物质:
③既有非极性键又有极性键的物质:
④只有离子键的物质:
⑤既有离子键,又有非极性共价键的物质:
⑥由离子键、共价键、配位键构成的物质:
⑦只含共价键而无范德华力的物质:
⑧由强极性键构成但不是强电解质的物质:
⑨无化学键的物质:二、分子结构2、分子间作用力
(1)定义:分子间存在的较弱的作用力。
(2)应用:
a 决定分子晶体的熔沸点
b 组成与结构相似的物质,其摩尔质量越大,分子间作用力越大。
二、分子结构3、分子的极性
(1)定义:
非极性分子:整个分子中的电荷分布是均匀的、对称的。
极性分子:整个分子中的电荷分布是不均匀的、不对称的。
(2)判断依据:键的极性与分子的空间构型
二、分子结构1、概念及比较
离子晶体 原子晶体 分子晶体 金属晶体
构成微粒 阴阳离子 原子 分子 金属阳离子
和自由电子
微粒间作用力
熔沸点 较高 很高 低 多数高,少数低
硬度 硬而脆 很大 很小 有硬,有软
导电 熔化、溶于水 不导电 不导电 电的良导体
导热性 热的不良导体 热的良导体
物质类别 强碱 C、硅 金属单质
绝大部分盐 SiO2、SiC 和合金
某些氧化物
三、晶体结构2、晶体类型的判断
含离子键的化合物
固态不导电,熔融状态下导电的物质
熔沸点高,能溶于水而不溶于有机溶剂的物质
常温下是固体,熔沸点高,不溶于水和有机溶剂的物质
直接由原子构成,以共价键结合,排列成空间网状结构
含有分子的晶体
室温下是气体或易挥发、易升华的物质或易溶于有机溶剂的物质
金属单质或合金
常温下固体能导电、导热或有延展性的物质三、晶体结构1、下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是( )
A、SO2和SiO2
B、CO2和H2O
C、NaCl和HCl
D、CCl4和KCl
课堂例题2、下列各晶体熔化时只需克服分子间作用力的是( )
A、SO2 B、Ag
C、SiO2 D、C6H6
课堂例题3、同主族元素所形成的同一类型化合物,其结构和性质往往相似,化合物PH4I是一种无色晶体,下列对它的描述错误的是( )
A、是一种离子晶体
B、与碱研磨不反应
C、加热时易升华
D、易溶于水呈酸性
课堂例题4、分析下列各物质的物理性质,判断其固态不属于分子晶体的是( )
A、碳化铝,黄色晶体,熔点2200℃,熔融态不导电
B、溴化铝,无色晶体,熔点98 ℃,熔融态不导电
C、五氟化钒、无色晶体,熔点19.5 ℃,易溶于乙醇、氯仿、丙酮中
D、溴化钾、无色晶体,熔融时或溶于水中都能导电。
课堂例题5、氯化铝是白色固体,180 ℃时升华,能溶于有机溶剂,可见它是______晶体。从蒸气密度的测定表明,它具有双分子缔合结构,可见在两个分子间形成_____键,其结构式为_________。课堂例题3、物质熔沸点的比较
(1)不同晶体类型
原子晶体>离子晶体、金属晶体>分子晶体
(2)同种晶体类型
①原子晶体
②离子晶体
③金属晶体
同主族: 同周期: 合金<各成分
④分子晶体
a 组成与结构相似的物质:
b 组成与结构不相似,但M相近的物质:
c 同分异构体:与分子的形状有关
d 与C=C有关:硬脂酸甘油酯>汕酸甘油酯三、晶体结构4、常见晶体的结构
(1)NaCl
1个Na+周围最近的Cl-有几个?
1个Cl- 周围最近的Na+ 有几个?
1个Cl- 周围最近的Cl-有几个?
设晶胞边长为a,则离子键键长为多少?
(2)CsCl
(3)CO2
(4)金刚石
(5)石墨三、晶体结构1、核外电子排布的周期性变化
(1) 最外层电子数
(2) 电子层数
2、元素性质的周期性变化
(1)原子半径周期性变化
(2)元素的金属性、非金属性
(3)气态氢化物的稳定性
(4)最高价氧化物的水化物的酸碱性
3、化合价的周期性变化
+1 +2 +3 +4 +5 +6 +7
-4 -3 -2 -1 四、元素周期律原子半径数据
Li Be B C N O F
1.52 0.89 0.82 0.77 0.75 0.74 0.71
Na Mg Al Si P S Cl
1.86 1.60 1.43 1.17 1.10 1.02 0.99
---------------------------------------------------------------
H Li Na K Rb Cs Fr
0.32 1.52 1.86 2.27 2.48 2.65 2.70
数据1、结构五、元素周期表
短周期 第1、2、3周期
周期
长周期 第4、5、6、7周期
主族 IA-VIIA
副族 IB-VIIB
族 0族
VIII族元素种类
2,8,818,18,32,3238
6
92、与原子结构的关系
原子序数=质子数
周期序数=电子层数
主族族序数=最外层电子数
五、元素周期表3、与性质的关系
(1)同周期:
(2)同主族:
五、元素周期表元素金属性强弱的比较依据1.同周期元素,从左到右金属性减弱
2.同主族元素,从上到下金属性增强
3.与水的反应剧烈程度.
4.与酸的反应剧烈程度
5.最高价氧化物的水化物的碱性强弱
6.金属活动性顺序
7.与盐溶液的置换反应
8.不同金属单质还原同一种氧化剂的程度
9.在原电池的二个电极中,作负极的金属性强
10.电解含不同金属离子的溶液时,阴极上先析出的金属性弱元素非金属性强弱的比较依据1.同周期元素,从左到右非金属性增强
2.同主族元素,从上到下非金属性减弱
3.与氢气的反应剧烈程度.
4.气态氢化物的稳定性
5.最高价氧化物的水化物的酸性强弱
6.非金属活动性顺序
7.与盐溶液的置换反应
8.不同非金属单质氧化同一种还原剂的程度
9.电解含不同非金属阴离子的溶液时,阳极上先反应的元素非金属性弱
3、与性质的关系
(1)同周期:
(2)同主族:
(3)价电子:
五、元素周期表1、两种短周期的元素X和Y,可组成化合物XY3,当Y的原子序数为m时,X的原子序数为(1)m-4 (2)m+4 (3)m+8 (4)m-2 (5)m+6。其中正确的组合是( )
A、(1)(2) B、(1)(2)(3)
C、(1)(2)(5)
D、(1)(2)(3)(4)(5)
课堂例题√2、 X和Y是短周期元素,两者组成化学式为X2Y3的化合物。已知X的原子序数为m,则Y的原子序数可能是(1)m+3 (2)m-3 (3)m+5 (4)m-5 (5)m-11。则Y的原子序数可能是( )
A、(1)(4)
B、(2)(3)
C、(1)(4)(5)
D、(1)(2)(3)(4)(5)
课堂例题√4、元素周期表的应用
(1)找特定元素
非金属性最强的元素:F
金属性最强的元素:Cs
地壳中的元素含量:O、Si、Al、Fe
熔点最低非金属:He 熔点最低金属:Hg
熔点最高非金属:C
农药元素:
半导体材料:
催化剂材料:五、元素周期表(2)元素结构与性质推断
①推测原子结构
原子结构示意图、电子式、分子式、结构式
②元素的性质
金属性和非金属性;酸碱的酸碱性强弱;
气态氢化物的稳定性;与某些物质的反应。五、元素周期表(3)微粒半径大小的比较
①同周期:从左到右原子半径由大到小
②同主族:
从上到下:原子半径由小到大
阳离子半径由小到大
阴离子半径由小到大
③同一元素
阳离子半径<原子半径
阴离子半径>原子半径
④相同电子层结构的不同简单离子
核电荷数越大,离子半径越小五、元素周期表1、有a、b、c、d四种元素,a、b的阳离子与c、d的阴离子具有相同的电子层结构,a的阳离子的正电荷数小于b的阳离子,c的阴离子负电荷数大于d的阴离子,则它们的离子半径关系是( )
A、a>b>c>d B、b>a>d>c
C、c>a>d>b D、c>d>a>b
课堂例题√2、有An+、B(n+1)+、Cn-、D(n+1)- 都具有相同的电子层结构,则A、B、C、D的原子半径由大到小的顺序是( )
A、A>B>C>D B、A>B>D>C
C、D>C>A>B D、D>B>C>A
课堂例题√3、已知A元素的原子序数为38,试推断:
(1)A元素的符号及在周期表中的位置。
(2)A和水反应情况
(3)A元素氧化物的水化物的碱性
(4)A元素氯化物的化学式、键型
(5)A元素的硫酸盐和碳酸盐的溶解性。
课堂例题4、白磷(P4)与氯气反应生成PCl3会放出大量热,生成物比反应物稳定得多。从键能数据简述其理由。(键能:Cl-Cl:247 P-P:196
P-Cl:331 单位:KJ/mol)
课堂例题Q=12×331KJ/mol-6×196KJ/mol
-6×247KJ/mol=1314KJ/mol
Bye Bye2005、10
运动特征
分层排布1、三种关系质子数(Z)=核外电子数=核电荷数=原子序数质量数(A)=质子数(Z) +中子数(N) -表示核电荷数这Z,质量数为A的一个 原子对于阴离子:Z=核外电子数-电荷数
对于阳离子:Z=核外电子数+电荷数结构相同的微粒,从电子总数相等找对应关系课堂练习1、? 氢原子的电子云图中的表示的意义是?( )
A 一个小黑点表示一个电子 B 黑点的多少表示电子个数的多少
C 表示电子运动的轨迹 D 表示电子在核外空间出现机会的多少
2、? aXn-和 b Ym+两种离子,其电子层结构相同。下列关系式或化学式正确的是( )
A a+n=m-b B b-a=n+m
C 氧化物为YOm D 氢化物为HnX或XHn DBD3.含有相同质子数和电子数的两种微粒之间的关系不正确的是:( )
A.它们可能是同位素 B.可能是不同的分子
C.可能是不同的离子 D.可能是一种分子和一种离子D课堂练习4某元素的阳离子Rn+,核外电子数有X个,质量数A,则原子里的中子是( )
5 3.0克RO32-,电子数比质子数多0.1mol,则R的相对原子质量( )A-(X+N)122、判断原子结构的要点
(1)等式
①质量关系:A=Z+N
②电性关系
③同位素之间:Z相同,N不同
④ 主族元素:最高正价=最外层电子数;最高正价+|最低负价| =8
⑤元素的相对原子质量
元素的近似相对原子质量
一、原子结构5、判断原子结构的要点
(2)特征离子结构
①最外层电子数≥3,必是主族元素
最外层电子数为1-2,可能是IA、IIA、副族、He和某些离子(H-)
②次外层电子数为2个,可能是第二周期元素或第三周期元素的阳离子
③1H+就是质子
④ 自然界中非金属性最强的元素是F,金属性最强的是Cs.一、原子结构5、判断原子结构的要点
(3)注意
①相对原子质量≠ 质量数≠元素的相对原子质量≠摩尔质量
②同位素与同素异形体之间的区别
一、原子结构⑷、元素和同位素(1)元素具有相同核电荷数的一类原子的总称(2)同位素质子数相同,中子数不同的同一种
元素的不同种原子互称同位素6、下列属于原子的是_______,属于阴离子的是_________,属于同种元素的是______,属于同位素的是_____,属于同种物质的是_________(在(1)-(5)中数字依次表示质子数、中子数、核外电子数)
(1)26,30,26 (2)35,46,35
(3)26,30,24 (4)35,44,36
(5)35,44,35 (6)+19 2 8 8
(7)二氧化碳,干冰 (8)水,重水课堂例题7、某元素X的近似相对原子质量为a,有质量数分别为b和c的两种同位素,则bX与cX在自然界中的原子个数之比为( )
A (a-c):(b-a) B (a-c):(b-c)
C (a-b):(a-c) D (b-c):(a-c) 课堂例题A采用十字交叉法 8[投影练习]有关 Cl-粒子,回答下列问题:?
(1)所含质子数 ;中子数 ,电子数
;质量数 。
?(2)该粒子的结构示意图 ;电子式 。?
(3)它与 Cl、 Cl之间的关系是 。?
(4)它与 Cl的半径大小的关系是 。?
(5)已知Cl元素的相对原子质量为35.5,可知 Cl、
Cl原子在自然界的原子质量分数之比为 。课堂练习17 1818 35注意结构示意图和电子式的区别9、我国科学院近代物理研究所最近合成了 91239Pa原子。下列说法不正确的是( )
A、该原子是一种金属原子
B、该原子核内质子数与中子数之差为57
C、合成该原子就是合成了一种新的元素
D、这种原子具有放射性
课堂例题C10、[投影例题]R原子的核内质子数为m,中子数为n,则下列叙述错误的是( )?
A.这种元素的相对原子质量为m+n?
B.不能由此确定该元素的相对原子质量?
C.其原子质量与C原子质量之比约为:(m+n)∶12?
D.原子核内中子数为n的原子可能是R原子的同位素 课堂例题A课堂例题11、下列说法中不正确的是( )
①质子数相同的粒子一定属于同种元素 ②同位素的性质几乎完全相同 ③质子数相同,电子数也相同的粒子,不可能一种是分子,一种是离子 ④电子数相同的粒子不一定是同一种元素 ⑤一种元素只能有一种质量数 ⑥某种元素的相对原子质量取整数,就是其质量数
A、①②③④ B、 ③④⑤⑥
C、 ②③⑤⑥ D、 ①②⑤⑥D6、核外电子的排布一、原子结构(1)电子层名称 K L M N O P 。。。
(2)表示:原子(离子)结构示意图
(3)价电子
(4)排布规律
①能量最低原则
②2n2规则
③限制:最外层;次外层;倒数第三层课堂练习12、下列数字为几种元素的核电荷数,其中原子核外最外层电子数最多的是( )
A、8 B、14 C、20 D、34
AD课堂练习1~20号元素粒子结构的特点
13.今有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰为A原子L层电子数的2倍。A和B分别是( ) (A) Si和Al (B) N和P (C) F和Cl (D) C和Al D6、核外电子的排布一、原子结构(5)特定电子数的微粒
10e:简单原子(离子):
分子(氢化物):
复杂离子:
18e:简单原子(离子):
分子(氢化物):
9+9型:
复杂离子:课堂例题答案(1)SH- (2)H2O2,PH3 (3)SiH4,CH3F,NH2OH
(4)CH3OH,N2H4 (5)CH3NH2 (6)CH3CH3
(7)NH4F (电子式略)14、按要求写出下列微粒的电子式。
(1)由2个原子核和18个电子组成的阴离子:
(2)由4个原子核和18个电子组成的化合物:
(3)由5个原子核和18个电子组成的化合物:
(4)由6个原子核和18个电子组成的化合物:
(5)由7个原子核和18个电子组成的化合物:
(6)由8个原子核和18个电子组成的化合物:
(7)在短周期元素中,由三种元素组成的既有离子键、共价键的配位键且阴、阳离子含电子总数相等的是:SH-H2O2,PH3 SiH4,CH3F,NH2OHCH3OH,N2H4CH3NH2CH3CH3
NH4F课堂例题15、有几种微粒的电子层结构如下所示
(1)某电中性的原子,一般不与其它元素的原子反应,这种微粒符号是___________
(2)某微粒的盐溶液,能使溴水褪色,并出现浑浊,这种微粒符号是___________
(3)某微粒氧化性甚弱,但得电子后还原性强,且这种原子最外层只有一个电子,这种微粒符号是________
(4)某微粒还原性虽弱,但失电子后形成的原子氧化性强,且这种原子得一个电子即达稳定结构,这种微粒符号是___________288ArK+Cl-S2-本节课到此为止
再见1、化学键
定义:分子中或晶体中相邻的两个或多个原子之间强烈的相互作用。二、分子结构(1)概念二、分子结构(1)概念
(2)常见物质的键角二、分子结构P4:60o H2S:92o
H2O:104.5o NH3:107o18’
CH4、CCl4、金刚石、Si、SiH4:109o28’
C2H4、BF3、苯、石墨:120o
CO2、CS2、C2H2:180o (3)化学键的知识点滴
①只有非极性键的物质:
②只有极性键的物质:
③既有非极性键又有极性键的物质:
④只有离子键的物质:
⑤既有离子键,又有非极性共价键的物质:
⑥由离子键、共价键、配位键构成的物质:
⑦只含共价键而无范德华力的物质:
⑧由强极性键构成但不是强电解质的物质:
⑨无化学键的物质:二、分子结构2、分子间作用力
(1)定义:分子间存在的较弱的作用力。
(2)应用:
a 决定分子晶体的熔沸点
b 组成与结构相似的物质,其摩尔质量越大,分子间作用力越大。
二、分子结构3、分子的极性
(1)定义:
非极性分子:整个分子中的电荷分布是均匀的、对称的。
极性分子:整个分子中的电荷分布是不均匀的、不对称的。
(2)判断依据:键的极性与分子的空间构型
二、分子结构1、概念及比较
离子晶体 原子晶体 分子晶体 金属晶体
构成微粒 阴阳离子 原子 分子 金属阳离子
和自由电子
微粒间作用力
熔沸点 较高 很高 低 多数高,少数低
硬度 硬而脆 很大 很小 有硬,有软
导电 熔化、溶于水 不导电 不导电 电的良导体
导热性 热的不良导体 热的良导体
物质类别 强碱 C、硅 金属单质
绝大部分盐 SiO2、SiC 和合金
某些氧化物
三、晶体结构2、晶体类型的判断
含离子键的化合物
固态不导电,熔融状态下导电的物质
熔沸点高,能溶于水而不溶于有机溶剂的物质
常温下是固体,熔沸点高,不溶于水和有机溶剂的物质
直接由原子构成,以共价键结合,排列成空间网状结构
含有分子的晶体
室温下是气体或易挥发、易升华的物质或易溶于有机溶剂的物质
金属单质或合金
常温下固体能导电、导热或有延展性的物质三、晶体结构1、下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是( )
A、SO2和SiO2
B、CO2和H2O
C、NaCl和HCl
D、CCl4和KCl
课堂例题2、下列各晶体熔化时只需克服分子间作用力的是( )
A、SO2 B、Ag
C、SiO2 D、C6H6
课堂例题3、同主族元素所形成的同一类型化合物,其结构和性质往往相似,化合物PH4I是一种无色晶体,下列对它的描述错误的是( )
A、是一种离子晶体
B、与碱研磨不反应
C、加热时易升华
D、易溶于水呈酸性
课堂例题4、分析下列各物质的物理性质,判断其固态不属于分子晶体的是( )
A、碳化铝,黄色晶体,熔点2200℃,熔融态不导电
B、溴化铝,无色晶体,熔点98 ℃,熔融态不导电
C、五氟化钒、无色晶体,熔点19.5 ℃,易溶于乙醇、氯仿、丙酮中
D、溴化钾、无色晶体,熔融时或溶于水中都能导电。
课堂例题5、氯化铝是白色固体,180 ℃时升华,能溶于有机溶剂,可见它是______晶体。从蒸气密度的测定表明,它具有双分子缔合结构,可见在两个分子间形成_____键,其结构式为_________。课堂例题3、物质熔沸点的比较
(1)不同晶体类型
原子晶体>离子晶体、金属晶体>分子晶体
(2)同种晶体类型
①原子晶体
②离子晶体
③金属晶体
同主族: 同周期: 合金<各成分
④分子晶体
a 组成与结构相似的物质:
b 组成与结构不相似,但M相近的物质:
c 同分异构体:与分子的形状有关
d 与C=C有关:硬脂酸甘油酯>汕酸甘油酯三、晶体结构4、常见晶体的结构
(1)NaCl
1个Na+周围最近的Cl-有几个?
1个Cl- 周围最近的Na+ 有几个?
1个Cl- 周围最近的Cl-有几个?
设晶胞边长为a,则离子键键长为多少?
(2)CsCl
(3)CO2
(4)金刚石
(5)石墨三、晶体结构1、核外电子排布的周期性变化
(1) 最外层电子数
(2) 电子层数
2、元素性质的周期性变化
(1)原子半径周期性变化
(2)元素的金属性、非金属性
(3)气态氢化物的稳定性
(4)最高价氧化物的水化物的酸碱性
3、化合价的周期性变化
+1 +2 +3 +4 +5 +6 +7
-4 -3 -2 -1 四、元素周期律原子半径数据
Li Be B C N O F
1.52 0.89 0.82 0.77 0.75 0.74 0.71
Na Mg Al Si P S Cl
1.86 1.60 1.43 1.17 1.10 1.02 0.99
---------------------------------------------------------------
H Li Na K Rb Cs Fr
0.32 1.52 1.86 2.27 2.48 2.65 2.70
数据1、结构五、元素周期表
短周期 第1、2、3周期
周期
长周期 第4、5、6、7周期
主族 IA-VIIA
副族 IB-VIIB
族 0族
VIII族元素种类
2,8,818,18,32,3238
6
92、与原子结构的关系
原子序数=质子数
周期序数=电子层数
主族族序数=最外层电子数
五、元素周期表3、与性质的关系
(1)同周期:
(2)同主族:
五、元素周期表元素金属性强弱的比较依据1.同周期元素,从左到右金属性减弱
2.同主族元素,从上到下金属性增强
3.与水的反应剧烈程度.
4.与酸的反应剧烈程度
5.最高价氧化物的水化物的碱性强弱
6.金属活动性顺序
7.与盐溶液的置换反应
8.不同金属单质还原同一种氧化剂的程度
9.在原电池的二个电极中,作负极的金属性强
10.电解含不同金属离子的溶液时,阴极上先析出的金属性弱元素非金属性强弱的比较依据1.同周期元素,从左到右非金属性增强
2.同主族元素,从上到下非金属性减弱
3.与氢气的反应剧烈程度.
4.气态氢化物的稳定性
5.最高价氧化物的水化物的酸性强弱
6.非金属活动性顺序
7.与盐溶液的置换反应
8.不同非金属单质氧化同一种还原剂的程度
9.电解含不同非金属阴离子的溶液时,阳极上先反应的元素非金属性弱
3、与性质的关系
(1)同周期:
(2)同主族:
(3)价电子:
五、元素周期表1、两种短周期的元素X和Y,可组成化合物XY3,当Y的原子序数为m时,X的原子序数为(1)m-4 (2)m+4 (3)m+8 (4)m-2 (5)m+6。其中正确的组合是( )
A、(1)(2) B、(1)(2)(3)
C、(1)(2)(5)
D、(1)(2)(3)(4)(5)
课堂例题√2、 X和Y是短周期元素,两者组成化学式为X2Y3的化合物。已知X的原子序数为m,则Y的原子序数可能是(1)m+3 (2)m-3 (3)m+5 (4)m-5 (5)m-11。则Y的原子序数可能是( )
A、(1)(4)
B、(2)(3)
C、(1)(4)(5)
D、(1)(2)(3)(4)(5)
课堂例题√4、元素周期表的应用
(1)找特定元素
非金属性最强的元素:F
金属性最强的元素:Cs
地壳中的元素含量:O、Si、Al、Fe
熔点最低非金属:He 熔点最低金属:Hg
熔点最高非金属:C
农药元素:
半导体材料:
催化剂材料:五、元素周期表(2)元素结构与性质推断
①推测原子结构
原子结构示意图、电子式、分子式、结构式
②元素的性质
金属性和非金属性;酸碱的酸碱性强弱;
气态氢化物的稳定性;与某些物质的反应。五、元素周期表(3)微粒半径大小的比较
①同周期:从左到右原子半径由大到小
②同主族:
从上到下:原子半径由小到大
阳离子半径由小到大
阴离子半径由小到大
③同一元素
阳离子半径<原子半径
阴离子半径>原子半径
④相同电子层结构的不同简单离子
核电荷数越大,离子半径越小五、元素周期表1、有a、b、c、d四种元素,a、b的阳离子与c、d的阴离子具有相同的电子层结构,a的阳离子的正电荷数小于b的阳离子,c的阴离子负电荷数大于d的阴离子,则它们的离子半径关系是( )
A、a>b>c>d B、b>a>d>c
C、c>a>d>b D、c>d>a>b
课堂例题√2、有An+、B(n+1)+、Cn-、D(n+1)- 都具有相同的电子层结构,则A、B、C、D的原子半径由大到小的顺序是( )
A、A>B>C>D B、A>B>D>C
C、D>C>A>B D、D>B>C>A
课堂例题√3、已知A元素的原子序数为38,试推断:
(1)A元素的符号及在周期表中的位置。
(2)A和水反应情况
(3)A元素氧化物的水化物的碱性
(4)A元素氯化物的化学式、键型
(5)A元素的硫酸盐和碳酸盐的溶解性。
课堂例题4、白磷(P4)与氯气反应生成PCl3会放出大量热,生成物比反应物稳定得多。从键能数据简述其理由。(键能:Cl-Cl:247 P-P:196
P-Cl:331 单位:KJ/mol)
课堂例题Q=12×331KJ/mol-6×196KJ/mol
-6×247KJ/mol=1314KJ/mol
Bye Bye2005、10
