原子晶体和分子晶体[上学期]
文档属性
| 名称 | 原子晶体和分子晶体[上学期] | 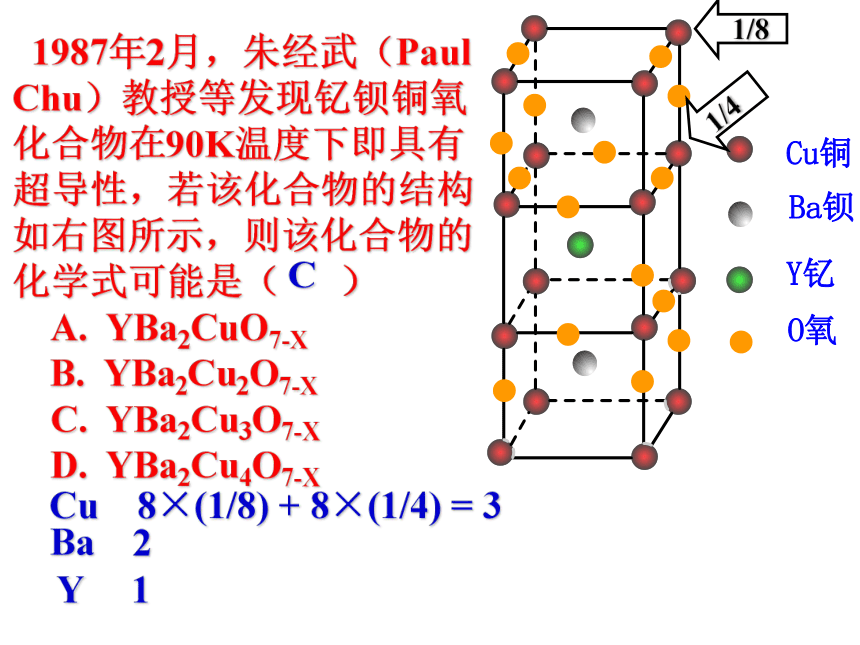 | |
| 格式 | rar | ||
| 文件大小 | 242.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-03-07 18:57:00 | ||
图片预览







文档简介
课件17张PPT。 1987年2月,朱经武(Paul Chu)教授等发现钇钡铜氧化合物在90K温度下即具有超导性,若该化合物的结构如右图所示,则该化合物的化学式可能是( )
A. YBa2CuO7-X
B. YBa2Cu2O7-X
C. YBa2Cu3O7-X
D. YBa2Cu4O7-XCu 8×(1/8) + 8×(1/4) = 3 Ba 2Y 1C分子晶体和原子晶体分子晶体知识回顾:
1.范德瓦耳斯力(分子间作用力)
(1)特征:能量小;广泛的存在分子之间(且分子间充分接触时才有相互间的作用力);本质为电性引力;只影响物质的物理性质(熔沸点)
(2)大小判断:组成和结构相似的物质,相对分子质量越大,分子间作用力也就越大(熔沸点也就越高)分子晶体知识回顾:
2.氢键
(1)本质:静电吸引作用(较强的分子间作用力) 主要存在于固体和液体中间
(2)形成条件:非金属性强;半径小;有孤对电子
(3)大小判断:非金属性的强弱
(4)表示方法:X H┄Y
(5)影响物质的其他性质:熔沸点;硬度;溶解度
注意:两个反常现象:水的沸点;冰的体积分子晶体知识回顾
3.分子晶体
(1)定义 :
(2) 构成 :
(3)3种物质结构:干冰;白磷;足球烯
(4) 性质:熔沸点低、硬度小;导电性;相似相溶原理1. 共价键、离子键和范德华力是构成物质粒子间的不同作用方式,下列物质中,只含有上述一种作用的是( )
(A)干冰 (B)氯化钠
(C)氢氧化钠 (D)碘2.最近科学家发现一种由钛原子和碳原子构成的气态团簇分子,如右图所示。顶角和面心的原于是钛原子,棱的中心和体心的原子是碳原子,则它的分子式是 ( )
A.TiC B.Ti4C4, C.Ti14C13 D.Ti13C14
3. 2003年春,北京小汤山等收治“非典”的定点医院,收到由解放军总装备部军事医学研究所研制的小分子团水,解决了医务人员工作时的如厕难题。新型小分子团“压缩”水,具有饮用量少、渗透力强、生物利用率高、在人体内储留时间长、排放量少的特点。一次饮用125mL小分子团水,可维持人体6小时正常需水量。下列关于小分子团水的说法正确的是( )
(A)水分子的化学性质发生了改变
(B)水分子中氧氢键数目增多
(C)分子团中水分子间主要以氢键结合
(D)水分子的结构、物理性质发生了改变4.1996年诺贝化学奖授予对发现C60有重大贡献的
三位科学家C60分子是形如球状的多面体(如图),
该结构的建立基于以下考虑:
①C60分子中每个碳原子只跟相邻的3个碳原子形
成化学键;
②C60分子只含有五边形和六边形;
③多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:
据上所述,可推知C60分子有12个五边形和20个六边形,C60分子所含的双键数为30。
回答下列问题:
(1)固体C60与金刚石相比较,熔点较高者应是_______,理由是__。
(2)试估计C60跟F2在一定条件下,能否发生反应生成C60F60(填“可能”或“不可能”)__________,并简述其理由:______________。
(3)通过计算,确定C60分子所含单键数。C60分子所含单键数为(4)C70分子也已制得,它的分子结构模型可以与C60同样考虑而推知.通过计算确定C70分子中五边形和六边形的数目.
(5)C70分子中所含五边形数为______,六边形数为_____。三、原子晶体1.组成:
2.定义:
3.结构:
4.熔沸点:原子 共价键 空间网状结构相邻原子间以共价键结合而成的空间
网状结构的晶体二氧化硅 金刚石键长越短,键能越大,共价键越稳定,熔沸点也就越高,反之越低练习:碳化硅SiC的一种晶体具有类似金刚石的结构,其中C原子和Si原子的位置是交替的。在下列三种晶体①金刚石 ②晶体硅 ③碳化硅中,它们的熔点从高到低的顺序是 ( )109o28′Sio二氧化硅的晶体结构示意图共价键109o28′金刚石的晶体结构示意图共价键石墨晶体——过渡型晶体或混合型晶体开拓思考题
仔细观察下边的示意图后,回答下列问题:
金刚石与石墨的熔点均很高,那么二者熔点是否相同?为什么?若不相同,哪种更高一些?1.下列的晶体中,化学键种类相同,晶体类型也相同的是( )
(A)SO2与SiO2 (B)C02与H2O
(C)NaCl与HCl (D)CCl4与KCl2.石墨晶体是层状结构,在每一层内;每一个碳原于都跟其他3个碳原子相结合,如图是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子数是( )
(A)10个 (B)18个
(C)24个 (D)14个3.下列关于只含非金属元素的化合物的说法正确的是
(A)一定是共价化合物,且只能构成分子晶体;
(B)其晶体不可能是离子晶体,因为微粒间的作用力只有分子间作用力;
(C)其晶体不可能是原子晶体,原子晶体只有非金属单质,没有化合物;
(D)可能是离子化合物。判断晶体类型的依据
(1)看构成晶体的微粒种类及微粒间的相互作用。
对分子晶体,构成晶体的微粒是_____,微粒间的相互作用是____;对于离子晶体,构成晶体的是微粒是______,微粒间的相互作______键。对于原子晶体,构成晶体的微粒是_____,微粒间的相互作用是____键。
(2)看物质的物理性质(如:熔、沸点或硬度)。
一般情况下,不同类晶体熔点高低顺序是 ___晶体>__晶体>___晶体。原子晶体、离子晶体比分子晶体的熔、沸点高得多
熔融状态的导电性。(导电:离子晶体)
(3)从组成上判断(仅限于中学范围):
有无金属离子?(有:离子晶体)
是否属于“四种原子晶体”?
以上皆否定,则多数是分子晶体。
A. YBa2CuO7-X
B. YBa2Cu2O7-X
C. YBa2Cu3O7-X
D. YBa2Cu4O7-XCu 8×(1/8) + 8×(1/4) = 3 Ba 2Y 1C分子晶体和原子晶体分子晶体知识回顾:
1.范德瓦耳斯力(分子间作用力)
(1)特征:能量小;广泛的存在分子之间(且分子间充分接触时才有相互间的作用力);本质为电性引力;只影响物质的物理性质(熔沸点)
(2)大小判断:组成和结构相似的物质,相对分子质量越大,分子间作用力也就越大(熔沸点也就越高)分子晶体知识回顾:
2.氢键
(1)本质:静电吸引作用(较强的分子间作用力) 主要存在于固体和液体中间
(2)形成条件:非金属性强;半径小;有孤对电子
(3)大小判断:非金属性的强弱
(4)表示方法:X H┄Y
(5)影响物质的其他性质:熔沸点;硬度;溶解度
注意:两个反常现象:水的沸点;冰的体积分子晶体知识回顾
3.分子晶体
(1)定义 :
(2) 构成 :
(3)3种物质结构:干冰;白磷;足球烯
(4) 性质:熔沸点低、硬度小;导电性;相似相溶原理1. 共价键、离子键和范德华力是构成物质粒子间的不同作用方式,下列物质中,只含有上述一种作用的是( )
(A)干冰 (B)氯化钠
(C)氢氧化钠 (D)碘2.最近科学家发现一种由钛原子和碳原子构成的气态团簇分子,如右图所示。顶角和面心的原于是钛原子,棱的中心和体心的原子是碳原子,则它的分子式是 ( )
A.TiC B.Ti4C4, C.Ti14C13 D.Ti13C14
3. 2003年春,北京小汤山等收治“非典”的定点医院,收到由解放军总装备部军事医学研究所研制的小分子团水,解决了医务人员工作时的如厕难题。新型小分子团“压缩”水,具有饮用量少、渗透力强、生物利用率高、在人体内储留时间长、排放量少的特点。一次饮用125mL小分子团水,可维持人体6小时正常需水量。下列关于小分子团水的说法正确的是( )
(A)水分子的化学性质发生了改变
(B)水分子中氧氢键数目增多
(C)分子团中水分子间主要以氢键结合
(D)水分子的结构、物理性质发生了改变4.1996年诺贝化学奖授予对发现C60有重大贡献的
三位科学家C60分子是形如球状的多面体(如图),
该结构的建立基于以下考虑:
①C60分子中每个碳原子只跟相邻的3个碳原子形
成化学键;
②C60分子只含有五边形和六边形;
③多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:
据上所述,可推知C60分子有12个五边形和20个六边形,C60分子所含的双键数为30。
回答下列问题:
(1)固体C60与金刚石相比较,熔点较高者应是_______,理由是__。
(2)试估计C60跟F2在一定条件下,能否发生反应生成C60F60(填“可能”或“不可能”)__________,并简述其理由:______________。
(3)通过计算,确定C60分子所含单键数。C60分子所含单键数为(4)C70分子也已制得,它的分子结构模型可以与C60同样考虑而推知.通过计算确定C70分子中五边形和六边形的数目.
(5)C70分子中所含五边形数为______,六边形数为_____。三、原子晶体1.组成:
2.定义:
3.结构:
4.熔沸点:原子 共价键 空间网状结构相邻原子间以共价键结合而成的空间
网状结构的晶体二氧化硅 金刚石键长越短,键能越大,共价键越稳定,熔沸点也就越高,反之越低练习:碳化硅SiC的一种晶体具有类似金刚石的结构,其中C原子和Si原子的位置是交替的。在下列三种晶体①金刚石 ②晶体硅 ③碳化硅中,它们的熔点从高到低的顺序是 ( )109o28′Sio二氧化硅的晶体结构示意图共价键109o28′金刚石的晶体结构示意图共价键石墨晶体——过渡型晶体或混合型晶体开拓思考题
仔细观察下边的示意图后,回答下列问题:
金刚石与石墨的熔点均很高,那么二者熔点是否相同?为什么?若不相同,哪种更高一些?1.下列的晶体中,化学键种类相同,晶体类型也相同的是( )
(A)SO2与SiO2 (B)C02与H2O
(C)NaCl与HCl (D)CCl4与KCl2.石墨晶体是层状结构,在每一层内;每一个碳原于都跟其他3个碳原子相结合,如图是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子数是( )
(A)10个 (B)18个
(C)24个 (D)14个3.下列关于只含非金属元素的化合物的说法正确的是
(A)一定是共价化合物,且只能构成分子晶体;
(B)其晶体不可能是离子晶体,因为微粒间的作用力只有分子间作用力;
(C)其晶体不可能是原子晶体,原子晶体只有非金属单质,没有化合物;
(D)可能是离子化合物。判断晶体类型的依据
(1)看构成晶体的微粒种类及微粒间的相互作用。
对分子晶体,构成晶体的微粒是_____,微粒间的相互作用是____;对于离子晶体,构成晶体的是微粒是______,微粒间的相互作______键。对于原子晶体,构成晶体的微粒是_____,微粒间的相互作用是____键。
(2)看物质的物理性质(如:熔、沸点或硬度)。
一般情况下,不同类晶体熔点高低顺序是 ___晶体>__晶体>___晶体。原子晶体、离子晶体比分子晶体的熔、沸点高得多
熔融状态的导电性。(导电:离子晶体)
(3)从组成上判断(仅限于中学范围):
有无金属离子?(有:离子晶体)
是否属于“四种原子晶体”?
以上皆否定,则多数是分子晶体。
