化学反应中的能量及能量变化[上学期]
文档属性
| 名称 | 化学反应中的能量及能量变化[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 144.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-09-26 00:00:00 | ||
图片预览











文档简介
课件33张PPT。专题三:化学反应中的能量变化 一、反应热: 化学反应过程中放出或吸收的热量。 1、放热反应和吸热反应: 有热量放出的化学反应叫放热反应。 如: 木炭、氢气、甲烷等在氧气中的燃烧反应吸收热量的化学反应叫吸热反应。 如Ba(OH)2·8H2O与NH4Cl的反应及灼热的碳与二氧化碳
的反应[练习]1、下列变化中,属于放热反应的是( )A.Ba(OH)2·8H2O与NH4Cl的反应
B.点燃的镁条在二氧化碳中继续燃烧
C.灼热的碳与二氧化碳的反应
D.氯化铝的水解B2、下列变化中,属于吸热反应的是( )
A.氨催化氧化生成NO B.酸碱中和
C.酯化反应 D.焦炭与高温水蒸气反应 3.下列变化中,属于吸热反应的是( )
①液氨气化②将胆矾加热变为白色粉末③稀释浓硫酸
④氨催化氧化生成NO⑤氯酸钾分解制O2
⑥酸碱中和生成水⑦氯化铁溶于水显酸性
A.②⑤⑦ B.①③④ C.①②⑤ D.③④⑥4.下列变化过程中会放出热量的是( )
①硝酸铵溶于水②物质的燃烧③苛性钠溶于水
④生石灰放入水中 ⑤醋酸的电离
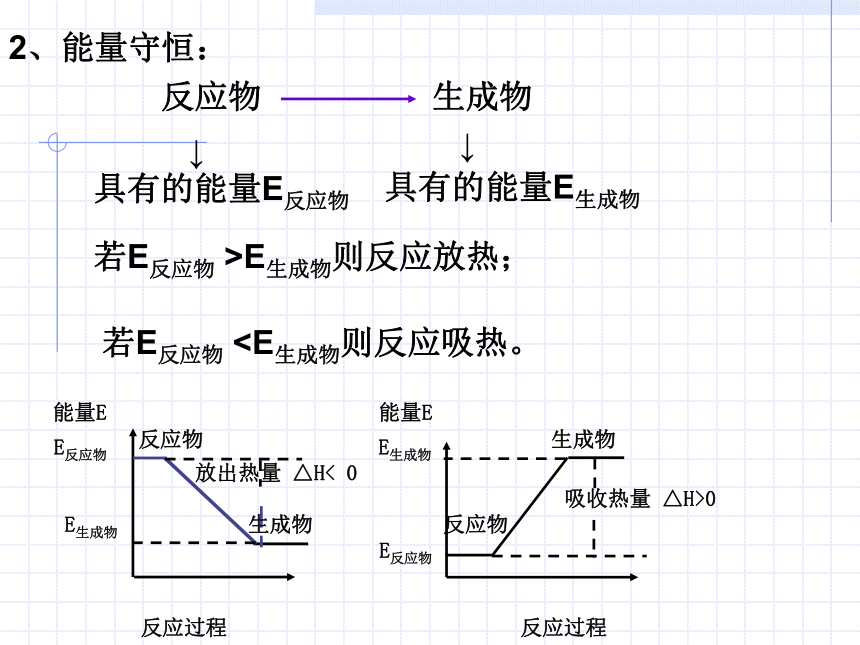
A.仅①⑤ B.仅②③ C.仅②④ D.②③④DAD2、能量守恒: 反应物 生成物 ↓ 具有的能量E反应物 具有的能量E生成物 ↓ 若E反应物 >E生成物则反应放热;若E反应物[练习] (1)下列叙述正确的是( )
A.化学反应一定伴随热量的变化
B.凡是吸热或放热过程中热量的变化均称为反应热
C.若△H<0,则反应物的能量高于生成物的能量
D.若△H>0,则反应物的能量高于生成物的能量(2)已知:H + H ═ H2;△H=-436KJ/mol,则下列
叙述正确的是( )
A.H原子的能量高于H2的能量
B.H原子的能量低于H2的能量
D. H原子比H2分子稳定
D.H2分子比H原子稳定CAD3、化学反应的本质: 反应物分子化学键的断裂和生成物分子化学键的形成。
前者需要吸热而后者要放出热量。 如:H2(g)+Cl2(g)=2HCl(g);△H=?∵Q=生成物的键能总和-反应物的键能总和
当△H为“-”或△H< 0 ,为放热反应。表示反应体系给出
能量,反应体系的能量降低。 当△H为“+”或△H>0 ,为吸热反应。表示反应体系获得
能量,反应体系的能量升高。=2mol×431KJ/mol-(1mol×436KJ/mol+1mol×243KJ/mol)=183KJ∴△H=-183KJ/mol
C(s)+ H2O (g)═ CO(g)+H2(g);△H=+131.5KJ/mol 反应热的单位一般是KJ/mol,由实验测得(一定大气压、
敞开的容器中用量热器测定)无法测定的反应热可通过
计算获得。如:
C二、热化学方程式1、概念: 表明反应所放出或吸收的热量的化学方程式。 如:H2(g)+Cl2(g)=2HCl(g);△H=-183KJ/mol 又如2gH2完全燃烧放出的热量为285.8KJ,则H2燃烧生成
液态水的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H=-571.6KJ/mol2、热化学方程式表示的意义:表示什么物质参加反应结果生成什么物质或H2(g)+ O2(g)=H2O(l);△H=-285.8KJ/mol
质→量→能
反应物和生成物之间的质量比、物质的量比反应物完全变成生成物后所放出或吸收的热量。3、热化学方程式的书写方法写出化学方程式并加以配平
[例]1、2.00gC2H2完全燃烧生成液态水和CO2放出的热量
为99.6KJ则C2H2燃烧的热化学方程式为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=-2589.6KJ/mol[例]2、写出下列反应的热化学方程式(1)1molC(固态)与适量H2O(气态) 反应,生成CO(气态)
和H2(气态),吸收131.3kJ的热量 C(s)+H2O(g)=CO(g)+H2(g); △H=+131.3KJ/mol→注明反应物和生成物的聚集状态
→右端写出热量的数值和符号。(2)0.5molCu(固态) 与适量O2(气态) 反应, 生成CuO(固态),
放出78.5 kJ的热量 注意点: 一般地说反应热是在25℃和101KPa
条件下测定的,因而可以不注明。但要注明热量的数值和
符号。 因为物质的聚集状态
不同所含的能量也不同。 固态
液态吸热气态吸热吸热2Cu(s)+O2(g)=2CuO(s); △H=-314KJ/mol1、要注明温度和压强:2、反应物和生成物要注明聚集状态:如H2(g)+ O2(g)=H2O(l);△H=-285.8KJ/mol
H2(g)+ O2(g)=H2O(g);△H=-241.8KJ/mol ∴H2O(l)═H2O(g);△H=+44KJ/mol 3、热化学方程式中各物质前的化学计量数表示物质的量
不表示分子数,因而必要时可用分数。热化学方程式中的
化学计量数不同则反应热也不同。 H2(g)+Cl2(g)=2HCl(g);△H=-184.6KJ/mol H2(g)+ Cl2(g)=HCl(g);△H=-92.3KJ/mol [练习]1、将12.7克固态碘与氢气完全反应生成碘化氢
气体时,必须吸收2.604千焦的热量,其热化学方程式为 I2(s)+H2(g)=2HI(g); △H=+52.08KJ/mol2、铝在纯氧中燃烧,每生成1gAl2O3(固)放出QkJ热量,
写出其热化学方程式 3、已知在1×105Pa,298K条件下,2mol氢气燃烧生成
水蒸气放出484kJ热量,下列热化学方程式正确的是( )A. H2O(g)=H2(g)+1/2O2(g);ΔH=+242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l);ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g);ΔH=+242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g);ΔH=+484kJ·mol-1 4Al(s)+3O2(g)=2Al2O3(s) ;ΔH=-204QkJ·mol-1A4、0.3摩的高能燃料乙硼烷(B2H6)在氧气中燃烧,
生成固体B2O3和液态水,放出649.5千焦的热量,又知:
H2O(液)=H2O(气) ;△H=+44KJ/mol,下列热化学方程
式中,正确的是( )
A.B2H6(g)+3O2(g)=B2O3(s)+3H2O(g);△H=-2165KJ/mol
B. B2H6(g)+3O2(g)=B2O3(s)+3H2O(g);△H=-2033KJ/mol
C. B2H6(g)+3O2(g)=B2O3(s)+3H2O(l);△H=-2165KJ/mol
D. B2H6(g)+3O2(g)=B2O3(s)+3H2O(l);△H=-2033KJ/molBC5、在同温同压下,下列各组热化学方程式中,
Q2>Q1的是( )
A.2H2(g)+O2(g)=2H2O(g);△H=-Q1 KJ/mol
2H2(g)+O2(g)=2H2O(l);△H=-Q2KJ/mol
B.S(g)+O2(g)=SO2(g);△H=-Q1 KJ/mol
S(s)+O2(g)=SO2(g);△H=-Q2KJ/mol
C.C(s)+1/2O2(g)=CO(g);△H=-Q1 KJ/mol
C(s)+O2(g)=CO2(g);△H=-Q2KJ/mol
D.H2(g)+Cl2(g)=2HCl(g);△H=-Q1 KJ/mol
1/2H2(g)+1/2Cl2(g)=HCl(g);△H=-Q2KJ/molAC6、已知白磷和红磷分别在氧气中燃烧的热化学方程式为:
P4(固,白磷)+5O2(气)=P4O10(固);△H=-2983.2KJ/mol
P(固,红磷)+5/4O2(气)=1/4P4O10(固);△H=-738.5KJ/mol
则:P4(固,白磷)=4P(固,红磷) 反应的ΔH=___________________,
红磷比白磷 (填稳定或不稳定),
理由是 。4、关于热化学方程式的简单计算[例题]汽油的主要成分是辛烷(C8H18), 1mol C8H18(液态)
在O2(气态)中燃烧,生成CO2(气态) 和H2O(液态),放出
5518 kJ的热量,试写出该反应的热化学方程式并计算
在同样情况下燃烧28.5g辛烷时放出的热量。-29.2 KJ/mol稳定白磷转化为红磷要放热,说明红磷的能量比白磷低
,所以红磷比白磷稳定.C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l); ΔH=-5518 kJ/mol放出的热量=5518KJ÷114×28.5=1379.5KJ [练习] 1、在一定条件下,CO和CH4燃烧的热化学方程式
分别为:
2CO(g)+O2(g)=2CO2(g);△H=-566KJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890KJ/mol
由1摩CO和3摩CH4组成的混和气在上述条件下完全燃烧
时,释放的热量为( )
A.2912KJ B.2953KJ C.3236KJ D.3867KJ2、一定质量的无水乙醇完全燃烧时放出的热量为QKJ.
它所生成的CO2用过量饱和石灰水完全吸收可得100g
碳酸钙沉淀,则完全燃烧1mol无水乙醇放出的热量是
( )A.0.5QKJ B.QKJ C.2QKJ D.5QKJBC3、已知:2H2(g)+O2(g)=2H2O(l);△H=-571.6KJ/mol
CO(g)+1/2O2(g)=CO2(g);△H=-282.9KJ/mol
若有一定量H2和CO的混合气体,完全燃烧后共生成
3.6克液态水,并放出了113.74KJ的热量,则原混合气体
中CO的物质的量为( )
A、0.2mol B、0.15mol C、0.1mol D、0.05mol AD三、燃烧热1、燃料的充分燃烧(1)燃料的充分燃烧的条件:(2)化石燃料包括:a、要有足够的空气b、燃料与空气要有足够大的接触面。如:煤的液化、汽油的雾化。
煤、石油和天然气。
煤→焦炭→水煤气,减少污染,提高热效率。 (3)化石燃料燃烧对环境的影响:煤燃烧产生SO2和烟尘污染环境,煤、石油燃烧产生SO2,SO2会导致酸雨的形成。化石燃料燃烧产生CO2CO2会导致“温室效应”。改变能源结构,开发新能源,少用煤和石油如充分利用地热、太阳能、大力开发水电和核电。[练习]1、在相同的条件下,对环境污染程度最小的燃料是
( )
A.液化气 B.煤油 C.煤饼 D.木柴2、根据以下叙述,回答第(1)—(3)题AAC能源可划分为一级能源和二级能源.自然界中以现成形式
提供的能源称为一级能源;需依靠其它能源的能量间接制
取的能源称为二级能源.氢气是一种高效而没有污染的二
级能源,它可以由自然界中大量存在的水来制取:
2H2O(l)=2H2(g)+O2(g);△H =517.6 KJ/mol
(1)下列叙述正确的是( )
A.电能是二级能源 B.水力是二级能源
C.天然气是一级能源 D.焦炉气是一级能源( 2).已知:CH4(g)+2O2(g)=2H2O(l)+CO2(g),△H=-890.3KJ/mol,1克氢气和1克甲烷分别燃烧后,放出的热量之比约是 ( )
A.1:3.4 B.1:1.7 C.2.3:1 D.4.6:1(3)关于用水制取二级能源氢气,以下研究方向不正确的是( )
A.构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二级能源
B.设法将太阳光聚集,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气CAC2、燃烧热:101KPa时,1mol物质完全燃烧生成稳定的
氧化物时所放出的热量叫该物质的燃烧热。 C→CO2(g),H→H2O(l),S→SO2(g),N→N2 (g)C2H2的燃烧热为1300KJ/mol,C的燃烧热为393.5KJ/mol
而不是110.5KJ/mol 。2H2(g)+O2(g)=2H2O(l);△H=-571.6KJ/mol[练习]1、已知:2H2(g)+O2(g)=2H2O(l),△H=-571.6KJ/mol
2H2(g)+O2(g)=2H2O(g),△H=-483.6KJ/mol
则氢气的燃烧热为( )
A.571.6KJ/mol B.483.6KJ/mol
C.285.8KJ/mol D.241.8KJ/mol CH2的燃烧热为285.8KJ/mol而不是241.8KJ/mol。2、1gCH4在标准状况下燃烧生成液态水和二氧化碳时,
放出55.6KJ热量,则CH4燃烧的热化学方程式是
,
CH4的燃烧热为 。3.已知:C的燃烧热为393.5KJ/mol,CO的燃烧热
为283.0KJ/mol,则C燃烧生成CO的热化学方程式是
。 四、中和热:在稀溶液中,酸与碱发生中和反应生成
1molH2O所放出的热量叫中和热。若是强酸强碱其中和热均为57.3KJ/mol。这是因为强酸
与强碱发生中和反应的实质是:H+ +OH― ═H2O CH4(g)+2O2(g)=2H2O(l)+CO2(g);△H=-889.6KJ/mol889.6KJ/molC(s)+1/2 O2(g)=CO(g);△H=-110.5 KJ/mol1mol/LHNO3 与1mol/LNaOH 发生中和反应生成1molH2O
放出的热量为57.3KJ。 一定要“稀溶液” 这是因为浓溶液中离子之间存在较强的
牵制作用。练习:
1、下列各对酸与碱的中和热大于 57.3KJ/mol的是 ,
小于 57.3KJ/mol的是 ,等于 57.3KJ/mol的是 。
(填序号)
A.盐酸与氢氧化钾 B.氨水与盐酸
C. 醋酸与氢氧化钠 D.硫酸与氢氧化钡 2、下列各对酸与碱的中和热大于 57.3KJ/mol的是( )
A.盐酸与氢氧化钾 B.氨水与盐酸
C. 醋酸与氢氧化钠 D.硫酸与氢氧化钡DBCAD
燃 烧 热 和 中 和 热 燃烧热
1、定义:在101KPa时,1mol物质完全燃烧生成稳定的氧化物时所放出的能量,叫做该物质的燃烧热。
单位:KJ/mol
注意:①反应程度:完全燃烧,例如:C→CO不是完全燃烧;S→SO2不是燃烧产物。
②产物是稳定的氧化物:例如生成的水为液态,不是气态。
③研究条件: 101KPa
④研究内容:放出的热量(△H<0,单位KJ/mol)
⑤不同反应物的燃烧热不同
2、表示的意义:例如C的燃烧热为393.5KJ/mol,在101KPa时,1molC完全燃烧放出393.5KJ的热量。3、热化学方程式的书写:可燃物必须是1mol4、有关燃烧热的计算:Q(放)=n× △H,其中n为可燃物的物质的量, △H为可燃物的燃烧热。中和热
1、定义:在稀溶液中,酸跟碱发生中和反应而生成1molH2O,这时的反应热叫做中和热。
H+(aq)+OH-(aq)=H2O(l) △H= -57.3KJ/mol
NaOH(aq) +HCl(aq) =NaCl (aq)+H2O (l) △H= -57.3KJ/mol
KOH(aq)+HNO3(aq)=KNO3(aq)+ H2O(l) △H= -57.3KJ/mol
2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2 H2O(l)
△H= -114.6KJ/mol
2、强调:
①稀溶液是指溶于大量水的离子
②中和热不包括离子在水溶液中的生成热、物质的溶解热、电解质电离所伴随的热效应。
③中和反应的实质是H+与OH-化合生成H2O,若反应过程中有其他物质生成,这部分反应热也不在中和热内。
④强酸与强碱间的中和反应的中和热相同.(57.3KJ/mol)
⑤不同反应物的中和热大致相同,都约是57.3KJ/mol使用气体燃料比使用煤、煤球等固体燃料的好处首先,气体燃料便于管道运输、使用方便(易点燃、易熄灭)、无渣无尘、清洁卫生;
其次,因气体易扩散,故气体燃料与空气混合充分,容易发生完全燃烧,与固体燃料相比有较高的能量利用率;
第三,固体煤中含有硫、氮等杂质,直接燃煤,会产生大量二氧化硫、氮氧化物、粉尘,造成大气污染,住宅环境、居室空气的污染则更严重。一、原理:
Q=mc△t
Q= (V酸d酸+V碱d碱)c(t2-t1)
其中c=4.18J/(g. ℃)
Q=0.418(t2-t1)KJ
△H=0.418(t2-t1)0.025KJ/mol中 和 热 的 测 定
二、实验注意事项:1、大、小烧杯放置时,要使两杯口相平:可使盖板把杯口尽量盖严,从而减少热量损失;
2、填碎纸条的作用:为了达到保温、隔热、减少实验过程中热量损失的目的 3、若换用隔热、密封性能更好的装置(如保温杯)会使实验结果更准确。4、温度计上的酸要用水冲洗干净:温度计还要用来测碱液的温度,若不冲洗,温度计上的酸会和碱发生中和反应而使热量散失
5、冲洗后的溶液不要倒入小烧杯:若倒入,会使总溶液的质量增加,而导致实验结果误差。
6、酸、碱混合时,要把量筒中的氢氧化钠溶液一次倒入小烧杯而不能缓缓倒入:因为本实验的关键是测反应的反应热,若动作迟缓,将会使热量损失而产生误差。
7、实验中所用盐酸和氢氧化钠的物质的量比不是1:1而是氢氧化钠过量:为了保证0.5mol/L的盐酸完全被氢氧化钠中和,采用0.55mol/L氢氧化钠溶液,使碱稍稍过量。若使盐酸过量也可以。
的反应[练习]1、下列变化中,属于放热反应的是( )A.Ba(OH)2·8H2O与NH4Cl的反应
B.点燃的镁条在二氧化碳中继续燃烧
C.灼热的碳与二氧化碳的反应
D.氯化铝的水解B2、下列变化中,属于吸热反应的是( )
A.氨催化氧化生成NO B.酸碱中和
C.酯化反应 D.焦炭与高温水蒸气反应 3.下列变化中,属于吸热反应的是( )
①液氨气化②将胆矾加热变为白色粉末③稀释浓硫酸
④氨催化氧化生成NO⑤氯酸钾分解制O2
⑥酸碱中和生成水⑦氯化铁溶于水显酸性
A.②⑤⑦ B.①③④ C.①②⑤ D.③④⑥4.下列变化过程中会放出热量的是( )
①硝酸铵溶于水②物质的燃烧③苛性钠溶于水
④生石灰放入水中 ⑤醋酸的电离
A.仅①⑤ B.仅②③ C.仅②④ D.②③④DAD2、能量守恒: 反应物 生成物 ↓ 具有的能量E反应物 具有的能量E生成物 ↓ 若E反应物 >E生成物则反应放热;若E反应物
A.化学反应一定伴随热量的变化
B.凡是吸热或放热过程中热量的变化均称为反应热
C.若△H<0,则反应物的能量高于生成物的能量
D.若△H>0,则反应物的能量高于生成物的能量(2)已知:H + H ═ H2;△H=-436KJ/mol,则下列
叙述正确的是( )
A.H原子的能量高于H2的能量
B.H原子的能量低于H2的能量
D. H原子比H2分子稳定
D.H2分子比H原子稳定CAD3、化学反应的本质: 反应物分子化学键的断裂和生成物分子化学键的形成。
前者需要吸热而后者要放出热量。 如:H2(g)+Cl2(g)=2HCl(g);△H=?∵Q=生成物的键能总和-反应物的键能总和
当△H为“-”或△H< 0 ,为放热反应。表示反应体系给出
能量,反应体系的能量降低。 当△H为“+”或△H>0 ,为吸热反应。表示反应体系获得
能量,反应体系的能量升高。=2mol×431KJ/mol-(1mol×436KJ/mol+1mol×243KJ/mol)=183KJ∴△H=-183KJ/mol
C(s)+ H2O (g)═ CO(g)+H2(g);△H=+131.5KJ/mol 反应热的单位一般是KJ/mol,由实验测得(一定大气压、
敞开的容器中用量热器测定)无法测定的反应热可通过
计算获得。如:
C二、热化学方程式1、概念: 表明反应所放出或吸收的热量的化学方程式。 如:H2(g)+Cl2(g)=2HCl(g);△H=-183KJ/mol 又如2gH2完全燃烧放出的热量为285.8KJ,则H2燃烧生成
液态水的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H=-571.6KJ/mol2、热化学方程式表示的意义:表示什么物质参加反应结果生成什么物质或H2(g)+ O2(g)=H2O(l);△H=-285.8KJ/mol
质→量→能
反应物和生成物之间的质量比、物质的量比反应物完全变成生成物后所放出或吸收的热量。3、热化学方程式的书写方法写出化学方程式并加以配平
[例]1、2.00gC2H2完全燃烧生成液态水和CO2放出的热量
为99.6KJ则C2H2燃烧的热化学方程式为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);△H=-2589.6KJ/mol[例]2、写出下列反应的热化学方程式(1)1molC(固态)与适量H2O(气态) 反应,生成CO(气态)
和H2(气态),吸收131.3kJ的热量 C(s)+H2O(g)=CO(g)+H2(g); △H=+131.3KJ/mol→注明反应物和生成物的聚集状态
→右端写出热量的数值和符号。(2)0.5molCu(固态) 与适量O2(气态) 反应, 生成CuO(固态),
放出78.5 kJ的热量 注意点: 一般地说反应热是在25℃和101KPa
条件下测定的,因而可以不注明。但要注明热量的数值和
符号。 因为物质的聚集状态
不同所含的能量也不同。 固态
液态吸热气态吸热吸热2Cu(s)+O2(g)=2CuO(s); △H=-314KJ/mol1、要注明温度和压强:2、反应物和生成物要注明聚集状态:如H2(g)+ O2(g)=H2O(l);△H=-285.8KJ/mol
H2(g)+ O2(g)=H2O(g);△H=-241.8KJ/mol ∴H2O(l)═H2O(g);△H=+44KJ/mol 3、热化学方程式中各物质前的化学计量数表示物质的量
不表示分子数,因而必要时可用分数。热化学方程式中的
化学计量数不同则反应热也不同。 H2(g)+Cl2(g)=2HCl(g);△H=-184.6KJ/mol H2(g)+ Cl2(g)=HCl(g);△H=-92.3KJ/mol [练习]1、将12.7克固态碘与氢气完全反应生成碘化氢
气体时,必须吸收2.604千焦的热量,其热化学方程式为 I2(s)+H2(g)=2HI(g); △H=+52.08KJ/mol2、铝在纯氧中燃烧,每生成1gAl2O3(固)放出QkJ热量,
写出其热化学方程式 3、已知在1×105Pa,298K条件下,2mol氢气燃烧生成
水蒸气放出484kJ热量,下列热化学方程式正确的是( )A. H2O(g)=H2(g)+1/2O2(g);ΔH=+242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l);ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g);ΔH=+242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g);ΔH=+484kJ·mol-1 4Al(s)+3O2(g)=2Al2O3(s) ;ΔH=-204QkJ·mol-1A4、0.3摩的高能燃料乙硼烷(B2H6)在氧气中燃烧,
生成固体B2O3和液态水,放出649.5千焦的热量,又知:
H2O(液)=H2O(气) ;△H=+44KJ/mol,下列热化学方程
式中,正确的是( )
A.B2H6(g)+3O2(g)=B2O3(s)+3H2O(g);△H=-2165KJ/mol
B. B2H6(g)+3O2(g)=B2O3(s)+3H2O(g);△H=-2033KJ/mol
C. B2H6(g)+3O2(g)=B2O3(s)+3H2O(l);△H=-2165KJ/mol
D. B2H6(g)+3O2(g)=B2O3(s)+3H2O(l);△H=-2033KJ/molBC5、在同温同压下,下列各组热化学方程式中,
Q2>Q1的是( )
A.2H2(g)+O2(g)=2H2O(g);△H=-Q1 KJ/mol
2H2(g)+O2(g)=2H2O(l);△H=-Q2KJ/mol
B.S(g)+O2(g)=SO2(g);△H=-Q1 KJ/mol
S(s)+O2(g)=SO2(g);△H=-Q2KJ/mol
C.C(s)+1/2O2(g)=CO(g);△H=-Q1 KJ/mol
C(s)+O2(g)=CO2(g);△H=-Q2KJ/mol
D.H2(g)+Cl2(g)=2HCl(g);△H=-Q1 KJ/mol
1/2H2(g)+1/2Cl2(g)=HCl(g);△H=-Q2KJ/molAC6、已知白磷和红磷分别在氧气中燃烧的热化学方程式为:
P4(固,白磷)+5O2(气)=P4O10(固);△H=-2983.2KJ/mol
P(固,红磷)+5/4O2(气)=1/4P4O10(固);△H=-738.5KJ/mol
则:P4(固,白磷)=4P(固,红磷) 反应的ΔH=___________________,
红磷比白磷 (填稳定或不稳定),
理由是 。4、关于热化学方程式的简单计算[例题]汽油的主要成分是辛烷(C8H18), 1mol C8H18(液态)
在O2(气态)中燃烧,生成CO2(气态) 和H2O(液态),放出
5518 kJ的热量,试写出该反应的热化学方程式并计算
在同样情况下燃烧28.5g辛烷时放出的热量。-29.2 KJ/mol稳定白磷转化为红磷要放热,说明红磷的能量比白磷低
,所以红磷比白磷稳定.C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l); ΔH=-5518 kJ/mol放出的热量=5518KJ÷114×28.5=1379.5KJ [练习] 1、在一定条件下,CO和CH4燃烧的热化学方程式
分别为:
2CO(g)+O2(g)=2CO2(g);△H=-566KJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890KJ/mol
由1摩CO和3摩CH4组成的混和气在上述条件下完全燃烧
时,释放的热量为( )
A.2912KJ B.2953KJ C.3236KJ D.3867KJ2、一定质量的无水乙醇完全燃烧时放出的热量为QKJ.
它所生成的CO2用过量饱和石灰水完全吸收可得100g
碳酸钙沉淀,则完全燃烧1mol无水乙醇放出的热量是
( )A.0.5QKJ B.QKJ C.2QKJ D.5QKJBC3、已知:2H2(g)+O2(g)=2H2O(l);△H=-571.6KJ/mol
CO(g)+1/2O2(g)=CO2(g);△H=-282.9KJ/mol
若有一定量H2和CO的混合气体,完全燃烧后共生成
3.6克液态水,并放出了113.74KJ的热量,则原混合气体
中CO的物质的量为( )
A、0.2mol B、0.15mol C、0.1mol D、0.05mol AD三、燃烧热1、燃料的充分燃烧(1)燃料的充分燃烧的条件:(2)化石燃料包括:a、要有足够的空气b、燃料与空气要有足够大的接触面。如:煤的液化、汽油的雾化。
煤、石油和天然气。
煤→焦炭→水煤气,减少污染,提高热效率。 (3)化石燃料燃烧对环境的影响:煤燃烧产生SO2和烟尘污染环境,煤、石油燃烧产生SO2,SO2会导致酸雨的形成。化石燃料燃烧产生CO2CO2会导致“温室效应”。改变能源结构,开发新能源,少用煤和石油如充分利用地热、太阳能、大力开发水电和核电。[练习]1、在相同的条件下,对环境污染程度最小的燃料是
( )
A.液化气 B.煤油 C.煤饼 D.木柴2、根据以下叙述,回答第(1)—(3)题AAC能源可划分为一级能源和二级能源.自然界中以现成形式
提供的能源称为一级能源;需依靠其它能源的能量间接制
取的能源称为二级能源.氢气是一种高效而没有污染的二
级能源,它可以由自然界中大量存在的水来制取:
2H2O(l)=2H2(g)+O2(g);△H =517.6 KJ/mol
(1)下列叙述正确的是( )
A.电能是二级能源 B.水力是二级能源
C.天然气是一级能源 D.焦炉气是一级能源( 2).已知:CH4(g)+2O2(g)=2H2O(l)+CO2(g),△H=-890.3KJ/mol,1克氢气和1克甲烷分别燃烧后,放出的热量之比约是 ( )
A.1:3.4 B.1:1.7 C.2.3:1 D.4.6:1(3)关于用水制取二级能源氢气,以下研究方向不正确的是( )
A.构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二级能源
B.设法将太阳光聚集,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气CAC2、燃烧热:101KPa时,1mol物质完全燃烧生成稳定的
氧化物时所放出的热量叫该物质的燃烧热。 C→CO2(g),H→H2O(l),S→SO2(g),N→N2 (g)C2H2的燃烧热为1300KJ/mol,C的燃烧热为393.5KJ/mol
而不是110.5KJ/mol 。2H2(g)+O2(g)=2H2O(l);△H=-571.6KJ/mol[练习]1、已知:2H2(g)+O2(g)=2H2O(l),△H=-571.6KJ/mol
2H2(g)+O2(g)=2H2O(g),△H=-483.6KJ/mol
则氢气的燃烧热为( )
A.571.6KJ/mol B.483.6KJ/mol
C.285.8KJ/mol D.241.8KJ/mol CH2的燃烧热为285.8KJ/mol而不是241.8KJ/mol。2、1gCH4在标准状况下燃烧生成液态水和二氧化碳时,
放出55.6KJ热量,则CH4燃烧的热化学方程式是
,
CH4的燃烧热为 。3.已知:C的燃烧热为393.5KJ/mol,CO的燃烧热
为283.0KJ/mol,则C燃烧生成CO的热化学方程式是
。 四、中和热:在稀溶液中,酸与碱发生中和反应生成
1molH2O所放出的热量叫中和热。若是强酸强碱其中和热均为57.3KJ/mol。这是因为强酸
与强碱发生中和反应的实质是:H+ +OH― ═H2O CH4(g)+2O2(g)=2H2O(l)+CO2(g);△H=-889.6KJ/mol889.6KJ/molC(s)+1/2 O2(g)=CO(g);△H=-110.5 KJ/mol1mol/LHNO3 与1mol/LNaOH 发生中和反应生成1molH2O
放出的热量为57.3KJ。 一定要“稀溶液” 这是因为浓溶液中离子之间存在较强的
牵制作用。练习:
1、下列各对酸与碱的中和热大于 57.3KJ/mol的是 ,
小于 57.3KJ/mol的是 ,等于 57.3KJ/mol的是 。
(填序号)
A.盐酸与氢氧化钾 B.氨水与盐酸
C. 醋酸与氢氧化钠 D.硫酸与氢氧化钡 2、下列各对酸与碱的中和热大于 57.3KJ/mol的是( )
A.盐酸与氢氧化钾 B.氨水与盐酸
C. 醋酸与氢氧化钠 D.硫酸与氢氧化钡DBCAD
燃 烧 热 和 中 和 热 燃烧热
1、定义:在101KPa时,1mol物质完全燃烧生成稳定的氧化物时所放出的能量,叫做该物质的燃烧热。
单位:KJ/mol
注意:①反应程度:完全燃烧,例如:C→CO不是完全燃烧;S→SO2不是燃烧产物。
②产物是稳定的氧化物:例如生成的水为液态,不是气态。
③研究条件: 101KPa
④研究内容:放出的热量(△H<0,单位KJ/mol)
⑤不同反应物的燃烧热不同
2、表示的意义:例如C的燃烧热为393.5KJ/mol,在101KPa时,1molC完全燃烧放出393.5KJ的热量。3、热化学方程式的书写:可燃物必须是1mol4、有关燃烧热的计算:Q(放)=n× △H,其中n为可燃物的物质的量, △H为可燃物的燃烧热。中和热
1、定义:在稀溶液中,酸跟碱发生中和反应而生成1molH2O,这时的反应热叫做中和热。
H+(aq)+OH-(aq)=H2O(l) △H= -57.3KJ/mol
NaOH(aq) +HCl(aq) =NaCl (aq)+H2O (l) △H= -57.3KJ/mol
KOH(aq)+HNO3(aq)=KNO3(aq)+ H2O(l) △H= -57.3KJ/mol
2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2 H2O(l)
△H= -114.6KJ/mol
2、强调:
①稀溶液是指溶于大量水的离子
②中和热不包括离子在水溶液中的生成热、物质的溶解热、电解质电离所伴随的热效应。
③中和反应的实质是H+与OH-化合生成H2O,若反应过程中有其他物质生成,这部分反应热也不在中和热内。
④强酸与强碱间的中和反应的中和热相同.(57.3KJ/mol)
⑤不同反应物的中和热大致相同,都约是57.3KJ/mol使用气体燃料比使用煤、煤球等固体燃料的好处首先,气体燃料便于管道运输、使用方便(易点燃、易熄灭)、无渣无尘、清洁卫生;
其次,因气体易扩散,故气体燃料与空气混合充分,容易发生完全燃烧,与固体燃料相比有较高的能量利用率;
第三,固体煤中含有硫、氮等杂质,直接燃煤,会产生大量二氧化硫、氮氧化物、粉尘,造成大气污染,住宅环境、居室空气的污染则更严重。一、原理:
Q=mc△t
Q= (V酸d酸+V碱d碱)c(t2-t1)
其中c=4.18J/(g. ℃)
Q=0.418(t2-t1)KJ
△H=0.418(t2-t1)0.025KJ/mol中 和 热 的 测 定
二、实验注意事项:1、大、小烧杯放置时,要使两杯口相平:可使盖板把杯口尽量盖严,从而减少热量损失;
2、填碎纸条的作用:为了达到保温、隔热、减少实验过程中热量损失的目的 3、若换用隔热、密封性能更好的装置(如保温杯)会使实验结果更准确。4、温度计上的酸要用水冲洗干净:温度计还要用来测碱液的温度,若不冲洗,温度计上的酸会和碱发生中和反应而使热量散失
5、冲洗后的溶液不要倒入小烧杯:若倒入,会使总溶液的质量增加,而导致实验结果误差。
6、酸、碱混合时,要把量筒中的氢氧化钠溶液一次倒入小烧杯而不能缓缓倒入:因为本实验的关键是测反应的反应热,若动作迟缓,将会使热量损失而产生误差。
7、实验中所用盐酸和氢氧化钠的物质的量比不是1:1而是氢氧化钠过量:为了保证0.5mol/L的盐酸完全被氢氧化钠中和,采用0.55mol/L氢氧化钠溶液,使碱稍稍过量。若使盐酸过量也可以。
