电化学复习[下学期]
图片预览




文档简介
课件16张PPT。电化学专题—— 关于原电池和电解池的综合应用思考:
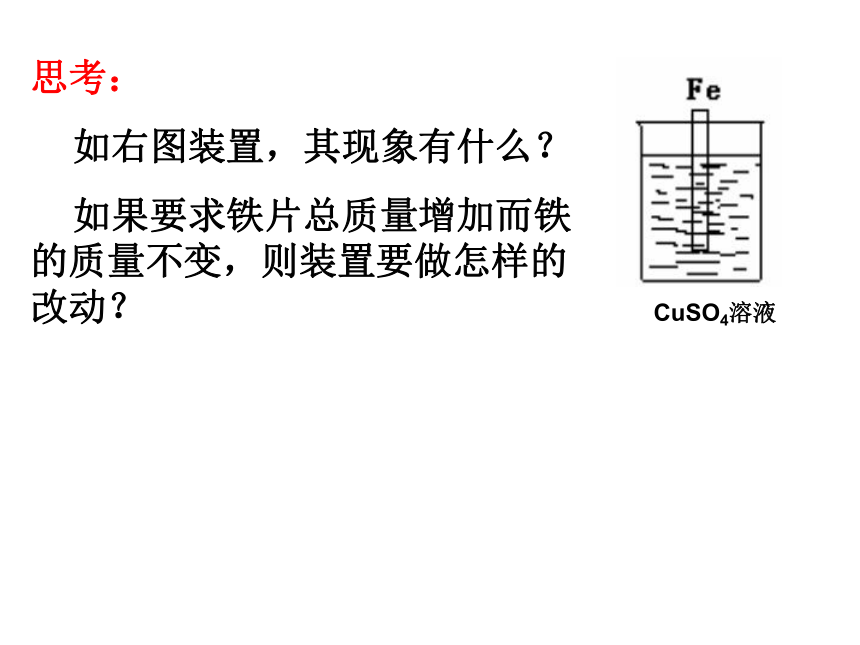
如右图装置,其现象有什么?
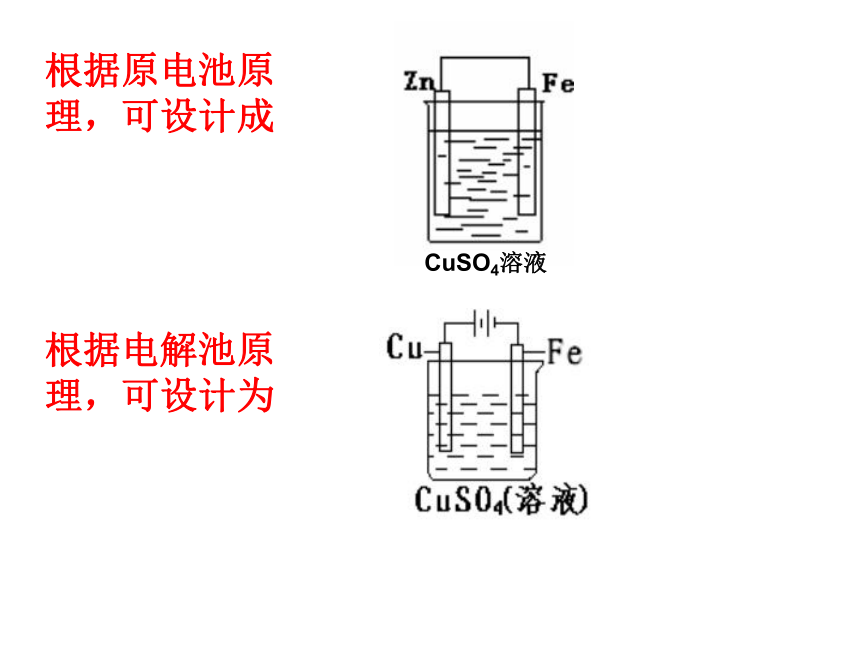
如果要求铁片总质量增加而铁 的质量不变,则装置要做怎样的改动?CuSO4溶液根据原电池原理,可设计成根据电解池原理,可设计为CuSO4溶液原电池和电解池的本质区别:
(1)原电池一般是自发的氧化还原反应。任何一个自发的氧化还原反应都可以设计成原电池。
(2)电解池是在外电源的作用下被动的发生氧化还原反应,是非自发的。 1 . 若反应为: ,该反应可以设计成原电池?
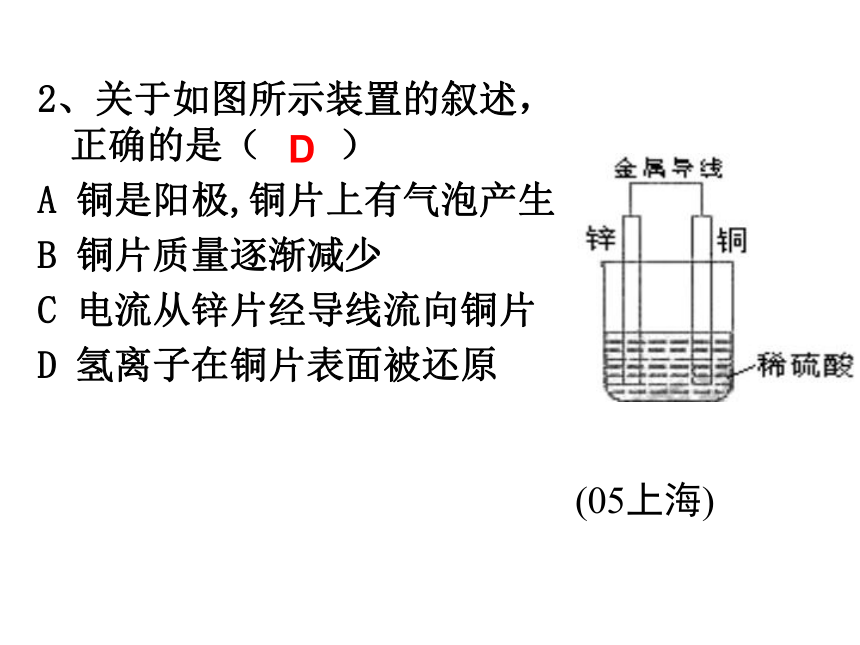
请说明理由 :__________________________问题透析能否设计一个实验使上述反应发生?2、关于如图所示装置的叙述,正确的是( )
A 铜是阳极,铜片上有气泡产生
B 铜片质量逐渐减少
C 电流从锌片经导线流向铜片
D 氢离子在铜片表面被还原(05上海)D3、一种新燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该电池说法正确的是 ( )
A、在熔融电解质中,O2-由负极移向正极
B、电池的总反应是:
2C4H10 + 13O2 → 8CO2 + 10H2O
C、通入空气的一极是正极,电极反应为:
O2 + 4e- = 2O2-
D、通入丁烷的一极是正极,电极反应为:
C4H10 + 26e- + 13O2 → 4CO2 + 5H2O(05广东)BC考查的知识点:
(1)两极的判断(正负极或者阴阳两极)
(2)两极上的电极反应(特别是新的电源)
(3)电极上产物的计算
(4)电解液的成分,PH值的变化1.右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的( )A 练 习2.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电流总反应式为:
Zn?s?+2MnO2?s?+H2O?l?=Zn?OH?2?s?+Mn2O3?s?
下列说法错误的是 ( )
A? 电池工作时,锌失去电子
B? 电池正极的电极反应式为:
2MnO2?s?+H2O?l?+2e?=Mn2O3?s?+2OH??aq?
C? 电池工作时,电子由正极通过外电路流向负极
D? 外电路中每通过0?2 mol电子,锌的质量理论上 减小6?5 g C?04江苏化学?3.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为
下列叙述不正确的是 ( )
A 放电时负极反应为:Zn--2e- +2OH- = Zn(OH)2
B 充电时阳极反应为:
Fe(OH)3 -3e- + 5 OH- = FeO42- + 4H2O
C 放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强(05江苏)CA、P是电源的正极
B、F极上发生的反应为:4OH- - 4e-=2H2O+O2↑
C、电解时,甲、乙、丙三池中,除E、F两极外,其余电极 均参加了反应
D、通电后,甲池的PH减小,而乙、丙两池溶液的PH不变
?
B 4.如上图所示,通电后A极上析出Ag,对该装置的有关叙述正确的是? ( )5.为下图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法正确的是 ( )
A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的PH值逐渐减小
D.CuSO4溶液的PH值不变AC 6.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6+7O2+8KOH==4K2CO3+10H2O,有关此电池的推断正确的是 ( )
A.负极反应为14H2O+7O2+28e-==28OH-
B.放电一段时间后,负极周围的pH减低
C.每消耗1molC2H6,则电路上转移的电子为14mol
D.放电过程中KOH的物质的量浓度不变
BC7 右图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。回答:
(1)直流电源中,M为 极。
(2)Pt电极上生成的物质是 ,
其质量为 g。
(3)电源输出的电子,其物质的量
与电极 b、c、d分别生成的物质的物质的量之比为: ________________
(4)AgNO3溶液的浓度(填增大、减小或不变。下同) ,AgNO3溶液的pH ,H2SO4溶液的浓度_____H2SO4溶液的pH______
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为 g。 正Ag2.164 : 4 : 1 : 2不变不变增大减小45.188 如图所示,按要求回答问题
打开电键K2,闭合电键K1,通电5分钟
后,Fe电极质量增加2.16g ,试回答:
①电源a为_______极
②写出右烧杯中电解总反应方程式
____________________________________
③若AgNO3溶液体积为200mL,且电解过程中
溶液体积不变,则电解后溶液pH为 _____
若打开电键K1, 闭合电键K2,试回答:
①整个装置是否有电流产生?________
左为______池 右为______池
②湿润的淀粉碘化钾试纸有什么变化?_________________
③当电路中转移0.02mol电子,左边共收集 224mL 气体(标况),溶液体积为 200mL,(电解前后无体积变化),则通电前CuSO4溶液的物质的量浓度为_______________.负1有电解原电d端试纸变蓝0.025mol/L
如右图装置,其现象有什么?
如果要求铁片总质量增加而铁 的质量不变,则装置要做怎样的改动?CuSO4溶液根据原电池原理,可设计成根据电解池原理,可设计为CuSO4溶液原电池和电解池的本质区别:
(1)原电池一般是自发的氧化还原反应。任何一个自发的氧化还原反应都可以设计成原电池。
(2)电解池是在外电源的作用下被动的发生氧化还原反应,是非自发的。 1 . 若反应为: ,该反应可以设计成原电池?
请说明理由 :__________________________问题透析能否设计一个实验使上述反应发生?2、关于如图所示装置的叙述,正确的是( )
A 铜是阳极,铜片上有气泡产生
B 铜片质量逐渐减少
C 电流从锌片经导线流向铜片
D 氢离子在铜片表面被还原(05上海)D3、一种新燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该电池说法正确的是 ( )
A、在熔融电解质中,O2-由负极移向正极
B、电池的总反应是:
2C4H10 + 13O2 → 8CO2 + 10H2O
C、通入空气的一极是正极,电极反应为:
O2 + 4e- = 2O2-
D、通入丁烷的一极是正极,电极反应为:
C4H10 + 26e- + 13O2 → 4CO2 + 5H2O(05广东)BC考查的知识点:
(1)两极的判断(正负极或者阴阳两极)
(2)两极上的电极反应(特别是新的电源)
(3)电极上产物的计算
(4)电解液的成分,PH值的变化1.右图中x、y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的( )A 练 习2.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电流总反应式为:
Zn?s?+2MnO2?s?+H2O?l?=Zn?OH?2?s?+Mn2O3?s?
下列说法错误的是 ( )
A? 电池工作时,锌失去电子
B? 电池正极的电极反应式为:
2MnO2?s?+H2O?l?+2e?=Mn2O3?s?+2OH??aq?
C? 电池工作时,电子由正极通过外电路流向负极
D? 外电路中每通过0?2 mol电子,锌的质量理论上 减小6?5 g C?04江苏化学?3.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为
下列叙述不正确的是 ( )
A 放电时负极反应为:Zn--2e- +2OH- = Zn(OH)2
B 充电时阳极反应为:
Fe(OH)3 -3e- + 5 OH- = FeO42- + 4H2O
C 放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强(05江苏)CA、P是电源的正极
B、F极上发生的反应为:4OH- - 4e-=2H2O+O2↑
C、电解时,甲、乙、丙三池中,除E、F两极外,其余电极 均参加了反应
D、通电后,甲池的PH减小,而乙、丙两池溶液的PH不变
?
B 4.如上图所示,通电后A极上析出Ag,对该装置的有关叙述正确的是? ( )5.为下图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法正确的是 ( )
A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的PH值逐渐减小
D.CuSO4溶液的PH值不变AC 6.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6+7O2+8KOH==4K2CO3+10H2O,有关此电池的推断正确的是 ( )
A.负极反应为14H2O+7O2+28e-==28OH-
B.放电一段时间后,负极周围的pH减低
C.每消耗1molC2H6,则电路上转移的电子为14mol
D.放电过程中KOH的物质的量浓度不变
BC7 右图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。回答:
(1)直流电源中,M为 极。
(2)Pt电极上生成的物质是 ,
其质量为 g。
(3)电源输出的电子,其物质的量
与电极 b、c、d分别生成的物质的物质的量之比为: ________________
(4)AgNO3溶液的浓度(填增大、减小或不变。下同) ,AgNO3溶液的pH ,H2SO4溶液的浓度_____H2SO4溶液的pH______
(5)若H2SO4溶液的质量分数由5.00%变为5.02%,则原有5.00%的H2SO4溶液为 g。 正Ag2.164 : 4 : 1 : 2不变不变增大减小45.188 如图所示,按要求回答问题
打开电键K2,闭合电键K1,通电5分钟
后,Fe电极质量增加2.16g ,试回答:
①电源a为_______极
②写出右烧杯中电解总反应方程式
____________________________________
③若AgNO3溶液体积为200mL,且电解过程中
溶液体积不变,则电解后溶液pH为 _____
若打开电键K1, 闭合电键K2,试回答:
①整个装置是否有电流产生?________
左为______池 右为______池
②湿润的淀粉碘化钾试纸有什么变化?_________________
③当电路中转移0.02mol电子,左边共收集 224mL 气体(标况),溶液体积为 200mL,(电解前后无体积变化),则通电前CuSO4溶液的物质的量浓度为_______________.负1有电解原电d端试纸变蓝0.025mol/L
