10.1 常见的酸和碱 一课一练
图片预览



文档简介
10.1 常见的酸和碱
a 酸碱指示剂及其性质
b 酸的物理性质及用途
c 酸的化学性质
d 常见碱的特性和用途
e 碱的化学性质
f 溶液的酸碱性与PH的关系
g 溶液的酸碱性测定
一.选择题
1.人的体液的pH如果超出正常范围,会导致生理机能失调或产生疾病。人体内几种体液的正常pH范围如表所示,其中,酸性最强的是( )
体液名称
胃液
血液
唾液
胆汁
pH
0.9﹣1.5
7.35﹣7.45
6.6﹣7.1
7.1﹣7.3
A.胃液 B.血液 C.唾液 D.胆汁
2.氢氧化钠溶液、氢氧化钾溶液和氢氧化钙溶液具有相似的化学性质,其本质原因是( )
A.都能离解出金属离子
B.都能使指示剂变色
C.都能离解出氢氧根离子
D.都能与酸反应生成盐和水
3.下列数据是一些物质的pH,其中呈碱性的是( )
物质
鸡蛋清
食用醋
西瓜汁
苹果汁
pH
7.6~8
4~5
5~6
2.9~3.3
A.鸡蛋清 B.食用醋 C.西瓜汁 D.苹果汁
4.实验室中,有一瓶,没有标签的无色溶液,为了判断它是中性溶液、酸性溶液还是碱性溶液,我们应该选择的物质是( )
A.石蕊试液 B.石灰水 C.酚酞试液 D.矿泉水
5.下列有关稀盐酸除铁锈的说法正确是( )
A.铁锈的主要成分是黑色的FeO
B.反应过程中溶液由无色变为浅绿色
C.铁生锈的条件是与氧气或水接触
D.所涉及的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O
6.微型实验具有节约成本、现象明显等特点。如图是微型实验装置﹣﹣井穴板,向其中4个井穴分别滴加盐酸、醋酸、硫酸铝和氯化铵四种溶液各3滴,再各加1滴紫色石蕊试液,观察到四种溶液均变红。以下说法正确的是( )
A.四种溶液都显酸性
B.盐溶液一定呈中性
C.上述实验中紫色石蕊试液使溶液变色
D.上述溶液如果滴加酚酞试剂也变红色
7.下列实验中,可观察到明显现象的是( )
A.向盐酸中滴加酚酞溶液
B.向硫酸中滴加氢氧化钠溶液
C.将铜丝插入硫酸亚铁溶液中
D.向氯化铁溶液中滴加氢氧化钠溶液
8.氧化铜是一种黑色固体,可溶于稀硫酸,某同学想知道是稀硫酸中的哪种粒子(H2O、H+、SO42﹣)能使氧化铜溶解。请你和他一起通过图中Ⅰ、Ⅱ、Ⅲ三个实验完成这次探究括动。下列说法错误的是( )
A.不做实验Ⅰ也能说明 H2O 不能使 CuO 溶解
B.在Ⅲ中应该加入盐酸
C.此实验说明稀硝酸也能溶解氧化铜
D.可以提出的假设溶液中的 H+使 CuO溶解
9.浓盐酸和浓硫酸对比,下列叙述正确的是( )
A.两者均具有挥发性 B.两者均具有刺激性气味
C.两者均具有腐蚀性 D.两者均是黏稠状液体
10.下列属于熟石灰用途的是( )
A.改良土壤 B.炼油 C.生产橡胶 D.造纸
二.填空题
11.酸碱指示剂遇到酸性碱性溶液的颜色变化
石蕊试液遇酸变 ;遇碱变
酚酞试液遇酸 ;遇碱变
12.浓盐酸放在空气中质量变 ,质量分数变 ,原因是 .浓硫酸放在空气中质量变 ,质量分数变 ,原因是 .
13.化学实验室常见的酸有盐酸、硫酸、硝酸等,它们既有相似之处又有不同之点。
(1)稀盐酸、稀硫酸、稀硝酸具有相似的化学性质,原因是它们 ;
(2)稀盐酸、稀硫酸、稀硝酸都能与氢氧化钠反应,这类反应的实质是 (请用离子方程式来表示);
(3)若分别往稀盐酸和稀硫酸中加入少量硝酸钡溶液,观察到的现象为 。
14.如图是同学们在实验室制作叶脉书签的部分操作步骤。请回答:
(1 )在氢氧化钠溶液中煮沸叶片,可以使叶肉与叶脉易于分离。此过程中利用了氢氧化钠的 性。
(2)标出水中氢元素的化合价 。
(3)过氧化氢溶液具有漂白作用。构成过氧化氢的微观粒子是 。(用化学符号表示)
/
15.某溶液由稀盐酸、稀硫酸、氢氧化钾、氯化镁中的一种或几种混合而成。现向该混合溶液中滴入氢氧化钡溶液,产生沉淀质量与加入氢氧化钡溶液体积如图所示。则:
(1)该溶液中一定没有的溶质是 。
(2)b 点对应的溶液中一定含有的溶质是 。
16.实验室中有A、B两种溶液,经测定,A溶液pH=4.5,B溶液pH=10.2.则A溶液呈① 性(填“酸”“碱”或“中”),A溶液能使紫色石蕊溶液变② 色;B溶液能使无色酚酞溶液变③ 色.
17.如果实验室没有pH试纸,又要测定未知溶液的酸碱性,可选用 试液来进行实验,该试液从紫色变成 色,能确定其呈酸性.
三.实验探究题
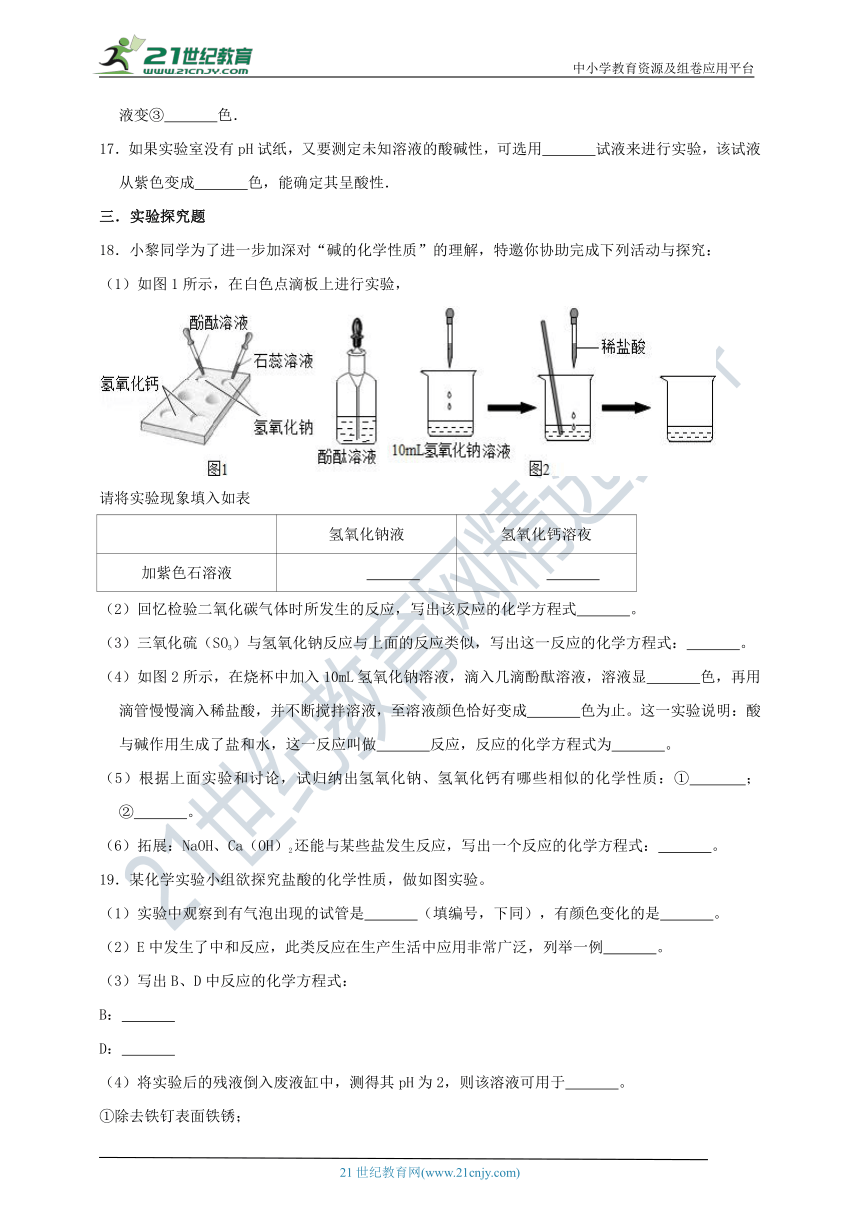
18.小黎同学为了进一步加深对“碱的化学性质”的理解,特邀你协助完成下列活动与探究:
(1)如图1所示,在白色点滴板上进行实验,
/
请将实验现象填入如表
氢氧化钠液
氢氧化钙溶夜
加紫色石溶液
(2)回忆检验二氧化碳气体时所发生的反应,写出该反应的化学方程式 。
(3)三氧化硫(SO3)与氢氧化钠反应与上面的反应类似,写出这一反应的化学方程式: 。
(4)如图2所示,在烧杯中加入10mL氢氧化钠溶液,滴入几滴酚酞溶液,溶液显 色,再用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成 色为止。这一实验说明:酸与碱作用生成了盐和水,这一反应叫做 反应,反应的化学方程式为 。
(5)根据上面实验和讨论,试归纳出氢氧化钠、氢氧化钙有哪些相似的化学性质:① ;② 。
(6)拓展:NaOH、Ca(OH)2还能与某些盐发生反应,写出一个反应的化学方程式: 。
19.某化学实验小组欲探究盐酸的化学性质,做如图实验。
(1)实验中观察到有气泡出现的试管是 (填编号,下同),有颜色变化的是 。
(2)E中发生了中和反应,此类反应在生产生活中应用非常广泛,列举一例 。
(3)写出B、D中反应的化学方程式:
B:
D:
(4)将实验后的残液倒入废液缸中,测得其pH为2,则该溶液可用于 。
①除去铁钉表面铁锈;
②洗去久盛石灰水的试剂瓶内壁的白膜;
③检验NaOH固体是否完全变质。
/
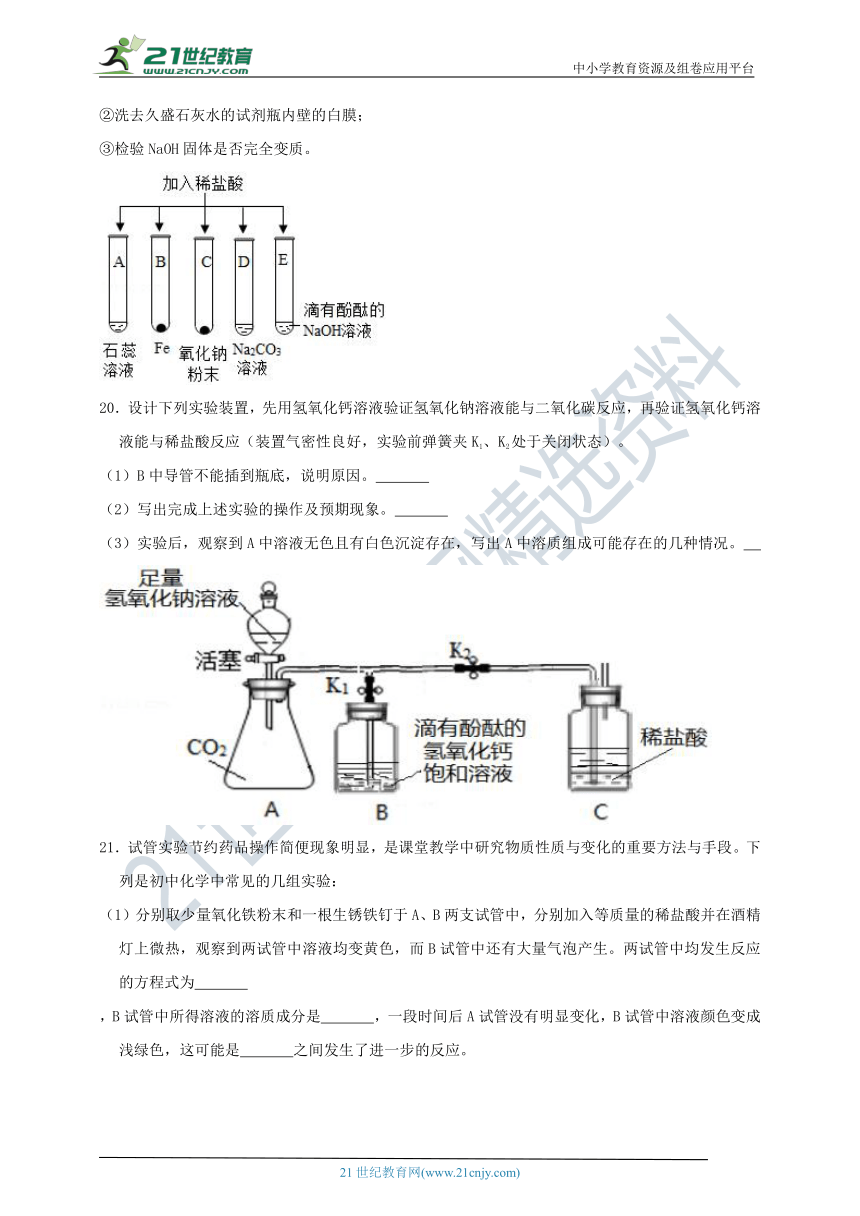
20.设计下列实验装置,先用氢氧化钙溶液验证氢氧化钠溶液能与二氧化碳反应,再验证氢氧化钙溶液能与稀盐酸反应(装置气密性良好,实验前弹簧夹K1、K2处于关闭状态)。
(1)B中导管不能插到瓶底,说明原因。
(2)写出完成上述实验的操作及预期现象。
(3)实验后,观察到A中溶液无色且有白色沉淀存在,写出A中溶质组成可能存在的几种情况。
/
21.试管实验节约药品操作简便现象明显,是课堂教学中研究物质性质与变化的重要方法与手段。下列是初中化学中常见的几组实验:
(1)分别取少量氧化铁粉末和一根生锈铁钉于A、B两支试管中,分别加入等质量的稀盐酸并在酒精灯上微热,观察到两试管中溶液均变黄色,而B试管中还有大量气泡产生。两试管中均发生反应的方程式为
,B试管中所得溶液的溶质成分是 ,一段时间后A试管没有明显变化,B试管中溶液颜色变成浅绿色,这可能是 之间发生了进一步的反应。
(2)将两片大小、形状相同的未打磨的铝片分别放入C、D两试管中,再分别倒入氯化铜溶液和硫酸铜溶液,结果C试管中产生较多气泡和紫红色固体,D试管中一段时间内无明显现象。将反复打磨了的铝片放入E试管中,加入硫酸铜溶液中产生一些气泡和紫红色固体。对比CD两试管说明 会影响铝与铜盐溶液的反应。为了验证这一观点,向D试管中加入下列物质中的 ,也产生与C试管同样现象。
A.NaCl溶液 B.Na2SO4溶液 C.KCl溶液 D.稀硫酸
对比DE两试管说明 会影响了铝与硫酸铜的反应。
(3)向盛有氢氧化钠溶液的G、H两支试管中分别滴入酚酞试液和氯化铁溶液,G中溶液变红色,H中出现 ,再分别滴入稀硫酸并充分振荡,G试管中看到 时说明氢氧化钠与稀硫酸恰好完全反应,H试管中则看到 ,此中和反应有明显现象,请再举一个有明显现象的中和反应实例 (用化学方程式表示)。
22.下列三个实验均可证明CO2能与NaOH溶液反应。
实验Ⅰ:取两体积为500mL的矿泉水瓶,排水法集满CO2,甲瓶中迅速加入100mL的水,乙瓶中迅速加入100mL的NaOH溶液,旋紧瓶塞,充分振荡,静置。
两瓶均变瘪,说明塑料瓶内压强均 (填“变大”或“变小”),其中加入NaOH溶液的塑料瓶变得更瘪,写出CO2与NaOH溶液反应的化学方程式: ;
实验Ⅱ:取实验Ⅰ中的乙瓶溶液,进行下列操作,由现象可推知CO2与NaOH溶液一定反应的是 (填序号)。
A.滴加酚酞溶液,呈红色
B.滴加少量稀盐酸,产生气泡
C.滴加少量氯化钡溶液,产生白色沉淀
D.滴入石蕊溶液,呈蓝色
实验Ⅲ:如图所示,将4g 溶质质量分数为10.0%的NaOH溶液缓慢、全部注射入瓶中,观察到酒精倒流入瓶中。此实验条件下,1体积水约可溶1体积CO2,CO2不溶于酒精。
①实验时不能用水代替量筒中的酒精的原因: ;
②实验时将NaOH溶液缓慢注射入瓶中的原因: ;
③理论上,上述4g溶质质量分数10.0%的NaOH溶液,与CO2反应都转化为Na2CO3时,可吸收的CO2的质量为 g。
答案:
一.选择题
1. A。
2. C。
/
6. A。
7. D。
8. B。
9. C。
10. A。
二.填空题
11.红;蓝;不变色;红。
12.小;小;浓盐酸具有挥发性;大;小;浓硫酸具有吸水性;
13.(1)都含有氢离子。(2)H++OH﹣═H2O。
(3)加入稀盐酸中时无明显现象,加入稀硫酸时产生白色沉淀。
14.(1 )腐蚀。(2)/2O。(3)H2O2。
15.(1)氢氧化钾、稀硫酸;(2)氯化钡、氯化镁。
16.酸性,红,红
17.紫色石蕊;红.
三.实验探究题
18.(1)
氢氧化钠液
氢氧化钙溶夜
加紫色石溶液
溶液变蓝
溶液变蓝
(2)CO2+Ca(OH)2=CaCO3↓+H2O;
/
(5)都能使指示剂变色;都能和某些非金属氧化物反应;
(6)2NaOH+CuCl2=2NaCl+Cu(OH)2↓。
19. (1)BD;ACE;
(2)用氢氧化钙中和酸性土壤;
(3)Fe+2HCl═FeCl2+H2↑;Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(4)①②。
20. (1)使B瓶中留部分溶液用于验证氢氧化钙溶液能与稀盐酸反应;(2)打开分液漏斗活塞,将足量氢氧化钠溶液全部注入锥形瓶中,立即关闭活塞;打开K1,B中部分溶液倒吸入A中,A 中溶液变浑浊,证明氢氧化钠溶液能与二氧化碳反应;打开K 2,C 中溶液分别倒吸入A、B中,B中溶液由红色变为无色,证明氢氧化钙溶液能与稀盐酸反应;(3)NaCl;NaCl、CaCl2。
21.(1)Fe2O3+6HCl═2FeCl3+3H2O,FeCl3、FeCl2,除去铁锈的铁钉与硫酸铁
(2)溶液中的酸根离子(阴离子),AC;铝片表面的致密氧化膜;
(3)红褐色沉淀;红色刚刚褪为无色;红褐色沉淀消失,溶液呈黄色;Ba(OH)2+H2SO4或Cu(OH)2+H2SO4;
22.实验Ⅰ:变小;2NaOH+CO2═Na2CO3+H2O。
实验Ⅱ:BC。
实验Ⅲ:①二氧化碳能够溶于水。
②0.22。
/
a 酸碱指示剂及其性质
b 酸的物理性质及用途
c 酸的化学性质
d 常见碱的特性和用途
e 碱的化学性质
f 溶液的酸碱性与PH的关系
g 溶液的酸碱性测定
一.选择题
1.人的体液的pH如果超出正常范围,会导致生理机能失调或产生疾病。人体内几种体液的正常pH范围如表所示,其中,酸性最强的是( )
体液名称
胃液
血液
唾液
胆汁
pH
0.9﹣1.5
7.35﹣7.45
6.6﹣7.1
7.1﹣7.3
A.胃液 B.血液 C.唾液 D.胆汁
2.氢氧化钠溶液、氢氧化钾溶液和氢氧化钙溶液具有相似的化学性质,其本质原因是( )
A.都能离解出金属离子
B.都能使指示剂变色
C.都能离解出氢氧根离子
D.都能与酸反应生成盐和水
3.下列数据是一些物质的pH,其中呈碱性的是( )
物质
鸡蛋清
食用醋
西瓜汁
苹果汁
pH
7.6~8
4~5
5~6
2.9~3.3
A.鸡蛋清 B.食用醋 C.西瓜汁 D.苹果汁
4.实验室中,有一瓶,没有标签的无色溶液,为了判断它是中性溶液、酸性溶液还是碱性溶液,我们应该选择的物质是( )
A.石蕊试液 B.石灰水 C.酚酞试液 D.矿泉水
5.下列有关稀盐酸除铁锈的说法正确是( )
A.铁锈的主要成分是黑色的FeO
B.反应过程中溶液由无色变为浅绿色
C.铁生锈的条件是与氧气或水接触
D.所涉及的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O
6.微型实验具有节约成本、现象明显等特点。如图是微型实验装置﹣﹣井穴板,向其中4个井穴分别滴加盐酸、醋酸、硫酸铝和氯化铵四种溶液各3滴,再各加1滴紫色石蕊试液,观察到四种溶液均变红。以下说法正确的是( )
A.四种溶液都显酸性
B.盐溶液一定呈中性
C.上述实验中紫色石蕊试液使溶液变色
D.上述溶液如果滴加酚酞试剂也变红色
7.下列实验中,可观察到明显现象的是( )
A.向盐酸中滴加酚酞溶液
B.向硫酸中滴加氢氧化钠溶液
C.将铜丝插入硫酸亚铁溶液中
D.向氯化铁溶液中滴加氢氧化钠溶液
8.氧化铜是一种黑色固体,可溶于稀硫酸,某同学想知道是稀硫酸中的哪种粒子(H2O、H+、SO42﹣)能使氧化铜溶解。请你和他一起通过图中Ⅰ、Ⅱ、Ⅲ三个实验完成这次探究括动。下列说法错误的是( )
A.不做实验Ⅰ也能说明 H2O 不能使 CuO 溶解
B.在Ⅲ中应该加入盐酸
C.此实验说明稀硝酸也能溶解氧化铜
D.可以提出的假设溶液中的 H+使 CuO溶解
9.浓盐酸和浓硫酸对比,下列叙述正确的是( )
A.两者均具有挥发性 B.两者均具有刺激性气味
C.两者均具有腐蚀性 D.两者均是黏稠状液体
10.下列属于熟石灰用途的是( )
A.改良土壤 B.炼油 C.生产橡胶 D.造纸
二.填空题
11.酸碱指示剂遇到酸性碱性溶液的颜色变化
石蕊试液遇酸变 ;遇碱变
酚酞试液遇酸 ;遇碱变
12.浓盐酸放在空气中质量变 ,质量分数变 ,原因是 .浓硫酸放在空气中质量变 ,质量分数变 ,原因是 .
13.化学实验室常见的酸有盐酸、硫酸、硝酸等,它们既有相似之处又有不同之点。
(1)稀盐酸、稀硫酸、稀硝酸具有相似的化学性质,原因是它们 ;
(2)稀盐酸、稀硫酸、稀硝酸都能与氢氧化钠反应,这类反应的实质是 (请用离子方程式来表示);
(3)若分别往稀盐酸和稀硫酸中加入少量硝酸钡溶液,观察到的现象为 。
14.如图是同学们在实验室制作叶脉书签的部分操作步骤。请回答:
(1 )在氢氧化钠溶液中煮沸叶片,可以使叶肉与叶脉易于分离。此过程中利用了氢氧化钠的 性。
(2)标出水中氢元素的化合价 。
(3)过氧化氢溶液具有漂白作用。构成过氧化氢的微观粒子是 。(用化学符号表示)
/
15.某溶液由稀盐酸、稀硫酸、氢氧化钾、氯化镁中的一种或几种混合而成。现向该混合溶液中滴入氢氧化钡溶液,产生沉淀质量与加入氢氧化钡溶液体积如图所示。则:
(1)该溶液中一定没有的溶质是 。
(2)b 点对应的溶液中一定含有的溶质是 。
16.实验室中有A、B两种溶液,经测定,A溶液pH=4.5,B溶液pH=10.2.则A溶液呈① 性(填“酸”“碱”或“中”),A溶液能使紫色石蕊溶液变② 色;B溶液能使无色酚酞溶液变③ 色.
17.如果实验室没有pH试纸,又要测定未知溶液的酸碱性,可选用 试液来进行实验,该试液从紫色变成 色,能确定其呈酸性.
三.实验探究题
18.小黎同学为了进一步加深对“碱的化学性质”的理解,特邀你协助完成下列活动与探究:
(1)如图1所示,在白色点滴板上进行实验,
/
请将实验现象填入如表
氢氧化钠液
氢氧化钙溶夜
加紫色石溶液
(2)回忆检验二氧化碳气体时所发生的反应,写出该反应的化学方程式 。
(3)三氧化硫(SO3)与氢氧化钠反应与上面的反应类似,写出这一反应的化学方程式: 。
(4)如图2所示,在烧杯中加入10mL氢氧化钠溶液,滴入几滴酚酞溶液,溶液显 色,再用滴管慢慢滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好变成 色为止。这一实验说明:酸与碱作用生成了盐和水,这一反应叫做 反应,反应的化学方程式为 。
(5)根据上面实验和讨论,试归纳出氢氧化钠、氢氧化钙有哪些相似的化学性质:① ;② 。
(6)拓展:NaOH、Ca(OH)2还能与某些盐发生反应,写出一个反应的化学方程式: 。
19.某化学实验小组欲探究盐酸的化学性质,做如图实验。
(1)实验中观察到有气泡出现的试管是 (填编号,下同),有颜色变化的是 。
(2)E中发生了中和反应,此类反应在生产生活中应用非常广泛,列举一例 。
(3)写出B、D中反应的化学方程式:
B:
D:
(4)将实验后的残液倒入废液缸中,测得其pH为2,则该溶液可用于 。
①除去铁钉表面铁锈;
②洗去久盛石灰水的试剂瓶内壁的白膜;
③检验NaOH固体是否完全变质。
/
20.设计下列实验装置,先用氢氧化钙溶液验证氢氧化钠溶液能与二氧化碳反应,再验证氢氧化钙溶液能与稀盐酸反应(装置气密性良好,实验前弹簧夹K1、K2处于关闭状态)。
(1)B中导管不能插到瓶底,说明原因。
(2)写出完成上述实验的操作及预期现象。
(3)实验后,观察到A中溶液无色且有白色沉淀存在,写出A中溶质组成可能存在的几种情况。
/
21.试管实验节约药品操作简便现象明显,是课堂教学中研究物质性质与变化的重要方法与手段。下列是初中化学中常见的几组实验:
(1)分别取少量氧化铁粉末和一根生锈铁钉于A、B两支试管中,分别加入等质量的稀盐酸并在酒精灯上微热,观察到两试管中溶液均变黄色,而B试管中还有大量气泡产生。两试管中均发生反应的方程式为
,B试管中所得溶液的溶质成分是 ,一段时间后A试管没有明显变化,B试管中溶液颜色变成浅绿色,这可能是 之间发生了进一步的反应。
(2)将两片大小、形状相同的未打磨的铝片分别放入C、D两试管中,再分别倒入氯化铜溶液和硫酸铜溶液,结果C试管中产生较多气泡和紫红色固体,D试管中一段时间内无明显现象。将反复打磨了的铝片放入E试管中,加入硫酸铜溶液中产生一些气泡和紫红色固体。对比CD两试管说明 会影响铝与铜盐溶液的反应。为了验证这一观点,向D试管中加入下列物质中的 ,也产生与C试管同样现象。
A.NaCl溶液 B.Na2SO4溶液 C.KCl溶液 D.稀硫酸
对比DE两试管说明 会影响了铝与硫酸铜的反应。
(3)向盛有氢氧化钠溶液的G、H两支试管中分别滴入酚酞试液和氯化铁溶液,G中溶液变红色,H中出现 ,再分别滴入稀硫酸并充分振荡,G试管中看到 时说明氢氧化钠与稀硫酸恰好完全反应,H试管中则看到 ,此中和反应有明显现象,请再举一个有明显现象的中和反应实例 (用化学方程式表示)。
22.下列三个实验均可证明CO2能与NaOH溶液反应。
实验Ⅰ:取两体积为500mL的矿泉水瓶,排水法集满CO2,甲瓶中迅速加入100mL的水,乙瓶中迅速加入100mL的NaOH溶液,旋紧瓶塞,充分振荡,静置。
两瓶均变瘪,说明塑料瓶内压强均 (填“变大”或“变小”),其中加入NaOH溶液的塑料瓶变得更瘪,写出CO2与NaOH溶液反应的化学方程式: ;
实验Ⅱ:取实验Ⅰ中的乙瓶溶液,进行下列操作,由现象可推知CO2与NaOH溶液一定反应的是 (填序号)。
A.滴加酚酞溶液,呈红色
B.滴加少量稀盐酸,产生气泡
C.滴加少量氯化钡溶液,产生白色沉淀
D.滴入石蕊溶液,呈蓝色
实验Ⅲ:如图所示,将4g 溶质质量分数为10.0%的NaOH溶液缓慢、全部注射入瓶中,观察到酒精倒流入瓶中。此实验条件下,1体积水约可溶1体积CO2,CO2不溶于酒精。
①实验时不能用水代替量筒中的酒精的原因: ;
②实验时将NaOH溶液缓慢注射入瓶中的原因: ;
③理论上,上述4g溶质质量分数10.0%的NaOH溶液,与CO2反应都转化为Na2CO3时,可吸收的CO2的质量为 g。
答案:
一.选择题
1. A。
2. C。
/
6. A。
7. D。
8. B。
9. C。
10. A。
二.填空题
11.红;蓝;不变色;红。
12.小;小;浓盐酸具有挥发性;大;小;浓硫酸具有吸水性;
13.(1)都含有氢离子。(2)H++OH﹣═H2O。
(3)加入稀盐酸中时无明显现象,加入稀硫酸时产生白色沉淀。
14.(1 )腐蚀。(2)/2O。(3)H2O2。
15.(1)氢氧化钾、稀硫酸;(2)氯化钡、氯化镁。
16.酸性,红,红
17.紫色石蕊;红.
三.实验探究题
18.(1)
氢氧化钠液
氢氧化钙溶夜
加紫色石溶液
溶液变蓝
溶液变蓝
(2)CO2+Ca(OH)2=CaCO3↓+H2O;
/
(5)都能使指示剂变色;都能和某些非金属氧化物反应;
(6)2NaOH+CuCl2=2NaCl+Cu(OH)2↓。
19. (1)BD;ACE;
(2)用氢氧化钙中和酸性土壤;
(3)Fe+2HCl═FeCl2+H2↑;Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(4)①②。
20. (1)使B瓶中留部分溶液用于验证氢氧化钙溶液能与稀盐酸反应;(2)打开分液漏斗活塞,将足量氢氧化钠溶液全部注入锥形瓶中,立即关闭活塞;打开K1,B中部分溶液倒吸入A中,A 中溶液变浑浊,证明氢氧化钠溶液能与二氧化碳反应;打开K 2,C 中溶液分别倒吸入A、B中,B中溶液由红色变为无色,证明氢氧化钙溶液能与稀盐酸反应;(3)NaCl;NaCl、CaCl2。
21.(1)Fe2O3+6HCl═2FeCl3+3H2O,FeCl3、FeCl2,除去铁锈的铁钉与硫酸铁
(2)溶液中的酸根离子(阴离子),AC;铝片表面的致密氧化膜;
(3)红褐色沉淀;红色刚刚褪为无色;红褐色沉淀消失,溶液呈黄色;Ba(OH)2+H2SO4或Cu(OH)2+H2SO4;
22.实验Ⅰ:变小;2NaOH+CO2═Na2CO3+H2O。
实验Ⅱ:BC。
实验Ⅲ:①二氧化碳能够溶于水。
②0.22。
/
同课章节目录
