10.2 酸和碱的中和反应 一课一练
图片预览


文档简介
10.2 酸和碱的中和反应
a 中和反应及其应用
一.选择题
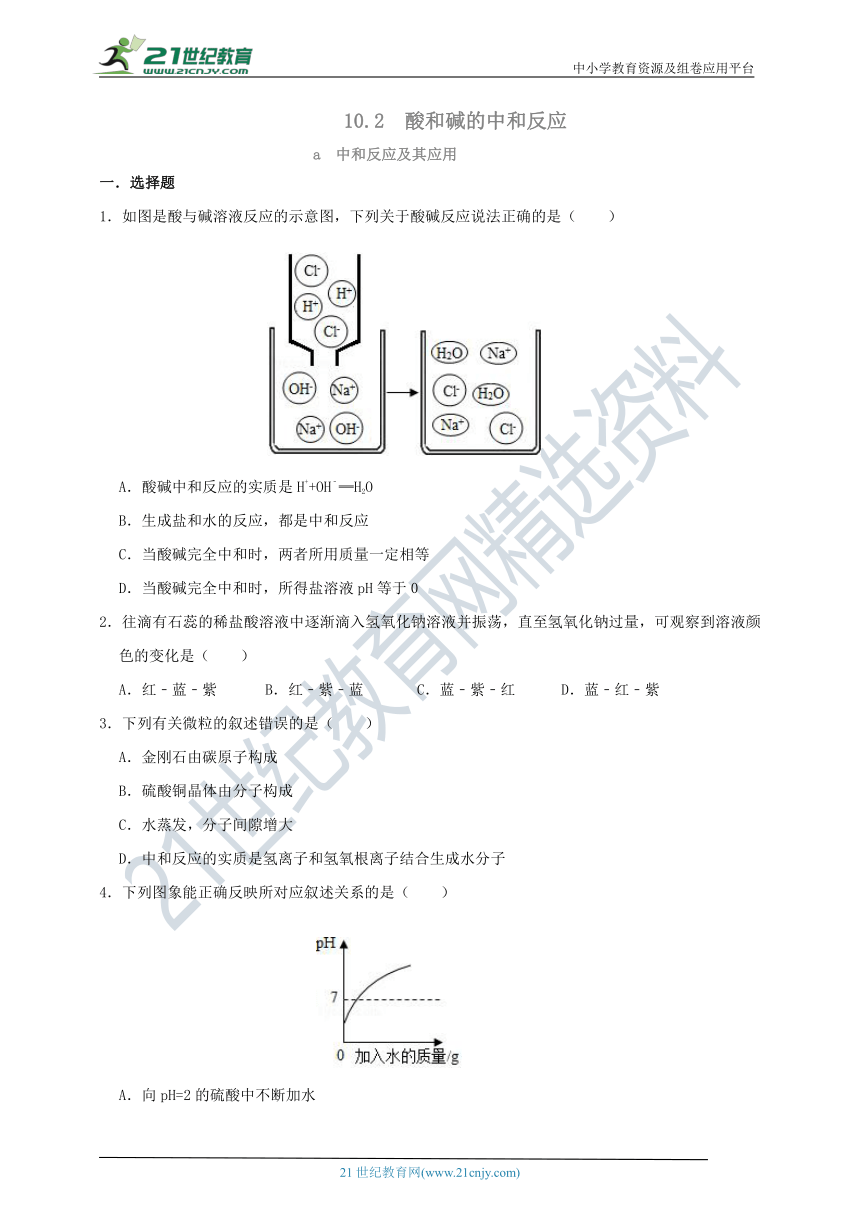
1.如图是酸与碱溶液反应的示意图,下列关于酸碱反应说法正确的是( )
A.酸碱中和反应的实质是H++OH﹣═H2O
B.生成盐和水的反应,都是中和反应
C.当酸碱完全中和时,两者所用质量一定相等
D.当酸碱完全中和时,所得盐溶液pH等于0
2.往滴有石蕊的稀盐酸溶液中逐渐滴入氢氧化钠溶液并振荡,直至氢氧化钠过量,可观察到溶液颜色的变化是( )
A.红﹣蓝﹣紫 B.红﹣紫﹣蓝 C.蓝﹣紫﹣红 D.蓝﹣红﹣紫
3.下列有关微粒的叙述错误的是( )
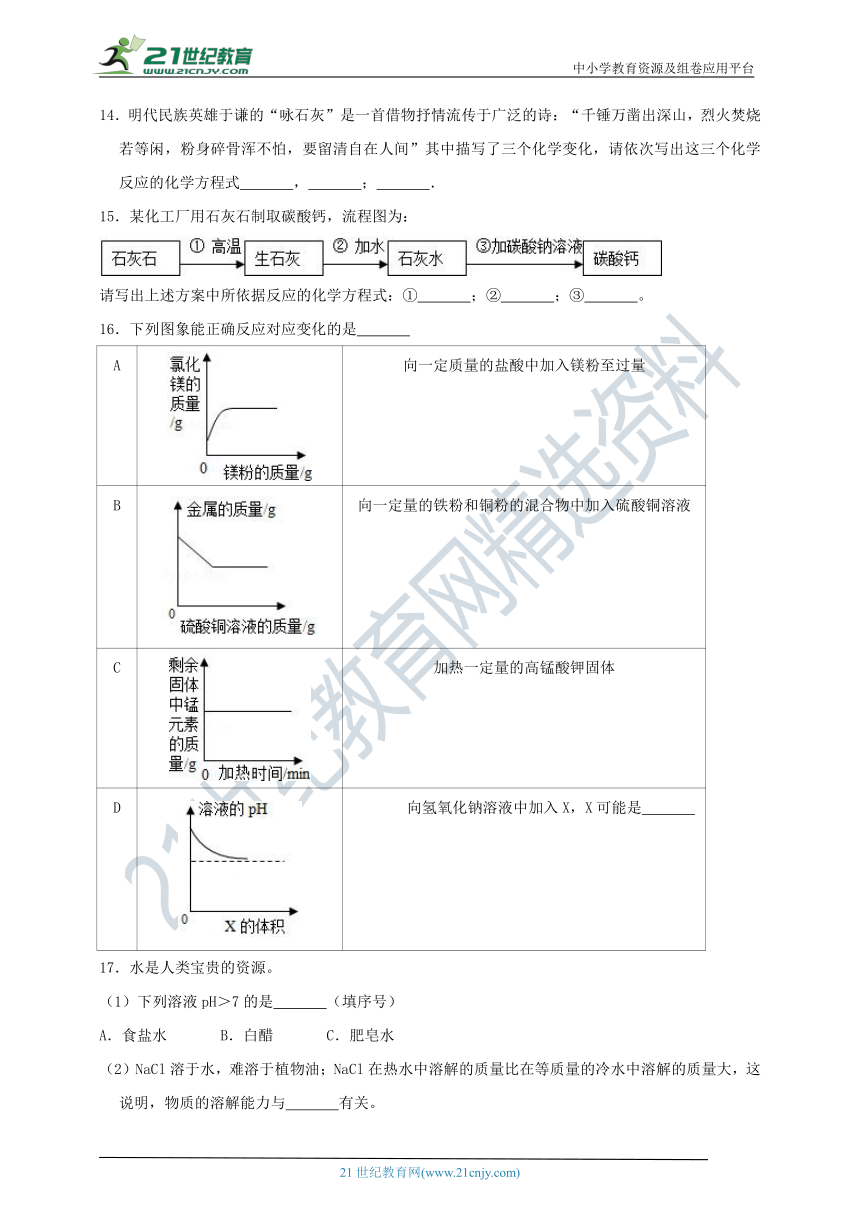
A.金刚石由碳原子构成
B.硫酸铜晶体由分子构成
C.水蒸发,分子间隙增大
D.中和反应的实质是氢离子和氢氧根离子结合生成水分子
4.下列图象能正确反映所对应叙述关系的是( )
A.向pH=2的硫酸中不断加水
B.在久置的NaOH溶液中加盐酸
C.分别向稀盐酸中加入等质量的Fe和Mg
D.双氧水分解
5.明代爱国诗人于谦写道:“千锤万凿出深山,烈火焚烧若等闲,粉身碎骨浑不怕,要留清白在人间”(《石灰呤》)该诗体现了诗人的崇高情操和献身精神.诗中蕴含着石灰的来源、生产、性质、用途等多种化学事实.下列化学变化与诗意无关的是( )
A.CaCO3/CO2↑+CaO
B.CaO+H2O=Ca(OH)2
C.CO2+Ca(OH)2=CaCO3↓+H2O
D.CO2+H2O=H2CO3
6.民族英雄于谦的石灰吟:“千锤万凿出深山,烈火焚烧若等闲.粉身碎骨浑不怕,要留清白在人间.”请你从化学的视角,找出符合诗句中物质变化顺序的选项( )
A.CaCO3→Ca(OH)2→CaO→CaCO3
B.CaCO3→CaO→Ca(OH)2→CaCO3
C.CaCO3→Ca(OH)2→CaCl2→CaCO3
D.Ca(OH)2→CaCO3→CaO→CaCO3
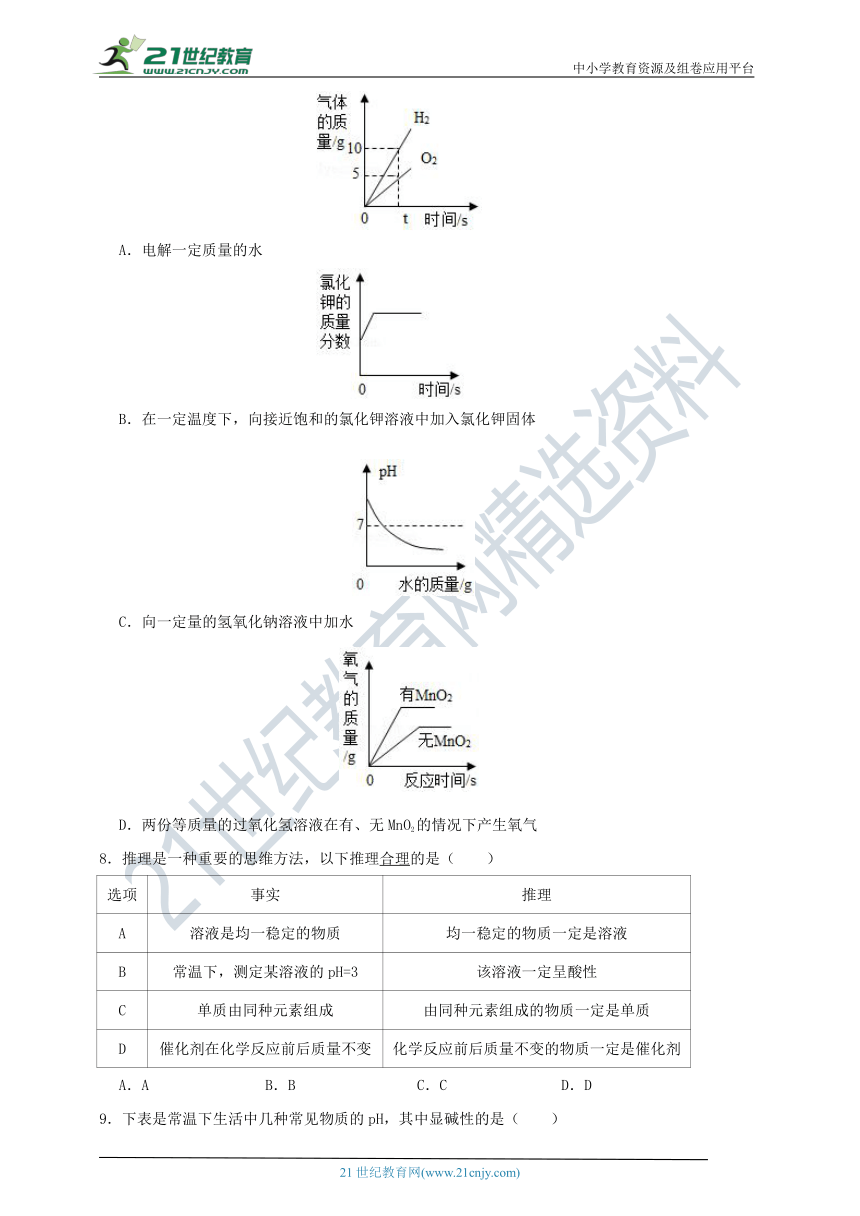
7.下列所示的四个图象,能正确反映对应变化关系的是( )
A.电解一定质量的水
B.在一定温度下,向接近饱和的氯化钾溶液中加入氯化钾固体
C.向一定量的氢氧化钠溶液中加水
D.两份等质量的过氧化氢溶液在有、无MnO2的情况下产生氧气
8.推理是一种重要的思维方法,以下推理合理的是( )
选项
事实
推理
A
溶液是均一稳定的物质
均一稳定的物质一定是溶液
B
常温下,测定某溶液的pH=3
该溶液一定呈酸性
C
单质由同种元素组成
由同种元素组成的物质一定是单质
D
催化剂在化学反应前后质量不变
化学反应前后质量不变的物质一定是催化剂
A.A B.B C.C D.D
9.下表是常温下生活中几种常见物质的pH,其中显碱性的是( )
选项
A
B
C
D
物质
新鲜牛奶
柠檬
西红柿
肥皂水
pH
7
2.2~2.4
4.0~4.4
10
A.A B.B C.C D.D
10.根据下列实验现象,可以判断溶液一定呈酸性的是( )
A.用p试纸测得pH<7的溶液
B.能使石蕊试液显蓝色的溶液
C.能与碱发生反应的溶液
D.能与盐发生反应的溶液
二.填空题
11.用烧碱中和一定量的盐酸时,溶液的pH与加入的烧碱质量的关系如图所示.烧碱与盐酸反应的化学方程式为 ;当加入烧碱n克时,溶液中的溶质为 .若改用n克氢氧化钾与相同量盐酸反应,所得溶液的pH 7(填“>“、“<“或“=”)
12.胃酸太多导致胃不舒服时,可以考虑服用抗酸药物来中和胃酸。某抗酸药物的有效成分为氢氧化镁,写出抗酸药物起作用的化学方程式: 。
13.人类的日常生活离不开酸、碱、盐三类物质,请回答下列问题:
(1)山药中含有碱性皂角素,皮肤沾上会奇非难忍。你认为可涂厨房中的 来止痒;
(2)①酸奶; ②肥皂水; ③食盐水;是生活中常见的三种物质。酸奶能使紫色石器试液变红,肥皂水显碱性,食盐水的pH=7,它们的pH由小到大的顺序为 (填序号);
(3)在树木上涂刷含有硫黄粉的石灰浆,作用是 。
(4)服用含有氢氧化铝的药物可以治疗胃酸过多症,反应的化学方程式为: 。
14.明代民族英雄于谦的“咏石灰”是一首借物抒情流传于广泛的诗:“千锤万凿出深山,烈火焚烧若等闲,粉身碎骨浑不怕,要留清自在人间”其中描写了三个化学变化,请依次写出这三个化学反应的化学方程式 , ; .
15.某化工厂用石灰石制取碳酸钙,流程图为:
/
请写出上述方案中所依据反应的化学方程式:① ;② ;③ 。
16.下列图象能正确反应对应变化的是
A
/
向一定质量的盐酸中加入镁粉至过量
B
/
向一定量的铁粉和铜粉的混合物中加入硫酸铜溶液
C
/
加热一定量的高锰酸钾固体
D
/
向氢氧化钠溶液中加入X,X可能是
17.水是人类宝贵的资源。
(1)下列溶液pH>7的是 (填序号)
A.食盐水 B.白醋 C.肥皂水
(2)NaCl溶于水,难溶于植物油;NaCl在热水中溶解的质量比在等质量的冷水中溶解的质量大,这说明,物质的溶解能力与 有关。
(3)净化水常用的方法有沉降、过滤、吸附和蒸馏,活性炭在净水器中能起到 的作用,从盐水中获得饮用水,可采取的方法是
18.经测定,在任何水溶液中,均存在一定数量的H+【用n(H+)表示】和一定数量的OH﹣【用n(OH﹣)表示】,n(H+)与n(OH﹣)的相对大小对应溶液的酸碱性如表所示:
n(H+)与n(OH﹣)的相对大小
溶液的酸碱性
n(H+)>n(OH﹣)
酸性
n(H+)=n(OH﹣)
中性
n(H+)<n(OH﹣)
碱性
据此分析
(1)常温下测得水中pH=7,可知水中n(H+) n(OH﹣)(填“>”或“=”或“<”,下同).
(2)向盛有碳酸钠溶液的试管中滴入几滴酚酞,现象是 ,原因是该溶液中n(H+) n(OH﹣).
(3)往上述试管中再滴入适量的硫酸氢钠溶液,溶液颜色褪去,说明硫酸氢钠溶液中n(H+) n(OH﹣).
(4)通过上述信息,由此得出盐溶液一定显中性是否正确? (填“正确”或“错误”).
三.实验探究题
19.某研究性学习小组对中和反应进行探究,请你参与实验。
/
【探究活动1】证明酸和碱发生了反应
小丽同学按图1进行实验,证明了盐酸和NaOH溶液能发生化学反应,他依据的实验现象是 ;反应的化学方程式 。
【探究活动2】能否通过证明有水生成来证明其反应的发生?
【设计实验】小明同学取变色硅胶、无水醋酸和氢氧化钠固体进行如图2所示的三个实验。
【小资料】a.变色硅胶吸水后由蓝色变为红色;b.无水醋酸是一种酸,常温下为无色液体;
(1)实验①、②的实验目的是 ;
(2)加入试剂后,要迅速塞紧橡胶塞的原因是 ;
(3)能证明酸和碱反应有水生成的现象是 ;
(4)除了上述方法之外,还可以按照下表实验方法证明稀盐酸与氢氧化钠发生了反应,说出对应的实验现象和实验结论:
实验步骤
实验现象
实验结论
取少量氢氧化钠溶液于试管中,加入过量稀盐酸,再加入少量氧化铜
氢氧化钠和盐酸发生了反应
20.小红进行酸碱中和反应的实验(如图所示)。她向氢氧化钠溶液中滴加一定量稀盐酸后,想起氢氧化钠溶液中事先没有滴加指示剂,为了确定盐酸与氢氧化钠的反应程度,她从烧杯中取了少量溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到试管中溶液颜色没有变化。于是她对烧杯中的溶液进行了以下探究:
(1)小红认为此时烧杯中的溶液可能有以下三种情况:
①盐酸与氢氧化钠恰好完全反应; ②氢氧化钠有剩余; ③盐酸过量。
小明同学却断定不可能“氢氧化钠有剩余”,他的理由是: ;
(2)他们共同设计了一个实验方案,欲对上述其他两种可能情况进行验证。请根据相关内容填写如表:
试验方法
可能观察到的现象
结论
将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中。
如果
则盐酸过量
如果
盐酸与氢氧化钠恰好完全反应
(3)经过讨论,他们认为利用下列几种物质代替锌粒,也可以达到验证目的。你认为其中不正确的是 (填序号)。
A.生锈的铁钉 B.碳酸钠粉末 C.硫酸钠粉末 D.氢氧化铜
(4)若采用pH试纸证明该反应恰好中和,具体方法为 。
21.(1)某溶液的pH=4,向该溶液中加入酚酞显 色,除去溶液中难溶性杂质所用的操作名称是 。
(2)净水时可用 来除去水中的色素和异味
(3)在如图所示“水中起火”的实验中,该实验中白磷能在热水中燃烧是因为 (填序号)
①白磷是可燃物;②白磷与氧气接触 ③温度达到了白磷的着火点。
22.在研究酸和碱的化学性质时,某小组同学想证明:稀H2SO4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应。请与他们一起完成实验方案的设计、实施和评价。
(1)方案一:测定稀H2SO4与NaOH溶液混合前后的pH(20℃)
测定混合后溶液的pH,pH<7。
结论:稀H2SO4与NaOH溶液确实发生了化学反应,并且 过量,该反应的化学方程式为 。
(2)方案二:探究反应终点问题
①小红说:根据图示实验步骤进行实验,观察到 。
【结论】:稀H2SO4与NaOH溶液溶液的反应恰好完全进行。
②小文说:实验开始不需要滴加酚酞试液,在实验后所得溶液中滴入几滴无色酚酞试液,若溶液颜色没有变化,则反应恰好完全进行。
【分析】:你认为他们的说法,不正确的是 ,理由是 。
请你设计一个实验,探究上述烧杯中的溶液是否呈酸性溶液:
实验操作
实验现象
实验结论
用试管取该溶液1﹣2mL, ,振荡
溶液呈酸性
(3)方案三:测温度的变化
为了进一步获取稀H2SO4与NaOH溶液确实发生了化学反应的证据,依据中和反应是 (选填“放热”、“吸热”或“无热量变化”)的反应,采用同温下的稀H2SO4与NaOH溶液进行实验,整个实验中至少需要测定溶液温度 次。
23.某化学兴趣小组围绕“酸和碱的反应”,做了如图所示的两个实验.
/
(1)实验一:向CuSO4溶液中滴入NaOH溶液,观察到的现象为 ,继续滴加稀盐酸,通过稀盐酸与 反应的现象,证明了酸和碱能发生反应.
(2)向NaOH溶液中滴入几滴酚酞溶液,振荡,继续加入稀盐酸,观察到溶液由 色变为无色,由此现象也证明了酸和碱能发生反应.
实验结束后,小组同学对实验二中试管内的无色溶液成分展开了讨论.
【提出问题】试管中无色溶液的溶质除酚酞外还有什么?
【猜想假设】猜想一:NaCl和HCl 猜想二:
【实验设计】若要证明猜想一成立,下列试剂中不能达到实验目的是 .
A.紫色石蕊溶液 B.Cu C.AgNO3 D.Na2CO3.
答案:
一.选择题
1. A。
2. B。
/
6. B。
7. B。
8. B。
9. D。
10. A。
二.填空题
11. HCl+NaOH=NaCl+H2O;NaCl;<.
12. 2HCl+Mg(OH)2=MgCl2+2H2O。
13.(1)食醋。(2)①③②。(3)防治病虫害。(4)Al(OH)3+3HCl═AlCl3+3H2O。
14. CaCO3/CaO+CO2↑;CaO+H2O═Ca(OH)2;Ca(OH)2+CO2═CaCO3↓+H2O.
15.①CaCO3/CaO+CO2↑;②CaO+H2O═Ca(OH)2;③Ca(OH)2+Na2CO3═CaCO3↓+2NaOH。
16. C 水(或氯化钠溶液等,合理即可)
17. (1)C;(2)溶剂种类和温度;(3)吸附,蒸馏。
18. (1)=;(2)溶液变为红色;<;(3)>;(4)错误.
三.实验探究题
19.(1)证明了无水醋酸和氢氧化钠不含有水,不能使变色硅胶变色;
(2)防止空气中的水分进入试管干扰试验;
(3)试管③中的变色硅胶由蓝色变为红色,试管①②中的变色硅胶不变色;
(4)取少量氢氧化钠溶液于试管中,加入过量稀盐酸,再加入少量氧化铜,根据这个描述可以推测设计本意是借助过量的盐酸和氧化铜反应能生成氯化铜,如果氢氧化钠和盐酸反应了,则没有剩余的氢氧化钠和氯化铜反应,则不会有蓝色沉淀生成;如果氢氧化钠和盐酸没反应,则氢氧化钠就能和氯化铜反应生成蓝色沉淀。故填:得到蓝色溶液。
20 (1)观察到试管中溶液颜色没有变化,说明溶液一定不显碱性,所以不可能是氢氧化钠有剩余;
(2)
试验方法
可能观察到的现象
结论
将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中。
有气泡冒出
则盐酸过量
没有气体生成
则盐酸与氢氧化钠恰好完全反应
(3)C;
(4)用玻璃棒蘸取待测溶液滴在pH试纸上,将试纸显示的颜色与标准比色卡对照,为7时说明恰好中和。
21. (1)无;过滤;(2)活性炭;(3)①②③
22.(1)稀H2SO4;2NaOH+H2SO4=Na2SO4+2H2O;
/
(3)放热;2;
23.红;【猜想假设】NaCl;【实验设计】B、C.
/
a 中和反应及其应用
一.选择题
1.如图是酸与碱溶液反应的示意图,下列关于酸碱反应说法正确的是( )
A.酸碱中和反应的实质是H++OH﹣═H2O
B.生成盐和水的反应,都是中和反应
C.当酸碱完全中和时,两者所用质量一定相等
D.当酸碱完全中和时,所得盐溶液pH等于0
2.往滴有石蕊的稀盐酸溶液中逐渐滴入氢氧化钠溶液并振荡,直至氢氧化钠过量,可观察到溶液颜色的变化是( )
A.红﹣蓝﹣紫 B.红﹣紫﹣蓝 C.蓝﹣紫﹣红 D.蓝﹣红﹣紫
3.下列有关微粒的叙述错误的是( )
A.金刚石由碳原子构成
B.硫酸铜晶体由分子构成
C.水蒸发,分子间隙增大
D.中和反应的实质是氢离子和氢氧根离子结合生成水分子
4.下列图象能正确反映所对应叙述关系的是( )
A.向pH=2的硫酸中不断加水
B.在久置的NaOH溶液中加盐酸
C.分别向稀盐酸中加入等质量的Fe和Mg
D.双氧水分解
5.明代爱国诗人于谦写道:“千锤万凿出深山,烈火焚烧若等闲,粉身碎骨浑不怕,要留清白在人间”(《石灰呤》)该诗体现了诗人的崇高情操和献身精神.诗中蕴含着石灰的来源、生产、性质、用途等多种化学事实.下列化学变化与诗意无关的是( )
A.CaCO3/CO2↑+CaO
B.CaO+H2O=Ca(OH)2
C.CO2+Ca(OH)2=CaCO3↓+H2O
D.CO2+H2O=H2CO3
6.民族英雄于谦的石灰吟:“千锤万凿出深山,烈火焚烧若等闲.粉身碎骨浑不怕,要留清白在人间.”请你从化学的视角,找出符合诗句中物质变化顺序的选项( )
A.CaCO3→Ca(OH)2→CaO→CaCO3
B.CaCO3→CaO→Ca(OH)2→CaCO3
C.CaCO3→Ca(OH)2→CaCl2→CaCO3
D.Ca(OH)2→CaCO3→CaO→CaCO3
7.下列所示的四个图象,能正确反映对应变化关系的是( )
A.电解一定质量的水
B.在一定温度下,向接近饱和的氯化钾溶液中加入氯化钾固体
C.向一定量的氢氧化钠溶液中加水
D.两份等质量的过氧化氢溶液在有、无MnO2的情况下产生氧气
8.推理是一种重要的思维方法,以下推理合理的是( )
选项
事实
推理
A
溶液是均一稳定的物质
均一稳定的物质一定是溶液
B
常温下,测定某溶液的pH=3
该溶液一定呈酸性
C
单质由同种元素组成
由同种元素组成的物质一定是单质
D
催化剂在化学反应前后质量不变
化学反应前后质量不变的物质一定是催化剂
A.A B.B C.C D.D
9.下表是常温下生活中几种常见物质的pH,其中显碱性的是( )
选项
A
B
C
D
物质
新鲜牛奶
柠檬
西红柿
肥皂水
pH
7
2.2~2.4
4.0~4.4
10
A.A B.B C.C D.D
10.根据下列实验现象,可以判断溶液一定呈酸性的是( )
A.用p试纸测得pH<7的溶液
B.能使石蕊试液显蓝色的溶液
C.能与碱发生反应的溶液
D.能与盐发生反应的溶液
二.填空题
11.用烧碱中和一定量的盐酸时,溶液的pH与加入的烧碱质量的关系如图所示.烧碱与盐酸反应的化学方程式为 ;当加入烧碱n克时,溶液中的溶质为 .若改用n克氢氧化钾与相同量盐酸反应,所得溶液的pH 7(填“>“、“<“或“=”)
12.胃酸太多导致胃不舒服时,可以考虑服用抗酸药物来中和胃酸。某抗酸药物的有效成分为氢氧化镁,写出抗酸药物起作用的化学方程式: 。
13.人类的日常生活离不开酸、碱、盐三类物质,请回答下列问题:
(1)山药中含有碱性皂角素,皮肤沾上会奇非难忍。你认为可涂厨房中的 来止痒;
(2)①酸奶; ②肥皂水; ③食盐水;是生活中常见的三种物质。酸奶能使紫色石器试液变红,肥皂水显碱性,食盐水的pH=7,它们的pH由小到大的顺序为 (填序号);
(3)在树木上涂刷含有硫黄粉的石灰浆,作用是 。
(4)服用含有氢氧化铝的药物可以治疗胃酸过多症,反应的化学方程式为: 。
14.明代民族英雄于谦的“咏石灰”是一首借物抒情流传于广泛的诗:“千锤万凿出深山,烈火焚烧若等闲,粉身碎骨浑不怕,要留清自在人间”其中描写了三个化学变化,请依次写出这三个化学反应的化学方程式 , ; .
15.某化工厂用石灰石制取碳酸钙,流程图为:
/
请写出上述方案中所依据反应的化学方程式:① ;② ;③ 。
16.下列图象能正确反应对应变化的是
A
/
向一定质量的盐酸中加入镁粉至过量
B
/
向一定量的铁粉和铜粉的混合物中加入硫酸铜溶液
C
/
加热一定量的高锰酸钾固体
D
/
向氢氧化钠溶液中加入X,X可能是
17.水是人类宝贵的资源。
(1)下列溶液pH>7的是 (填序号)
A.食盐水 B.白醋 C.肥皂水
(2)NaCl溶于水,难溶于植物油;NaCl在热水中溶解的质量比在等质量的冷水中溶解的质量大,这说明,物质的溶解能力与 有关。
(3)净化水常用的方法有沉降、过滤、吸附和蒸馏,活性炭在净水器中能起到 的作用,从盐水中获得饮用水,可采取的方法是
18.经测定,在任何水溶液中,均存在一定数量的H+【用n(H+)表示】和一定数量的OH﹣【用n(OH﹣)表示】,n(H+)与n(OH﹣)的相对大小对应溶液的酸碱性如表所示:
n(H+)与n(OH﹣)的相对大小
溶液的酸碱性
n(H+)>n(OH﹣)
酸性
n(H+)=n(OH﹣)
中性
n(H+)<n(OH﹣)
碱性
据此分析
(1)常温下测得水中pH=7,可知水中n(H+) n(OH﹣)(填“>”或“=”或“<”,下同).
(2)向盛有碳酸钠溶液的试管中滴入几滴酚酞,现象是 ,原因是该溶液中n(H+) n(OH﹣).
(3)往上述试管中再滴入适量的硫酸氢钠溶液,溶液颜色褪去,说明硫酸氢钠溶液中n(H+) n(OH﹣).
(4)通过上述信息,由此得出盐溶液一定显中性是否正确? (填“正确”或“错误”).
三.实验探究题
19.某研究性学习小组对中和反应进行探究,请你参与实验。
/
【探究活动1】证明酸和碱发生了反应
小丽同学按图1进行实验,证明了盐酸和NaOH溶液能发生化学反应,他依据的实验现象是 ;反应的化学方程式 。
【探究活动2】能否通过证明有水生成来证明其反应的发生?
【设计实验】小明同学取变色硅胶、无水醋酸和氢氧化钠固体进行如图2所示的三个实验。
【小资料】a.变色硅胶吸水后由蓝色变为红色;b.无水醋酸是一种酸,常温下为无色液体;
(1)实验①、②的实验目的是 ;
(2)加入试剂后,要迅速塞紧橡胶塞的原因是 ;
(3)能证明酸和碱反应有水生成的现象是 ;
(4)除了上述方法之外,还可以按照下表实验方法证明稀盐酸与氢氧化钠发生了反应,说出对应的实验现象和实验结论:
实验步骤
实验现象
实验结论
取少量氢氧化钠溶液于试管中,加入过量稀盐酸,再加入少量氧化铜
氢氧化钠和盐酸发生了反应
20.小红进行酸碱中和反应的实验(如图所示)。她向氢氧化钠溶液中滴加一定量稀盐酸后,想起氢氧化钠溶液中事先没有滴加指示剂,为了确定盐酸与氢氧化钠的反应程度,她从烧杯中取了少量溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到试管中溶液颜色没有变化。于是她对烧杯中的溶液进行了以下探究:
(1)小红认为此时烧杯中的溶液可能有以下三种情况:
①盐酸与氢氧化钠恰好完全反应; ②氢氧化钠有剩余; ③盐酸过量。
小明同学却断定不可能“氢氧化钠有剩余”,他的理由是: ;
(2)他们共同设计了一个实验方案,欲对上述其他两种可能情况进行验证。请根据相关内容填写如表:
试验方法
可能观察到的现象
结论
将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中。
如果
则盐酸过量
如果
盐酸与氢氧化钠恰好完全反应
(3)经过讨论,他们认为利用下列几种物质代替锌粒,也可以达到验证目的。你认为其中不正确的是 (填序号)。
A.生锈的铁钉 B.碳酸钠粉末 C.硫酸钠粉末 D.氢氧化铜
(4)若采用pH试纸证明该反应恰好中和,具体方法为 。
21.(1)某溶液的pH=4,向该溶液中加入酚酞显 色,除去溶液中难溶性杂质所用的操作名称是 。
(2)净水时可用 来除去水中的色素和异味
(3)在如图所示“水中起火”的实验中,该实验中白磷能在热水中燃烧是因为 (填序号)
①白磷是可燃物;②白磷与氧气接触 ③温度达到了白磷的着火点。
22.在研究酸和碱的化学性质时,某小组同学想证明:稀H2SO4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应。请与他们一起完成实验方案的设计、实施和评价。
(1)方案一:测定稀H2SO4与NaOH溶液混合前后的pH(20℃)
测定混合后溶液的pH,pH<7。
结论:稀H2SO4与NaOH溶液确实发生了化学反应,并且 过量,该反应的化学方程式为 。
(2)方案二:探究反应终点问题
①小红说:根据图示实验步骤进行实验,观察到 。
【结论】:稀H2SO4与NaOH溶液溶液的反应恰好完全进行。
②小文说:实验开始不需要滴加酚酞试液,在实验后所得溶液中滴入几滴无色酚酞试液,若溶液颜色没有变化,则反应恰好完全进行。
【分析】:你认为他们的说法,不正确的是 ,理由是 。
请你设计一个实验,探究上述烧杯中的溶液是否呈酸性溶液:
实验操作
实验现象
实验结论
用试管取该溶液1﹣2mL, ,振荡
溶液呈酸性
(3)方案三:测温度的变化
为了进一步获取稀H2SO4与NaOH溶液确实发生了化学反应的证据,依据中和反应是 (选填“放热”、“吸热”或“无热量变化”)的反应,采用同温下的稀H2SO4与NaOH溶液进行实验,整个实验中至少需要测定溶液温度 次。
23.某化学兴趣小组围绕“酸和碱的反应”,做了如图所示的两个实验.
/
(1)实验一:向CuSO4溶液中滴入NaOH溶液,观察到的现象为 ,继续滴加稀盐酸,通过稀盐酸与 反应的现象,证明了酸和碱能发生反应.
(2)向NaOH溶液中滴入几滴酚酞溶液,振荡,继续加入稀盐酸,观察到溶液由 色变为无色,由此现象也证明了酸和碱能发生反应.
实验结束后,小组同学对实验二中试管内的无色溶液成分展开了讨论.
【提出问题】试管中无色溶液的溶质除酚酞外还有什么?
【猜想假设】猜想一:NaCl和HCl 猜想二:
【实验设计】若要证明猜想一成立,下列试剂中不能达到实验目的是 .
A.紫色石蕊溶液 B.Cu C.AgNO3 D.Na2CO3.
答案:
一.选择题
1. A。
2. B。
/
6. B。
7. B。
8. B。
9. D。
10. A。
二.填空题
11. HCl+NaOH=NaCl+H2O;NaCl;<.
12. 2HCl+Mg(OH)2=MgCl2+2H2O。
13.(1)食醋。(2)①③②。(3)防治病虫害。(4)Al(OH)3+3HCl═AlCl3+3H2O。
14. CaCO3/CaO+CO2↑;CaO+H2O═Ca(OH)2;Ca(OH)2+CO2═CaCO3↓+H2O.
15.①CaCO3/CaO+CO2↑;②CaO+H2O═Ca(OH)2;③Ca(OH)2+Na2CO3═CaCO3↓+2NaOH。
16. C 水(或氯化钠溶液等,合理即可)
17. (1)C;(2)溶剂种类和温度;(3)吸附,蒸馏。
18. (1)=;(2)溶液变为红色;<;(3)>;(4)错误.
三.实验探究题
19.(1)证明了无水醋酸和氢氧化钠不含有水,不能使变色硅胶变色;
(2)防止空气中的水分进入试管干扰试验;
(3)试管③中的变色硅胶由蓝色变为红色,试管①②中的变色硅胶不变色;
(4)取少量氢氧化钠溶液于试管中,加入过量稀盐酸,再加入少量氧化铜,根据这个描述可以推测设计本意是借助过量的盐酸和氧化铜反应能生成氯化铜,如果氢氧化钠和盐酸反应了,则没有剩余的氢氧化钠和氯化铜反应,则不会有蓝色沉淀生成;如果氢氧化钠和盐酸没反应,则氢氧化钠就能和氯化铜反应生成蓝色沉淀。故填:得到蓝色溶液。
20 (1)观察到试管中溶液颜色没有变化,说明溶液一定不显碱性,所以不可能是氢氧化钠有剩余;
(2)
试验方法
可能观察到的现象
结论
将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中。
有气泡冒出
则盐酸过量
没有气体生成
则盐酸与氢氧化钠恰好完全反应
(3)C;
(4)用玻璃棒蘸取待测溶液滴在pH试纸上,将试纸显示的颜色与标准比色卡对照,为7时说明恰好中和。
21. (1)无;过滤;(2)活性炭;(3)①②③
22.(1)稀H2SO4;2NaOH+H2SO4=Na2SO4+2H2O;
/
(3)放热;2;
23.红;【猜想假设】NaCl;【实验设计】B、C.
/
同课章节目录
