2007届全国百校调研·高一化学第二次月考卷(化学物质及其变化)[上学期]
文档属性
| 名称 | 2007届全国百校调研·高一化学第二次月考卷(化学物质及其变化)[上学期] |

|
|
| 格式 | zip | ||
| 文件大小 | 59.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-12-28 00:00:00 | ||
图片预览

文档简介
2007届全国百校调研·高一第二次月考卷
化学物质及其变化
命题人:273500 山东邹城市实验中学 曹广雪
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Ca 40 Fe 56 Cu 64
第Ⅰ卷(选择题,共45分)
一、单项选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1.下列说法不正确的是 ( )
A.实验室制取气体前要检查装置的气密性 B.油锅不慎着火,应迅速盖上锅盖
C.用水浸法检查液化气瓶是否漏气 D.吸烟使人精神振奋,有益健康
2.下列描写事物的一些诗句,其中一定含有化学变化的是 ( )
A.白玉做床,金做马 B.忽如一夜春风来,千树万树梨花开
C.千锤万凿出深山,烈火焚烧若等闲 D.大河上下,顿失滔滔
3.下列叙述正确的是 ( )
A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B.没有单质参加的反应一定不是氧化还原反应
C.置换反应一定是氧化还原反应
D.失电子难的原子,容易获得的电子
4.下列反应中,不属于氧化还原反应的是 ( )
A.2CO+O2 2CO2 B.CH4+2O2 CO2+2H2O
C.2KClO3 2KCl+3O2↑ D.2Fe(OH)3 Fe2O3 +3H2O
5.在溶液导电性实验中,往氢氧化钡溶液中滴加硫酸至过量,灯泡的明亮度变化是:明→暗→明,下列说法正确的是 ( )
A.溶液的导电性与溶液中离子的浓度有关
B.溶液的导电性与溶液中离子数目的多少有关
C.灯泡最暗时溶液中无自由移动的离子
D.往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同
6.已知反应C2H6(气)+2Cl2(气) C2H4Cl2(液体,不溶于水)+2HCl(气),是农药生产及有机合成工业中的重要反应。为了从上述反应的产物中获得副产品盐酸,可能用到的最佳分离方案是 ( )
A.蒸馏法 B.水洗分液法 C.过滤法 D.水洗萃取法
7.下列离子方程式书写正确的是 ( )
A.铜跟硝酸银溶液反应:Cu+Ag+=Cu2++Ag
B.硫酸与氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
C.碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O
D.Ba(OH)2与CuSO4溶液反应:Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓
8.氢化钙可以作为生氢剂(其中CaH2中氢元素为-1价),反应方程式如下:CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是 ( )
A.既不是氧化剂也不是还原剂 B.是氧化剂
C.是还原剂 D.既是氧化剂又是还原剂
二、不定项选择题(本题包括7小题,每小题3分,共21分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
9.离子反应、复分解反应、置换反应和氧化还原反应之间可用集合关系表示,其正确的是 ( )
10.只有两种元素组成的化合物,其中一种是氢元素,这类化合物称为氢化物。下列物质不属于氢化物的是 ( )
A.H2O B.NH3 C.HNO3 D.NaH
11.在实验室中,因装配仪器不慎划破手指出血,可立即在出血处滴FeCl3溶液应急止血,其原因是 ( )
A.FeCl3溶液具有杀菌消毒作用
B.FeCl3溶液能使血液凝聚
C.FeCl3溶液能产生Fe(OH)3沉淀堵住伤口
D.FeCl3能使血液产生化学变化
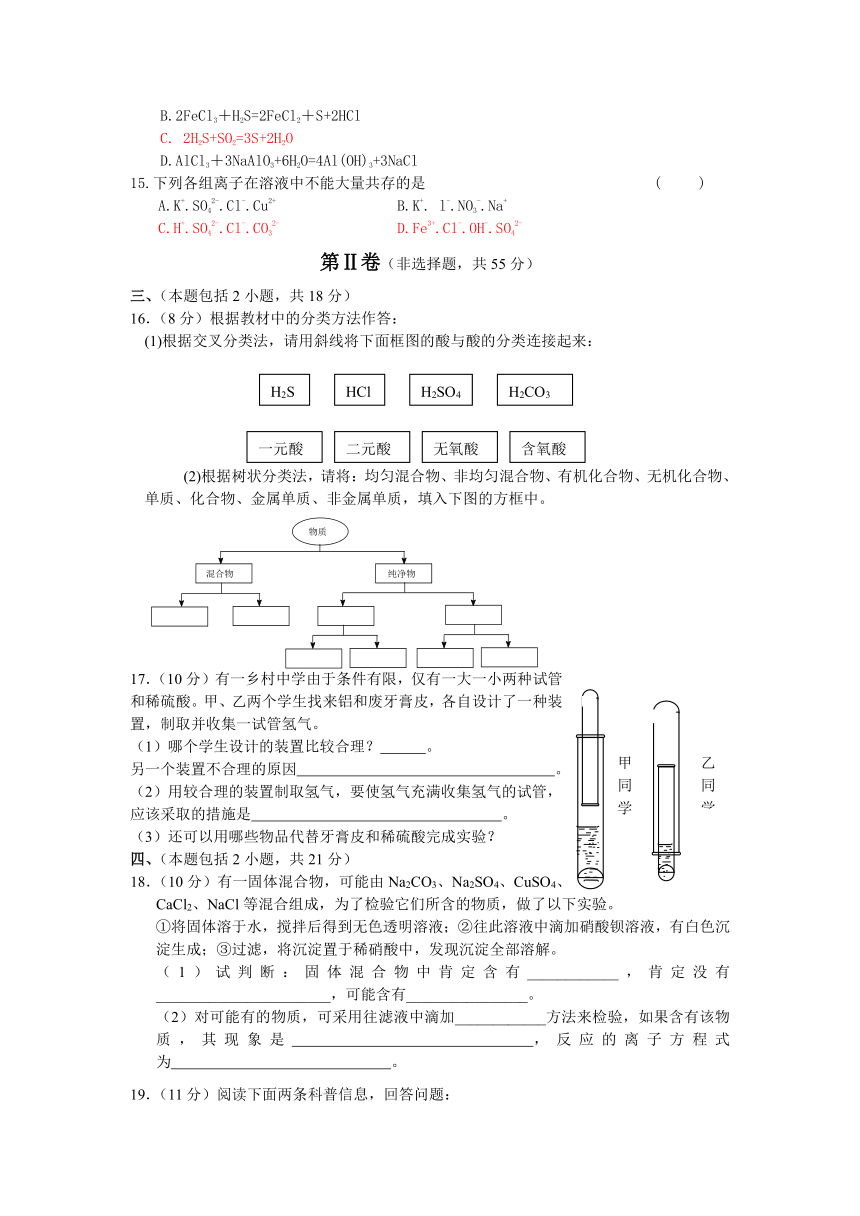
12.一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
A.NaCl是非电解质
B.NaCl溶液是电解质
C.NaCl在水溶液中电离出了可以自由移动的离子
D.NaCl溶液中水电离出大量的离子
13.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( )
A.KClO3在反应中得到电子 B.ClO2是氧化产物
C.H2C2O4在反应中被氧化 D.1mol KClO3参加反应有2 mol电子转移
14.在海水中提取溴的反应原理是5NaBr+NaBrO+3H2SO4=3Br2 +3Na2SO4+ 3H2O下列反应的原理与上述反应最相似的是 ( )
A. 2NaBr+Cl2=2NaCl+Br2
B.2FeCl3+H2S=2FeCl2+S+2HCl
C. 2H2S+SO2=3S+2H2O
D.AlCl3+3NaAlO3+6H2O=4Al(OH)3+3NaCl
15.下列各组离子在溶液中不能大量共存的是 ( )
A.K+.SO42-.Cl-.Cu2+ B.K+. l-.NO3-.Na+
C.H+.SO42-.Cl-.CO32- D.Fe3+.Cl-.OH-.SO42-
第Ⅱ卷(非选择题,共55分)
三、(本题包括2小题,共18分)
16.(8分)根据教材中的分类方法作答:
(1)根据交叉分类法,请用斜线将下面框图的酸与酸的分类连接起来:
(2)根据树状分类法,请将:均匀混合物、非均匀混合物、有机化合物、无机化合物、单质、化合物、金属单质、非金属单质,填入下图的方框中。
17.(10分)有一乡村中学由于条件有限,仅有一大一小两种试管和稀硫酸。甲、乙两个学生找来铝和废牙膏皮,各自设计了一种装置,制取并收集一试管氢气。
(1)哪个学生设计的装置比较合理? 。
另一个装置不合理的原因 。
(2)用较合理的装置制取氢气,要使氢气充满收集氢气的试管,
应该采取的措施是 。
(3)还可以用哪些物品代替牙膏皮和稀硫酸完成实验?
四、(本题包括2小题,共21分)
18.(10分)有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合组成,为了检验它们所含的物质,做了以下实验。
①将固体溶于水,搅拌后得到无色透明溶液;②往此溶液中滴加硝酸钡溶液,有白色沉淀生成;③过滤,将沉淀置于稀硝酸中,发现沉淀全部溶解。
(1)试判断:固体混合物中肯定含有____________,肯定没有_______________________,可能含有________________。
(2)对可能有的物质,可采用往滤液中滴加____________方法来检验,如果含有该物质,其现象是 ,反应的离子方程式为 。
19.(11分)阅读下面两条科普信息,回答问题:
(1)一个体重50Kg的健康人含铁2g,这2g铁在人体中不是以单质金属的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于人体吸收。
(2)在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛:CH2O表示)。
问题:
这两则科普信息分别介绍了人体内和海水中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。
(1)能在人体进行Fe2+和Fe3+的转化,这说明亚铁离子具有 性,铁离子具有 性;
(2)服用维生素C,可以使食物中的Fe3+还原成Fe2+,这句话指出维生素C是 剂,具有 性
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的化学方程式为 ;离子方程式为: 。
(4)第(2)条信息中的CO2做 剂,写出(2)中的离子方程式 。
五、(本题包括2小题,共16分)
20、(6分)右图是医院病人输液使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液标签,请认真观察标签上所列内容后填写:
(1)该溶液中含水 g
(2)该溶液的密度约为 g/mL。
(3)该溶液的物质的量浓度为 。
21.(10分稀硝酸和铜反应的化学方程式如下:
3Cu+8HNO3 =3Cu( NO3 )2+2NO+4H2O
(1)指出该氧化还原反应的氧化剂和还原剂,并用双线桥法表示出电子转移的方向和数目(在上面方程式中标出)。
(2)若生成标准状况下11.2LNO气体,计算参加反应的铜的质量以及反应中被还原的HNO3的物质的量。
参考答案
第I卷(非选择题,共45分)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
D C C D A B D B A C B C AC C CD
第Ⅱ卷(非选择题,共55分)
16.(8分)(1)(1)
(2)略
17.(10分)(1)乙学生,由于小试管套在大试管中,小试管中的空气不易排除,且氢气从两试管空隙中逸出。(2)将大试管慢慢往上移动(3)废干电池的锌皮、食醋
18.(10分)(1)Na2CO3 CuSO4、Na2SO4、CaCl2 NaCl (每空2分)
(2)AgNO3溶液 产生白色沉淀 Cl +Ag+=AgCl↓(方程式2分,其余1分)
19.(11分)(方程式2分,其余每空1分)
(1)还原性;氧化性;
(2)还原;还原
(3)Fe+2HCl=FeCl2+H2↑ ;Fe+2H+=Fe2++H2↑
(4)氧化;CO2+4Fe2++5H2O=CH2O+3Fe2O3+8H+
20、(每空2分)(1)250 (2)1 (3)0.278mol/L
21.(10分)(1)氧化剂HNO3;还原剂Cu;(电子转移的方向和数目略)
(2)参加反应的铜的质量为:9.6g 被还原的HNO3的物质的量为:0.5moL
备选题目:
1.今有三个氧化还原反应: ①2FeCl3+2KI = 2 FeCl2+2KCl+I2;②2FeCl2+Cl2 = 2FeCl3;③2KMnO4+16HCl = 2KCl+2MnCl2+5Cl2↑+8H2O。若某溶液中有Fe2+和I-共存,要氧化除去I-而又不影响Fe2+和Cl-。可加入的试剂是 ( C )
A.Cl2 B.KMnO4
C.FeCl3 D.HCl
电解质有强电解质、弱电解质之分,强电解质在水溶液中完全电离,而弱电解质如弱酸、
弱碱在水中则不能完全电离,不能完全电离的弱电解质在离子方程式中用其化学式表示,不能以离子的形式出现。请解答2、3两题。
2.下列溶液的溶质都是强电解质,这些溶液中的Cl浓度与50 mL 1 mol ·L-1 MgCl2溶液中的Cl浓度相等的是 ( B )
A. 150 mL 1 mol·L-1 NaCl溶液 B. 75 mL 1 mol·L-1 CaCl2溶液
C. 50 mL 1 mol·L-1 KCl溶液 D. 75 mL 1 mol ·L-1 AlCl3溶液
3.已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色的溶液,其化学方程式是:PbSO4+2NH4Ac = Pb(Ac)2+(NH4)2SO4。当Pb(Ac)2(醋酸铅)溶液中通入H2S时,有黑色沉淀PbS和弱电解质HAc生成。表示这个反应的有关离子方程式正确的是( C )
A.Pb(Ac)2+H2S = PbS↓+2H Ac B.Pb2++H2S = PbS↓+2H+
C.Pb2++2Ac-+H2S = PbS↓+2H Ac D.Pb2++2Ac-+2H++S2- = PbS↓+2Hac
4.针对以下A~D四个涉及H2O2的反应(未配平),填写下列空白:
A.Na2O2+HCl H2O2+NaCl B.Ag2O+H2O2 Ag+O2↑+H2O
C.H2O2H2O+O2↑ D.H2O2+Cr2(SO4)3+KOH K2CrO4+K2SO4+H2O
⑴H2O2仅体现氧化性的反应是(填选项代号,以下同)___________。
⑵H2O2既体现氧化性又体现还原性的反应是________________。
⑶H2O2体现酸性的反应是_________,其理由是_________________。
4.⑴D ⑵C ⑶A 这一反应可看作是强酸制弱酸的反应
5.某同学从古书中查得“曾青得铁化为铜”,为验证其反应情况,该同学将Fe浸入足量CuSO4溶液中,过一段时间称量,发现Fe片增重了0.8g。请回答下列问题:
(1)溶液中金属阳离子发生了什么变化,写出变化的离子方程式。
(2)求参加反应的Fe的质量。
5.(1)Cu2+减少,Fe2+增多(1分) Fe+Cu2+=Fe2++Cu (1分)
(2)Fe+Cu2+ = Fe2+ + Cu
56g 64g △m=8g
m(Fe) △m'=0.8g (2分)
所以m (Fe) =5.6g (2分)
6.在一烧杯中盛有稀H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央(如图所示)。向该烧杯里缓缓注入与稀H2SO4等密度的Ba(OH)2溶液至恰好完全反应。试回答下列问题:
(1)在此实验过程中烧杯里观察到的实验现象有:
①____________________________________________,
②____________________________________________。
(2)写出实验过程中反应的离子方程式________________________________________。
6.⑴①产生白色沉淀 ②小球下沉 ⑵Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
点燃
点燃
△
催化剂
△
光照
(图2)
(图1)
H2S
HCl
H2SO4
H2CO3
一元酸
二元酸
无氧酸
含氧酸
甲同学
乙同学
H2S
HCl
H2SO4
H2CO3
一元酸
二元酸
无氧酸
含氧酸
△
化学物质及其变化
命题人:273500 山东邹城市实验中学 曹广雪
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Ca 40 Fe 56 Cu 64
第Ⅰ卷(选择题,共45分)
一、单项选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1.下列说法不正确的是 ( )
A.实验室制取气体前要检查装置的气密性 B.油锅不慎着火,应迅速盖上锅盖
C.用水浸法检查液化气瓶是否漏气 D.吸烟使人精神振奋,有益健康
2.下列描写事物的一些诗句,其中一定含有化学变化的是 ( )
A.白玉做床,金做马 B.忽如一夜春风来,千树万树梨花开
C.千锤万凿出深山,烈火焚烧若等闲 D.大河上下,顿失滔滔
3.下列叙述正确的是 ( )
A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B.没有单质参加的反应一定不是氧化还原反应
C.置换反应一定是氧化还原反应
D.失电子难的原子,容易获得的电子
4.下列反应中,不属于氧化还原反应的是 ( )
A.2CO+O2 2CO2 B.CH4+2O2 CO2+2H2O
C.2KClO3 2KCl+3O2↑ D.2Fe(OH)3 Fe2O3 +3H2O
5.在溶液导电性实验中,往氢氧化钡溶液中滴加硫酸至过量,灯泡的明亮度变化是:明→暗→明,下列说法正确的是 ( )
A.溶液的导电性与溶液中离子的浓度有关
B.溶液的导电性与溶液中离子数目的多少有关
C.灯泡最暗时溶液中无自由移动的离子
D.往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同
6.已知反应C2H6(气)+2Cl2(气) C2H4Cl2(液体,不溶于水)+2HCl(气),是农药生产及有机合成工业中的重要反应。为了从上述反应的产物中获得副产品盐酸,可能用到的最佳分离方案是 ( )
A.蒸馏法 B.水洗分液法 C.过滤法 D.水洗萃取法
7.下列离子方程式书写正确的是 ( )
A.铜跟硝酸银溶液反应:Cu+Ag+=Cu2++Ag
B.硫酸与氢氧化钡溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
C.碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O
D.Ba(OH)2与CuSO4溶液反应:Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓
8.氢化钙可以作为生氢剂(其中CaH2中氢元素为-1价),反应方程式如下:CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是 ( )
A.既不是氧化剂也不是还原剂 B.是氧化剂
C.是还原剂 D.既是氧化剂又是还原剂
二、不定项选择题(本题包括7小题,每小题3分,共21分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
9.离子反应、复分解反应、置换反应和氧化还原反应之间可用集合关系表示,其正确的是 ( )
10.只有两种元素组成的化合物,其中一种是氢元素,这类化合物称为氢化物。下列物质不属于氢化物的是 ( )
A.H2O B.NH3 C.HNO3 D.NaH
11.在实验室中,因装配仪器不慎划破手指出血,可立即在出血处滴FeCl3溶液应急止血,其原因是 ( )
A.FeCl3溶液具有杀菌消毒作用
B.FeCl3溶液能使血液凝聚
C.FeCl3溶液能产生Fe(OH)3沉淀堵住伤口
D.FeCl3能使血液产生化学变化
12.一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
A.NaCl是非电解质
B.NaCl溶液是电解质
C.NaCl在水溶液中电离出了可以自由移动的离子
D.NaCl溶液中水电离出大量的离子
13.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( )
A.KClO3在反应中得到电子 B.ClO2是氧化产物
C.H2C2O4在反应中被氧化 D.1mol KClO3参加反应有2 mol电子转移
14.在海水中提取溴的反应原理是5NaBr+NaBrO+3H2SO4=3Br2 +3Na2SO4+ 3H2O下列反应的原理与上述反应最相似的是 ( )
A. 2NaBr+Cl2=2NaCl+Br2
B.2FeCl3+H2S=2FeCl2+S+2HCl
C. 2H2S+SO2=3S+2H2O
D.AlCl3+3NaAlO3+6H2O=4Al(OH)3+3NaCl
15.下列各组离子在溶液中不能大量共存的是 ( )
A.K+.SO42-.Cl-.Cu2+ B.K+. l-.NO3-.Na+
C.H+.SO42-.Cl-.CO32- D.Fe3+.Cl-.OH-.SO42-
第Ⅱ卷(非选择题,共55分)
三、(本题包括2小题,共18分)
16.(8分)根据教材中的分类方法作答:
(1)根据交叉分类法,请用斜线将下面框图的酸与酸的分类连接起来:
(2)根据树状分类法,请将:均匀混合物、非均匀混合物、有机化合物、无机化合物、单质、化合物、金属单质、非金属单质,填入下图的方框中。
17.(10分)有一乡村中学由于条件有限,仅有一大一小两种试管和稀硫酸。甲、乙两个学生找来铝和废牙膏皮,各自设计了一种装置,制取并收集一试管氢气。
(1)哪个学生设计的装置比较合理? 。
另一个装置不合理的原因 。
(2)用较合理的装置制取氢气,要使氢气充满收集氢气的试管,
应该采取的措施是 。
(3)还可以用哪些物品代替牙膏皮和稀硫酸完成实验?
四、(本题包括2小题,共21分)
18.(10分)有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合组成,为了检验它们所含的物质,做了以下实验。
①将固体溶于水,搅拌后得到无色透明溶液;②往此溶液中滴加硝酸钡溶液,有白色沉淀生成;③过滤,将沉淀置于稀硝酸中,发现沉淀全部溶解。
(1)试判断:固体混合物中肯定含有____________,肯定没有_______________________,可能含有________________。
(2)对可能有的物质,可采用往滤液中滴加____________方法来检验,如果含有该物质,其现象是 ,反应的离子方程式为 。
19.(11分)阅读下面两条科普信息,回答问题:
(1)一个体重50Kg的健康人含铁2g,这2g铁在人体中不是以单质金属的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于人体吸收。
(2)在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛:CH2O表示)。
问题:
这两则科普信息分别介绍了人体内和海水中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。
(1)能在人体进行Fe2+和Fe3+的转化,这说明亚铁离子具有 性,铁离子具有 性;
(2)服用维生素C,可以使食物中的Fe3+还原成Fe2+,这句话指出维生素C是 剂,具有 性
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的化学方程式为 ;离子方程式为: 。
(4)第(2)条信息中的CO2做 剂,写出(2)中的离子方程式 。
五、(本题包括2小题,共16分)
20、(6分)右图是医院病人输液使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液标签,请认真观察标签上所列内容后填写:
(1)该溶液中含水 g
(2)该溶液的密度约为 g/mL。
(3)该溶液的物质的量浓度为 。
21.(10分稀硝酸和铜反应的化学方程式如下:
3Cu+8HNO3 =3Cu( NO3 )2+2NO+4H2O
(1)指出该氧化还原反应的氧化剂和还原剂,并用双线桥法表示出电子转移的方向和数目(在上面方程式中标出)。
(2)若生成标准状况下11.2LNO气体,计算参加反应的铜的质量以及反应中被还原的HNO3的物质的量。
参考答案
第I卷(非选择题,共45分)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
D C C D A B D B A C B C AC C CD
第Ⅱ卷(非选择题,共55分)
16.(8分)(1)(1)
(2)略
17.(10分)(1)乙学生,由于小试管套在大试管中,小试管中的空气不易排除,且氢气从两试管空隙中逸出。(2)将大试管慢慢往上移动(3)废干电池的锌皮、食醋
18.(10分)(1)Na2CO3 CuSO4、Na2SO4、CaCl2 NaCl (每空2分)
(2)AgNO3溶液 产生白色沉淀 Cl +Ag+=AgCl↓(方程式2分,其余1分)
19.(11分)(方程式2分,其余每空1分)
(1)还原性;氧化性;
(2)还原;还原
(3)Fe+2HCl=FeCl2+H2↑ ;Fe+2H+=Fe2++H2↑
(4)氧化;CO2+4Fe2++5H2O=CH2O+3Fe2O3+8H+
20、(每空2分)(1)250 (2)1 (3)0.278mol/L
21.(10分)(1)氧化剂HNO3;还原剂Cu;(电子转移的方向和数目略)
(2)参加反应的铜的质量为:9.6g 被还原的HNO3的物质的量为:0.5moL
备选题目:
1.今有三个氧化还原反应: ①2FeCl3+2KI = 2 FeCl2+2KCl+I2;②2FeCl2+Cl2 = 2FeCl3;③2KMnO4+16HCl = 2KCl+2MnCl2+5Cl2↑+8H2O。若某溶液中有Fe2+和I-共存,要氧化除去I-而又不影响Fe2+和Cl-。可加入的试剂是 ( C )
A.Cl2 B.KMnO4
C.FeCl3 D.HCl
电解质有强电解质、弱电解质之分,强电解质在水溶液中完全电离,而弱电解质如弱酸、
弱碱在水中则不能完全电离,不能完全电离的弱电解质在离子方程式中用其化学式表示,不能以离子的形式出现。请解答2、3两题。
2.下列溶液的溶质都是强电解质,这些溶液中的Cl浓度与50 mL 1 mol ·L-1 MgCl2溶液中的Cl浓度相等的是 ( B )
A. 150 mL 1 mol·L-1 NaCl溶液 B. 75 mL 1 mol·L-1 CaCl2溶液
C. 50 mL 1 mol·L-1 KCl溶液 D. 75 mL 1 mol ·L-1 AlCl3溶液
3.已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色的溶液,其化学方程式是:PbSO4+2NH4Ac = Pb(Ac)2+(NH4)2SO4。当Pb(Ac)2(醋酸铅)溶液中通入H2S时,有黑色沉淀PbS和弱电解质HAc生成。表示这个反应的有关离子方程式正确的是( C )
A.Pb(Ac)2+H2S = PbS↓+2H Ac B.Pb2++H2S = PbS↓+2H+
C.Pb2++2Ac-+H2S = PbS↓+2H Ac D.Pb2++2Ac-+2H++S2- = PbS↓+2Hac
4.针对以下A~D四个涉及H2O2的反应(未配平),填写下列空白:
A.Na2O2+HCl H2O2+NaCl B.Ag2O+H2O2 Ag+O2↑+H2O
C.H2O2H2O+O2↑ D.H2O2+Cr2(SO4)3+KOH K2CrO4+K2SO4+H2O
⑴H2O2仅体现氧化性的反应是(填选项代号,以下同)___________。
⑵H2O2既体现氧化性又体现还原性的反应是________________。
⑶H2O2体现酸性的反应是_________,其理由是_________________。
4.⑴D ⑵C ⑶A 这一反应可看作是强酸制弱酸的反应
5.某同学从古书中查得“曾青得铁化为铜”,为验证其反应情况,该同学将Fe浸入足量CuSO4溶液中,过一段时间称量,发现Fe片增重了0.8g。请回答下列问题:
(1)溶液中金属阳离子发生了什么变化,写出变化的离子方程式。
(2)求参加反应的Fe的质量。
5.(1)Cu2+减少,Fe2+增多(1分) Fe+Cu2+=Fe2++Cu (1分)
(2)Fe+Cu2+ = Fe2+ + Cu
56g 64g △m=8g
m(Fe) △m'=0.8g (2分)
所以m (Fe) =5.6g (2分)
6.在一烧杯中盛有稀H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央(如图所示)。向该烧杯里缓缓注入与稀H2SO4等密度的Ba(OH)2溶液至恰好完全反应。试回答下列问题:
(1)在此实验过程中烧杯里观察到的实验现象有:
①____________________________________________,
②____________________________________________。
(2)写出实验过程中反应的离子方程式________________________________________。
6.⑴①产生白色沉淀 ②小球下沉 ⑵Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
点燃
点燃
△
催化剂
△
光照
(图2)
(图1)
H2S
HCl
H2SO4
H2CO3
一元酸
二元酸
无氧酸
含氧酸
甲同学
乙同学
H2S
HCl
H2SO4
H2CO3
一元酸
二元酸
无氧酸
含氧酸
△
