几种重要的金属化合物 复习课件[上学期]
文档属性
| 名称 | 几种重要的金属化合物 复习课件[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 600.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-07-26 00:00:00 | ||
图片预览








文档简介
课件20张PPT。顺德均安中学顺德均安中学第三章 金 属 及 其 化 合 物
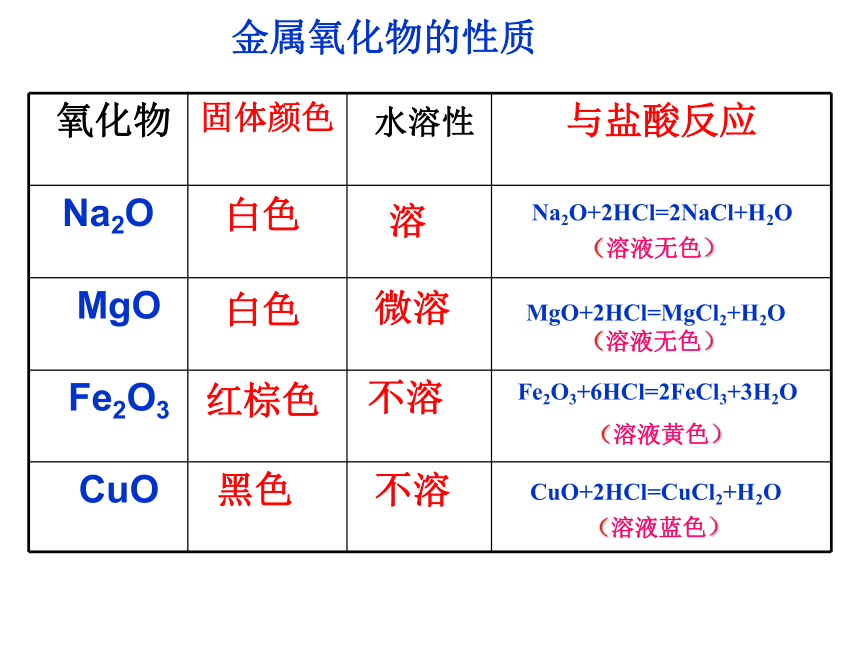
2 几种重要的金属化合物 几种重要的金属化合物氢氧化物氧化物盐一.氧化物 ①多数金属氧化物不溶于水,如 ②只有少数金属氧化物溶于水,能与水起反应生成或微溶的碱,如Na2O、MgO 、CaO等1.金属氧化物的性质(1)溶解性Fe2O3 、CuO、 Al2O3等金属氧化物的性质(溶液无色)(溶液无色)白色白色红棕色黑色溶微溶不溶不溶MgO+2HCl=MgCl2+H2ONa2O+2HCl=2NaCl+H2OFe2O3+6HCl=2FeCl3+3H2O(溶液黄色)CuO+2HCl=CuCl2+H2O(溶液蓝色) 以上金属氧化物能与酸起反应,生成
盐和水,这类氧化物称为碱性氧化物总结:(3)氧化铝性质的特殊性Al2O3+6HCl==2AlCl3+3H2OAl2O3+2NaOH==2NaAlO2+H2O(偏铝酸钠) 因此氧化铝既能与酸反应生成盐和水,也能与强碱溶液反应生成盐和水这类氧化物叫做两性氧化物 2. 金属氧化物的用途 Ⅰ.作为冶炼金属的原料Fe2O3+3CO===2Fe+3CO2 Ⅱ.氧化铁(Fe2O3)是一种红棕色的粉未(俗称铁红),常用于制造红色油漆和涂料 Ⅲ.氧化铝(Al2O3)是一种白色难熔的物质,是一种较好的耐火材料 Ⅳ.氧化亚铜(Cu2O)呈红色,可以制造玻璃、搪瓷的红色颜料碱的一般性质物理性质:① 水溶性易溶于水的:微溶于水的:难溶于水的:②色态NaOH KOH Ba(OH)2等Ca(OH)2Cu(OH)2 Al(OH)3 Fe(OH)3等NaOH KOH Ba(OH)2 Ca(OH)2为白色固体Cu(OH)2为浅蓝色固体化学性质: ①碱溶液能使酚酞变红色,使紫色石蕊变蓝色②能与酸反应生成盐和水NaOH+HCl=NaCl+H2OCu(OH)2+H2SO4=CuSO4+2H2O(H++OH-= H2O)[Cu(OH)2+2H+=Cu2++2H2O]二.氢氧化物1.铁的氢氧化物实验3-6:在FeCl3、FeSO4分别加入NaOH溶液产生红褐色的沉淀先有灰白色的沉淀,迅速变成灰绿色,最后变成红褐色FeCl3+3NaOH=
Fe(OH)3↓+3NaClFeSO4+2NaOH=Fe(OH)2↓ +Na2SO44Fe(OH)2+O2+2H2O=4Fe(OH)3(1)氢氧化铁的性质①与酸反应②受热可分解氢氧化铁是一种难溶于水的红褐色固体Fe(OH)3+3HCl=FeCl3+3H2O 2Fe(OH)3===Fe2O3+3H2O(2)氢氧化亚铁的性质①与酸反应② 不稳定,易被空气中的氧气氧化Fe(OH)2+2HCl=FeCl2+2H2O4Fe(OH)2+O2+2H2O=4Fe(OH)3(氧化剂)(还原剂)2.氢氧化铝(1)氢氧化铝的制备实验:向0.5molL的Al2(SO4)3溶液滴加氨水现象:产生白色胶状沉淀Al2(SO4)3+6NH3?H2O=2Al(OH)3 +3(NH4)2SO4 白色胶状的氢氧化铝难溶于水,能凝聚水中的悬浮物,并能吸附色素(2)氢氧化铝的性质实验1:向氢氧化铝沉淀中加入盐酸现象:白色沉淀溶解成无色溶液Al(OH)3+3HCl=AlCl3+3H2O实验2:向氢氧化铝沉淀中加入氢氧化钠溶液现象:白色沉淀溶解成无色溶液 Al(OH)3+NaOH=NaAlO2+2H2O ①可见氢氧化铝既能与酸反应也能与碱反应,所以,氢氧化铝是两性氢氧化物 ②受热可以分解 Al(OH)3==Al2O3+H2O练习 1.在MgCl2溶液中滴加少量的NaOH溶液,现象为_____________,继续加入过量的NaOH溶液,现象为______________。在AlCl3溶液中滴加少量NaOH溶液,现象为_____________,继续加入过量的NaOH溶液,现象为___________.产生白色沉淀产生白色沉淀白色沉淀不溶解白色沉淀溶解 2.下列金属化合物,不能与氢氧化钠溶液反应的是:( )
A. FeCl3 B. Fe2O3 C. Al2O3 D.Al(OH)33.可用做医用胃酸用和剂的是: ( )
A. NaOH B. Cu(OH)2 C. Al(OH)3 D. NaHCO3BCD三.盐1.碳酸钠和碳酸氢钠 (1)Na2CO3和NaHCO3在水中的溶解性 固体的量减少溶液变微红色 白色粉未,加水结块成晶体,放热 白色粉未,加水部分溶解,感受不到热量变化振荡长时间可溶解溶液变红色 加水先变成含结晶水的晶体,溶液的碱性比NaHCO3强
加水部分溶解,溶液的碱性比Na2CO3弱初步结论(2)Na2CO3和NaHCO3的热稳定性① Na2CO3稳定受热不分解② NaHCO3不稳定,受热可分解现象:澄 清石灰水变浑浊2NaHCO3===Na2CO3+H2O+CO2(3)Na2CO3和NaHCO3盐酸的反应现象化学方程式反应较剧烈,有气泡产生反应很剧烈,有气泡产生
Na2CO3+2HCl=2NaCl+H2O+CO2CO32-+2H+=H2O+CO2NaHCO3+HCl=NaCl+H2O+CO2HCO3-+H+=H2O+CO2 2.三价铁的氧化性 (1)Fe3+离子的检验 向FeCl3和FeCl2溶液中分别加入KSCN溶液 溶液呈血红色溶液颜色无变化 交流和讨论:有哪些方法可以签别FeCl3溶液和FeCl2溶液(2)Fe3+离子的氧化性 实验1:在FeCl3溶液中加入Fe粉,振荡。再滴入几滴KSCN溶液现象:溶液不显红色结论:溶液中已不含Fe3+2FeCl3 + Fe == 3FeCl2 反应方程式:(氧化剂)(还原剂) 实验2:在以上所得到的FeCl2和KSCN的混合溶液中,滴加氯水(Cl2)现象:溶液变成红色结论:原溶液中的Fe2+转变成Fe3+反应方程式:2FeCl2 + Cl2 == 2FeCl3氧化剂还原剂总结:还原剂+氧化剂(Cl2)+还原剂(Fe)氧化剂Fe2+Fe3+3.焰色反应 很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这在化学上叫做焰色反应 ①我们在炒菜的时候,偶有食盐溅在煤气火焰上,火焰呈黄色 ②钠燃烧时,火焰呈黄色 实验:用铂丝分别蘸取碳酸钠溶液和碳酸钾溶液,在火焰上灼烧问题1.铂丝为什么要用盐酸洗涤? 2.为什么要用蓝色钴玻璃观察钾的焰色? 一些金属及化合物的焰色反应 黄色紫色砖红色洋红色绿色紫红色黄绿色顺德均安中学顺德均安中学2.在某溶液中酚酞呈红色。下列离子在该溶液中
不能大量存在的是 ( )
A.Fe3+ B.Na+ C.Ba2+ D.Al3+1.下列化合物与小苏打溶液反应,没有气体或沉淀生成的是
( )
A.烧碱 B.硫酸氢钠 C.氢氧化钡 D.过氧化钠
3.下列离子方程式书写正确的是 ( ) ( )
A.FeCl2溶液中通入Cl2:Fe2++Cl2→Fe3++2Cl-
B.Ba(OH) 2溶液与盐酸的反应 OH-+H+ = H2O
C.Al(OH) 3沉淀中滴加盐酸 Al(OH) 3+3H+ = Al3++3H2O
D. AlCl3溶液中加入过量氨水:Al3++4OH-→+2H2OAADBC练习
2 几种重要的金属化合物 几种重要的金属化合物氢氧化物氧化物盐一.氧化物 ①多数金属氧化物不溶于水,如 ②只有少数金属氧化物溶于水,能与水起反应生成或微溶的碱,如Na2O、MgO 、CaO等1.金属氧化物的性质(1)溶解性Fe2O3 、CuO、 Al2O3等金属氧化物的性质(溶液无色)(溶液无色)白色白色红棕色黑色溶微溶不溶不溶MgO+2HCl=MgCl2+H2ONa2O+2HCl=2NaCl+H2OFe2O3+6HCl=2FeCl3+3H2O(溶液黄色)CuO+2HCl=CuCl2+H2O(溶液蓝色) 以上金属氧化物能与酸起反应,生成
盐和水,这类氧化物称为碱性氧化物总结:(3)氧化铝性质的特殊性Al2O3+6HCl==2AlCl3+3H2OAl2O3+2NaOH==2NaAlO2+H2O(偏铝酸钠) 因此氧化铝既能与酸反应生成盐和水,也能与强碱溶液反应生成盐和水这类氧化物叫做两性氧化物 2. 金属氧化物的用途 Ⅰ.作为冶炼金属的原料Fe2O3+3CO===2Fe+3CO2 Ⅱ.氧化铁(Fe2O3)是一种红棕色的粉未(俗称铁红),常用于制造红色油漆和涂料 Ⅲ.氧化铝(Al2O3)是一种白色难熔的物质,是一种较好的耐火材料 Ⅳ.氧化亚铜(Cu2O)呈红色,可以制造玻璃、搪瓷的红色颜料碱的一般性质物理性质:① 水溶性易溶于水的:微溶于水的:难溶于水的:②色态NaOH KOH Ba(OH)2等Ca(OH)2Cu(OH)2 Al(OH)3 Fe(OH)3等NaOH KOH Ba(OH)2 Ca(OH)2为白色固体Cu(OH)2为浅蓝色固体化学性质: ①碱溶液能使酚酞变红色,使紫色石蕊变蓝色②能与酸反应生成盐和水NaOH+HCl=NaCl+H2OCu(OH)2+H2SO4=CuSO4+2H2O(H++OH-= H2O)[Cu(OH)2+2H+=Cu2++2H2O]二.氢氧化物1.铁的氢氧化物实验3-6:在FeCl3、FeSO4分别加入NaOH溶液产生红褐色的沉淀先有灰白色的沉淀,迅速变成灰绿色,最后变成红褐色FeCl3+3NaOH=
Fe(OH)3↓+3NaClFeSO4+2NaOH=Fe(OH)2↓ +Na2SO44Fe(OH)2+O2+2H2O=4Fe(OH)3(1)氢氧化铁的性质①与酸反应②受热可分解氢氧化铁是一种难溶于水的红褐色固体Fe(OH)3+3HCl=FeCl3+3H2O 2Fe(OH)3===Fe2O3+3H2O(2)氢氧化亚铁的性质①与酸反应② 不稳定,易被空气中的氧气氧化Fe(OH)2+2HCl=FeCl2+2H2O4Fe(OH)2+O2+2H2O=4Fe(OH)3(氧化剂)(还原剂)2.氢氧化铝(1)氢氧化铝的制备实验:向0.5molL的Al2(SO4)3溶液滴加氨水现象:产生白色胶状沉淀Al2(SO4)3+6NH3?H2O=2Al(OH)3 +3(NH4)2SO4 白色胶状的氢氧化铝难溶于水,能凝聚水中的悬浮物,并能吸附色素(2)氢氧化铝的性质实验1:向氢氧化铝沉淀中加入盐酸现象:白色沉淀溶解成无色溶液Al(OH)3+3HCl=AlCl3+3H2O实验2:向氢氧化铝沉淀中加入氢氧化钠溶液现象:白色沉淀溶解成无色溶液 Al(OH)3+NaOH=NaAlO2+2H2O ①可见氢氧化铝既能与酸反应也能与碱反应,所以,氢氧化铝是两性氢氧化物 ②受热可以分解 Al(OH)3==Al2O3+H2O练习 1.在MgCl2溶液中滴加少量的NaOH溶液,现象为_____________,继续加入过量的NaOH溶液,现象为______________。在AlCl3溶液中滴加少量NaOH溶液,现象为_____________,继续加入过量的NaOH溶液,现象为___________.产生白色沉淀产生白色沉淀白色沉淀不溶解白色沉淀溶解 2.下列金属化合物,不能与氢氧化钠溶液反应的是:( )
A. FeCl3 B. Fe2O3 C. Al2O3 D.Al(OH)33.可用做医用胃酸用和剂的是: ( )
A. NaOH B. Cu(OH)2 C. Al(OH)3 D. NaHCO3BCD三.盐1.碳酸钠和碳酸氢钠 (1)Na2CO3和NaHCO3在水中的溶解性 固体的量减少溶液变微红色 白色粉未,加水结块成晶体,放热 白色粉未,加水部分溶解,感受不到热量变化振荡长时间可溶解溶液变红色 加水先变成含结晶水的晶体,溶液的碱性比NaHCO3强
加水部分溶解,溶液的碱性比Na2CO3弱初步结论(2)Na2CO3和NaHCO3的热稳定性① Na2CO3稳定受热不分解② NaHCO3不稳定,受热可分解现象:澄 清石灰水变浑浊2NaHCO3===Na2CO3+H2O+CO2(3)Na2CO3和NaHCO3盐酸的反应现象化学方程式反应较剧烈,有气泡产生反应很剧烈,有气泡产生
Na2CO3+2HCl=2NaCl+H2O+CO2CO32-+2H+=H2O+CO2NaHCO3+HCl=NaCl+H2O+CO2HCO3-+H+=H2O+CO2 2.三价铁的氧化性 (1)Fe3+离子的检验 向FeCl3和FeCl2溶液中分别加入KSCN溶液 溶液呈血红色溶液颜色无变化 交流和讨论:有哪些方法可以签别FeCl3溶液和FeCl2溶液(2)Fe3+离子的氧化性 实验1:在FeCl3溶液中加入Fe粉,振荡。再滴入几滴KSCN溶液现象:溶液不显红色结论:溶液中已不含Fe3+2FeCl3 + Fe == 3FeCl2 反应方程式:(氧化剂)(还原剂) 实验2:在以上所得到的FeCl2和KSCN的混合溶液中,滴加氯水(Cl2)现象:溶液变成红色结论:原溶液中的Fe2+转变成Fe3+反应方程式:2FeCl2 + Cl2 == 2FeCl3氧化剂还原剂总结:还原剂+氧化剂(Cl2)+还原剂(Fe)氧化剂Fe2+Fe3+3.焰色反应 很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这在化学上叫做焰色反应 ①我们在炒菜的时候,偶有食盐溅在煤气火焰上,火焰呈黄色 ②钠燃烧时,火焰呈黄色 实验:用铂丝分别蘸取碳酸钠溶液和碳酸钾溶液,在火焰上灼烧问题1.铂丝为什么要用盐酸洗涤? 2.为什么要用蓝色钴玻璃观察钾的焰色? 一些金属及化合物的焰色反应 黄色紫色砖红色洋红色绿色紫红色黄绿色顺德均安中学顺德均安中学2.在某溶液中酚酞呈红色。下列离子在该溶液中
不能大量存在的是 ( )
A.Fe3+ B.Na+ C.Ba2+ D.Al3+1.下列化合物与小苏打溶液反应,没有气体或沉淀生成的是
( )
A.烧碱 B.硫酸氢钠 C.氢氧化钡 D.过氧化钠
3.下列离子方程式书写正确的是 ( ) ( )
A.FeCl2溶液中通入Cl2:Fe2++Cl2→Fe3++2Cl-
B.Ba(OH) 2溶液与盐酸的反应 OH-+H+ = H2O
C.Al(OH) 3沉淀中滴加盐酸 Al(OH) 3+3H+ = Al3++3H2O
D. AlCl3溶液中加入过量氨水:Al3++4OH-→+2H2OAADBC练习
