第三章第二节几种重要的金属化合物(1)[上学期]
文档属性
| 名称 | 第三章第二节几种重要的金属化合物(1)[上学期] |  | |
| 格式 | rar | ||
| 文件大小 | 254.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2005-11-17 22:48:00 | ||
图片预览




文档简介
课件12张PPT。第三章 金属及其化合物第二节
几种重要金属的化合物(1)教学目标 1、了解金属氧化物的重要性质和用途。
2、了解 Fe(OH)2 、 Fe(OH)3 的制法和性质。
3、学会用实验探究的方法研究物质的性质。
重、难点
1、Al2O3的两性。
2、Fe(OH)2的制备方法和性质。科学视野:21世纪是钛的世纪 未来金属——钛
常温稳定,高温活泼。
金属单质有哪些物理性质和化学性质?
金属的物理性质:(共性)
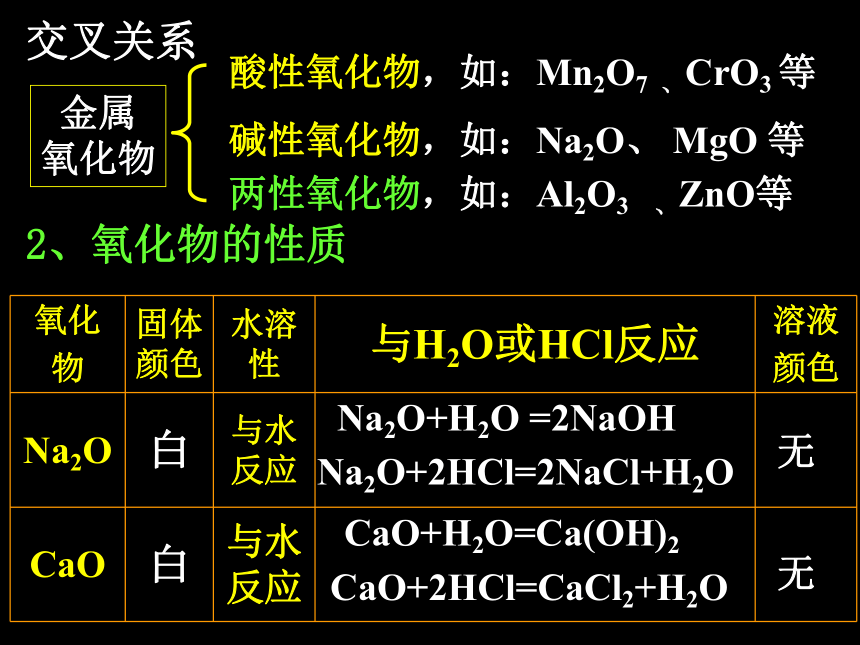
有金属光泽、易传热、易导电,有延展性、可塑性,常温下除汞以外都是固体 。 金属+H2O→金属氧化物+H2↑金属+O2→金属氧化物下面来讨论几种重要的金属化合物1、分类金属氧化物 非金属氧化物酸性氧化物碱性氧化物两性氧化物氧化物一、氧化物由两种元素组成,其中一种是氧元素的化合物成盐氧化物不成盐氧化物特殊氧化物如:CuO 、 MgO 、Na2O Al2O3 、Fe2O3、 FeO 等如:CO、 CO2 、NO2 SO3 、Cl2O7 、N2O5 等如:SO2、 CO2、 Cl2O7 等如:Na2O、 MgO、 CuO 等如:Al2O3 、ZnO等如:SO2、 Fe2O3、 Al2O3 等如:CO、 NO等如:Na2O2 、K2O等按组成分按性质分按性质分酸性氧化物,如:Mn2O7 、CrO3 等碱性氧化物,如:Na2O、 MgO 等两性氧化物,如:Al2O3 、ZnO等交叉关系金属
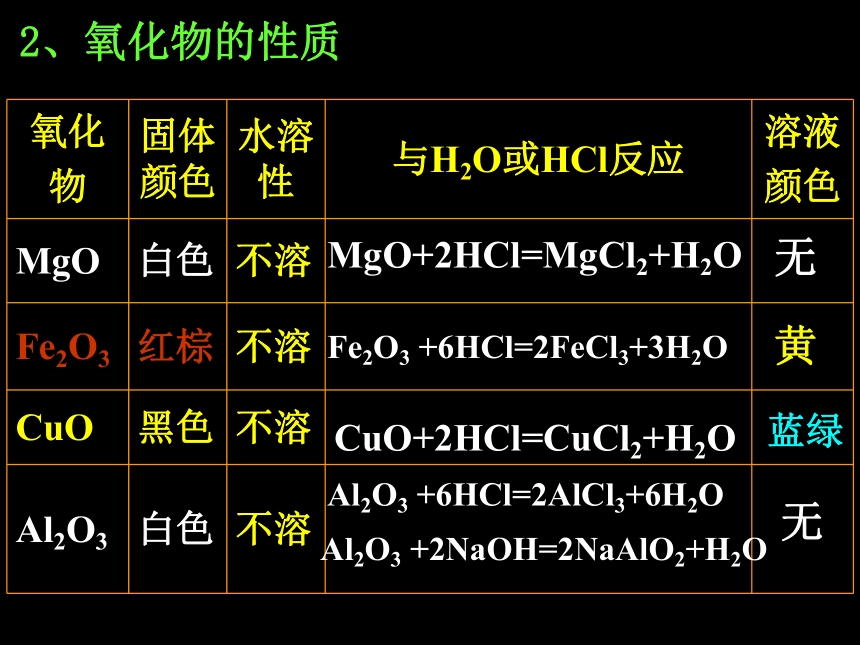
氧化物2、氧化物的性质Na2O+H2O =2NaOHNa2O+2HCl=2NaCl+H2OCaO+H2O=Ca(OH)2CaO+2HCl=CaCl2+H2O无无MgO+2HCl=MgCl2+H2OFe2O3 +6HCl=2FeCl3+3H2OCuO+2HCl=CuCl2+H2OAl2O3 +6HCl=2AlCl3+6H2OAl2O3 +2NaOH=2NaAlO2+H2O无无黄蓝绿2、氧化物的性质3、氧化物的性质 1)少数金属氧化物可溶于水,并与水化合如:Na2O、K2O、BaO、CaO等 2)大多数金属氧化物不溶于水,不能与水化合,但可与酸反应生成盐和水。如:MgO、CuO、Fe2O3、 FeO等 3)少数金属氧化物不溶于水,但既可与强酸反应又可与强碱溶液反应生成盐和水。如:Al2O3、ZnO等 既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物叫两性氧化物。碱性氧化物实验3-5MgO、CuO、Fe2O3、分别跟盐酸反应反应式??? 无色 棕黄色 蓝绿色 既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物叫两性氧化物。氧化铝的两性 Al2O3+2NaOH ==2NaAlO2+H2O
Al2O3+6HCl == 2AlCl3+3H2O
4、金属氧化物用途:主要作冶炼金属的原料,还有广泛的用途,如:Al2O3+2OH-==2AlO2-+H2OAl2O3+6H+ ==2Al3++3H2O 它们都是白色固体,但Na2O易跟H2O、CO2反应,不致密,不能保护内层金属;而Al2O3不能跟H2O、CO2反应,且很致密,能保护内层金属。47页学与问:二、氢氧化物1、铁的氢氧化物:Fe(OH)2、Fe(OH)34Fe(OH)2+O2+2H2O=4Fe(OH)3 1)制备:
FeCl3+3NaOH=3NaCl+Fe(OH)3↓(红褐色)
FeSO4+2NaOH=Na2SO4+Fe(OH)2↓(白色)
Fe3++3OH-=Fe(OH)3↓
Fe2++3OH-=Fe(OH)2↓ 2)氢氧化物的性质HCl+NaOH=NaOH+H2O2HCl+Ca(OH)2=CaCl2+2H2O2HCl+Cu(OH)2=CuCl2+2H2O2HCl+Fe(OH)2=FeCl2+2H2O3HCl+Fe(OH)3=FeCl3+3H2O48页学与问 氢氧化铁与氢氧化亚铁都是不溶性碱,你能写出它们与强酸反应的离子方程式吗?
Fe(OH)3+3H+=Fe3++3H2O
Fe(OH)2 + 2H+ = Fe2++ 2H2O
不溶性碱受热易分解:
2Fe(OH)3 = Fe2O3+3H2O
布置作业:
P.54 6△
几种重要金属的化合物(1)教学目标 1、了解金属氧化物的重要性质和用途。
2、了解 Fe(OH)2 、 Fe(OH)3 的制法和性质。
3、学会用实验探究的方法研究物质的性质。
重、难点
1、Al2O3的两性。
2、Fe(OH)2的制备方法和性质。科学视野:21世纪是钛的世纪 未来金属——钛
常温稳定,高温活泼。
金属单质有哪些物理性质和化学性质?
金属的物理性质:(共性)
有金属光泽、易传热、易导电,有延展性、可塑性,常温下除汞以外都是固体 。 金属+H2O→金属氧化物+H2↑金属+O2→金属氧化物下面来讨论几种重要的金属化合物1、分类金属氧化物 非金属氧化物酸性氧化物碱性氧化物两性氧化物氧化物一、氧化物由两种元素组成,其中一种是氧元素的化合物成盐氧化物不成盐氧化物特殊氧化物如:CuO 、 MgO 、Na2O Al2O3 、Fe2O3、 FeO 等如:CO、 CO2 、NO2 SO3 、Cl2O7 、N2O5 等如:SO2、 CO2、 Cl2O7 等如:Na2O、 MgO、 CuO 等如:Al2O3 、ZnO等如:SO2、 Fe2O3、 Al2O3 等如:CO、 NO等如:Na2O2 、K2O等按组成分按性质分按性质分酸性氧化物,如:Mn2O7 、CrO3 等碱性氧化物,如:Na2O、 MgO 等两性氧化物,如:Al2O3 、ZnO等交叉关系金属
氧化物2、氧化物的性质Na2O+H2O =2NaOHNa2O+2HCl=2NaCl+H2OCaO+H2O=Ca(OH)2CaO+2HCl=CaCl2+H2O无无MgO+2HCl=MgCl2+H2OFe2O3 +6HCl=2FeCl3+3H2OCuO+2HCl=CuCl2+H2OAl2O3 +6HCl=2AlCl3+6H2OAl2O3 +2NaOH=2NaAlO2+H2O无无黄蓝绿2、氧化物的性质3、氧化物的性质 1)少数金属氧化物可溶于水,并与水化合如:Na2O、K2O、BaO、CaO等 2)大多数金属氧化物不溶于水,不能与水化合,但可与酸反应生成盐和水。如:MgO、CuO、Fe2O3、 FeO等 3)少数金属氧化物不溶于水,但既可与强酸反应又可与强碱溶液反应生成盐和水。如:Al2O3、ZnO等 既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物叫两性氧化物。碱性氧化物实验3-5MgO、CuO、Fe2O3、分别跟盐酸反应反应式??? 无色 棕黄色 蓝绿色 既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物叫两性氧化物。氧化铝的两性 Al2O3+2NaOH ==2NaAlO2+H2O
Al2O3+6HCl == 2AlCl3+3H2O
4、金属氧化物用途:主要作冶炼金属的原料,还有广泛的用途,如:Al2O3+2OH-==2AlO2-+H2OAl2O3+6H+ ==2Al3++3H2O 它们都是白色固体,但Na2O易跟H2O、CO2反应,不致密,不能保护内层金属;而Al2O3不能跟H2O、CO2反应,且很致密,能保护内层金属。47页学与问:二、氢氧化物1、铁的氢氧化物:Fe(OH)2、Fe(OH)34Fe(OH)2+O2+2H2O=4Fe(OH)3 1)制备:
FeCl3+3NaOH=3NaCl+Fe(OH)3↓(红褐色)
FeSO4+2NaOH=Na2SO4+Fe(OH)2↓(白色)
Fe3++3OH-=Fe(OH)3↓
Fe2++3OH-=Fe(OH)2↓ 2)氢氧化物的性质HCl+NaOH=NaOH+H2O2HCl+Ca(OH)2=CaCl2+2H2O2HCl+Cu(OH)2=CuCl2+2H2O2HCl+Fe(OH)2=FeCl2+2H2O3HCl+Fe(OH)3=FeCl3+3H2O48页学与问 氢氧化铁与氢氧化亚铁都是不溶性碱,你能写出它们与强酸反应的离子方程式吗?
Fe(OH)3+3H+=Fe3++3H2O
Fe(OH)2 + 2H+ = Fe2++ 2H2O
不溶性碱受热易分解:
2Fe(OH)3 = Fe2O3+3H2O
布置作业:
P.54 6△
