第三章第二节几种重要的金属化合物[上学期]
文档属性
| 名称 | 第三章第二节几种重要的金属化合物[上学期] |  | |
| 格式 | rar | ||
| 文件大小 | 107.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2005-12-02 11:27:00 | ||
图片预览











文档简介
课件35张PPT。多媒体课堂化 学 多 媒 体 课 堂2 几种重要的
金属化合物南海艺术高中自然科组为什么金属元素在自然界中绝大多以化合态存在?一、氧化物1、金属氧化物的存在:
金属氧化物在自然界中常以矿物的形式存在,如Al2O3存在在矿物叫铝土矿;Fe2O3存在的矿物叫赤铁矿。
2、金属氧化物在水中的溶解性:
多数金属氧化物不溶于水,少数金属氧化物能跟水反应而溶解。(1)跟水反应:金属活动性顺序表中Al 之前的金属的氧化物能跟水反应,生成可溶或微溶的碱。
写出下列金属氧化物跟水反应的化学方程式Na2O CaO MgO
Na2O + H2O = 2NaOH
CaO + H2O = 2Ca(OH)2
MgO + H2O = 2Mg(OH)2
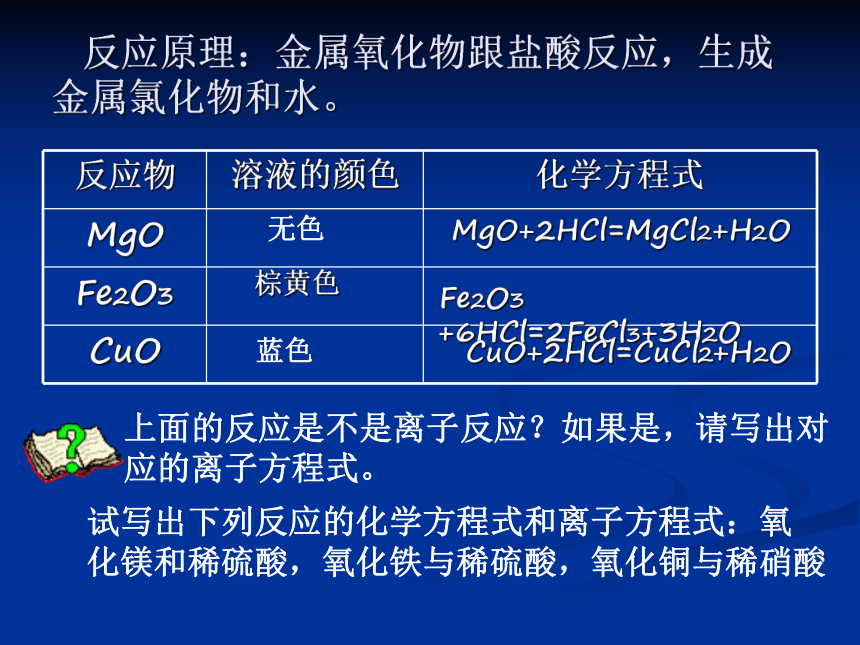
3、金属氧化物的化学性质:(2)跟酸反应三种金属氧化物的颜色:
实验现象:
氧化镁:白色粉末溶解,得到无色溶液;
氧化铁:红色粉末溶解,得到棕黄色溶液;
氧化铜:黑色粉末溶解,得到蓝色溶液;演示实验3-5:在三支分别装有氧化镁、氧化铁、
氧化铜粉末的试管中加入盐酸,振荡,观察现象。 反应原理:金属氧化物跟盐酸反应,生成金属氯化物和水。无色棕黄色MgO+2HCl=MgCl2+H2OFe2O3 +6HCl=2FeCl3+3H2OCuO+2HCl=CuCl2+H2O蓝色上面的反应是不是离子反应?如果是,请写出对应的离子方程式。试写出下列反应的化学方程式和离子方程式:氧
化镁和稀硫酸,氧化铁与稀硫酸,氧化铜与稀硝酸(3)Al2O3的特性补充实验:将两块铝箔分别放入盛有稀硫酸和稀NaOH溶液的小烧杯中。
实验现象:开始一段时间无明显现象,但过一会儿两烧杯都有气泡产生。
反应原理:铝箔的表面有一层氧化膜,成分为氧化铝,当加入稀硫酸和稀NaOH溶液后,氧化铝先溶解,其溶解过程没明显的现象 ,当氧化铝溶解后,内部的金属铝继续跟稀硫酸和稀 NaOH溶液反应,生成氢气。(两性氧化物)
Al2O3 +3H2SO4=2Al2(SO4)3+3H2O
Al2O3 +2NaOH = 2NaAlO2+H2O(4)金属氧化物的用途金属氧化物可作为冶炼金属的原料,如氧化铁用于冶炼铁,氧化铝用于冶炼铝,氧化铬用于冶炼铬。
氧化铁是一种红棕色的粉末,俗称铁红,常用于制造红色油漆和涂料。
氧化铝是一种白色难熔的物质,是一种较好的耐火材料,常用于制造耐火坩埚和耐火管等。
氧化铜呈黑色,可作为制造铜盐的原料
氧化亚铜(Cu2O)呈红色,可作为制造玻璃、搪瓷的红色颜料。P47 学与问:钠表面的氧化膜和铝的氧化膜都是金属氧化膜,它们的外观形态相似,但性质差别较大,Na2O能跟水、酸反应,而Al2O3 不能跟水反应,但能跟酸和强碱溶液反应。
它们对内层金属的保护作用不一样,钠的氧化膜不能保护内层的钠,而铝的氧化膜能保护内层有铝。二、氢氧化物指示剂:能使酸碱指示剂变色。
与酸反应:发生中和反应,生成盐和水。
写出下列反应的化学方程式
NaOH与H2SO4
澄清石灰水和盐酸
Ba(OH)2和H2SO4
1、碱的溶解性:
常见可溶性的碱有NaOH、KOH、Ba(OH)2、氨水(NH3·H2O)
微溶性的碱有Ca(OH)2;其它如Fe(OH)3、Mg(OH)2、
Cu(OH)2、Al(OH)3、Fe(OH)2等都是难溶的,但都可溶于酸中。2、碱的化学性质:与某些非金属氧化物反应,生成盐和水。
写出下列反应的化学方程式:
NaOH 与 CO2
Ba(OH)2 与 CO2
KOH溶液 与 SO2
3、铁的氢氧化物的制备和性质
(1)Fe(OH)3 和Fe(OH)2的制备演示实验3-6:在两支试管里分别加入少量的FeCl3和FeSO4溶液然后滴入NaOH溶液,观察现象。实验现象:向FeCl3溶液中滴加NaOH 溶液立即产生红褐色的沉淀;向FeSO4溶液中滴加NaOH 溶液后,先产生灰白色沉淀,然后迅速变为灰绿色,最后变为红褐色。
反应原理:
FeCl3+3NaOH =3NaCl +Fe(OH)3↓(红褐色)
FeSO4+2NaOH =Na2 SO4+Fe(OH)2↓(白色)
Fe(OH)2(白色)+O2+2H2O=4Fe(OH)3(红褐色)
说明:其它可溶性三价铁盐、可溶性亚铁盐都可跟可溶性碱分别生成Fe(OH)3和Fe(OH)2。
思考:若要使制得的Fe(OH)2不变色,应采取什么措施?
(1)Fe(OH)3 和Fe(OH)2的性质P48学与问: (1)Fe(OH)3 和Fe(OH)2都是难溶性弱碱,跟指示剂作用现象不明显,也不跟非金属氧化物反应,那么如何体现它的碱性呢?
可考虑中和反应,跟酸反应生成相对应的铁盐和水。
写出下列反应的化学方程式和离子方程式
Fe(OH)2和盐酸
Fe(OH)2和稀硫酸
Fe(OH)3和稀硫酸
(2)难溶性碱的共性——受热分解
加热Fe(OH)3时,它能失去水生成红棕色的
Fe2O3粉末,化学方程式为_________
基本规律:难溶性碱受热分解失去水,同时生成相应价态的金属氧化物.
写出下列难溶性碱受热分解的化学方程式:
Cu(OH)2 _____________________
Mg(OH)2 _____________________
AgOH _____________________ 2AgOH =AgO+H2O4、氢氧化铝的制取和性质实验现象:生成白色胶状沉淀。
反应原理:
Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4
Al3+ +3NH3·H2O= Al(OH)3↓+ 3NH4+
说明:其它可溶性铝盐溶液都可以跟氨水反应制备Al(OH)3
(1)氢氧化铝的制备演示实验3-7 在试管中加入10ml 0.5mol/L
Al2(SO4)3溶液,再滴加氨水至不再产生沉淀.实验现象:两支试管中的氢氧化铝沉淀都溶解了。
实验结论: Al(OH)3在酸或强碱溶液里都能溶解,这说明Al(OH)3既能和酸反应,又能跟强碱溶液起反应,我们称它为两性氢氧化物。(2)氢氧化铝的性质演示实验3-8:取一些上面实验中制得的氢
氧化铝沉淀,分别装在2支试管里,往一支试
管里滴加2mol/L盐酸,另一支试管里滴加2mol/L
NaOH溶液,边加边振荡。反应原理:
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+3H+=Al3++3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
Al(OH)3+OH-=AlO2-+2H2O
思考1:为什么实验室制取Al(OH)3用可溶性铝盐溶液跟氨水反应制备Al(OH)3而不用NaOH?
思考2:由上面学到的难溶性碱的共性,可看出Al(OH)3还有什么性质?(2)氢氧化铝的用途Al(OH)3是一种胶状物质,能凝聚水中的悬浮物,并能吸咐色素。因此生活和生产中常用明矾净水,明矾溶于水后能跟水作用生成Al(OH)3胶体,凝聚水中的悬浮物一同沉降,起到净水作用。(见课本P51资料卡片)
Al(OH)3能跟酸发生中和反应,可用作医用的胃酸中和剂,原因是它的碱性不强,不至于对胃壁产生强烈的剌激或腐蚀作用,但可以跟胃酸反应,使胃液的酸度降低,起到了中和过多胃酸的作用。三、盐俗名:Na2CO3----- 纯碱、苏打
NaHCO3------小苏打
性质:
(1)在水中的溶解性
(2)热稳定性
(3)其它化学性质1、碳酸钠和碳酸氢钠科学探究:碳酸钠和碳酸氢钠的性质(1)Na2CO3和NaHCO3在水中的溶解性123白色粉末,加水后结为晶体,用手摸试管底感觉温热白色细小晶体,加水
后变为糊状,用手摸
试管底不热晶体溶解,得到无色溶液晶体没有完全溶解溶液显红色溶液显浅红色实验初步结论:Na2CO3粉末遇少量的水生成含有结晶水的碳酸钠晶体,同时放出热量,使温度升高,而NaHCO3遇水不能形成晶体,没有放出热量.
Na2CO3溶解性在相同条件下比NaHCO3的溶解性大.
Na2CO3和NaHCO3溶液都显碱性,但Na2CO3溶液的碱性强于NaHCO3溶液,它们属于盐类,不属于碱类,因此被用作食用碱.(2)Na2CO3和NaHCO3的热稳定性受热后,澄清
石灰水未变浑
浊Na2CO3受热不
分解,说明
Na2CO3热稳定
性很强受热后,澄清
石灰水变浑浊,
在试管口处有
无色液体生成.NaHCO3受热
发生分解,说明
NaHCO3热稳
定性弱(3)Na2CO3和NaHCO3的其它化学性质跟盐酸反应:
Na2CO3 + 2HCl = 2NaCl +H2O +CO2 ↑
NaHCO3 + HCl = NaCl +H2O +CO2 ↑
与CaCl2溶液反应:已知Na2CO3溶液跟CaCl2溶液混合立即产生白色沉淀,但NaHCO3 跟CaCl2溶液相混没明显现象,试解释以上现象,并写出有关的化学方程式.
与Ca(OH)2的反应:都产生了白色的沉淀
相互转变: 2NaHCO3 = Na2CO3 + H2O + CO2 ↑
NaHCO3 + NaOH = Na2CO3 + H2O
Na2CO3 + CO2 + H2O = 2NaHCO3
怎样鉴别碳酸钠和碳酸氢钠? ⑴ 加热固体。产生能使石灰水变浑浊的无色气体
的是碳酸氢钠。2NaHCO3 = Na2CO3 + H2O + CO2△ ⑶ 在固体中加入相同浓度的盐酸,
反应剧烈的是碳酸氢钠。Na2CO3 + CaCl2 = 2NaCl + CaCO3 ⑵ 溶解,加入氯化钙溶液,产生沉淀的是碳酸钠。2、三价铁的氧化性科学探究一:铁盐和亚铁盐的一些性质(1)Fe3+的检验溶液立即变为血红色(不是沉淀)溶液无明显变化这一反应是Fe3+特有的,利用这一反应可
检验Fe3+的存在。
反应实质是Fe3+和SCN-发生反应。Fe3+具有较强的氧化性,能将Fe氧化为Fe2+,而本身被还原为Fe2+
Fe2+具有较强的还原性,能被氯气氧化为Fe3+
Fe2+ Fe3+(2)Fe3+的氧化性溶液未变血红色溶液变为血红色Cl2等较强的氧化剂Fe等较强的还原剂思考:如何确定溶液中含有Fe2+?设计思维: Fe2+没有特征检验方法,需借助Fe3+的检验方法,但实验要排除Fe3+的干扰。
检验方法:先向未知溶液中加入KSCN溶液,若不变色,再向溶液中滴加氯水,若溶液变为血红色,则确定未知溶液中含有Fe2+。科学探究二:铝盐和铁盐的净水作用(1)生活常识:当生活用水浑浊时,人们就会向水缸
加入少量的明矾,搅拌,过一段时间,在水缸底部会出
现很多絮状不溶物,而水却变得澄清了。(2)Al3+、Fe3+的净水实验 浑浊上部少量澄清,
其它部份仍浑浊上部澄清,中下
部出现絮状不溶物上部澄清,中下
部出现絮状不溶物完全变澄清,底部
有絮状不溶物完全变澄清,底部
有絮状不溶物3、焰色反应 多种金属用它们的化合物在燃烧或灼烧时呈现特殊的
颜色,这在化学上叫焰色反应.演示实验3-9:金属的焰色反应实验步骤:洗、烧、蘸、烧、观
钠和钾的焰色反应的颜色:
钠:黄色; 钾:紫色(透过蓝色钴玻璃)
讨论:焰色反应是金属或它们的化合物的化学性质吗?
应用:节日燃放的五彩缤纷的烟花,化学实验中用于鉴别某些离子的存在。 小结:物质结构和性质关系常见的金属氧化物都是碱性氧化物,都能跟酸反应
金属氢氧化物在水中都能电离出OH-,都能跟酸反应,可溶性碱除了跟酸反应外,还能跟指示剂、非金属氧化物反应等
Na2CO3和NaHCO3组成中都含有CO32-,都能跟盐酸反应产生CO2气体,跟Ca(OH)2产生沉淀
Al3+和Fe3+都带有三个正电荷,电荷数较多,常温下都能跟水作用生成氢氧化物的胶状物质而净水。(1)结构相似,必然性质相似(2)结构不同,性质不同金属表面氧化膜有的疏松,不能保护内层金属,如钠、铁等氧化膜,有的致密,可以保护内层金属不被继续氧化,如镁、铝的氧化膜。
铝的氧化物、氢氧化物具有两性,即既能跟酸反应,又能跟碱反应,这与铝元素既表现一定金属性,又表现一定的非金属性有关系,而钠、镁、铁等金属元素只表现金属性。Na2CO3和NaHCO3在组成上不同,即CO32-和HCO3-组成不同,表现在性质上也不同,如CaCO3是难溶的,而Ca(HCO3)2是可溶的;Na2CO3能与CaCl2产生沉淀,而NaHCO3不能与CaCl2反应;NaHCO3受热易分解,Na2CO3热稳定性很强等.
Fe3+与Fe2+所带的电荷不同,性质差别较大,如Fe3+具有较强的氧化性,而Fe2+有较强的还原性,Fe(OH)3呈红褐色,而Fe(OH)3呈灰白色,在空气中迅速变为灰绿色,最后变为红褐色,Fe3+遇KSCN溶液变为血红色,而Fe2+遇KSCN溶液不变色.
总之,物质的性质是由物质的结构决定的.NaNa2ONaOHNa2O2Na2CO3NaHCO3NaCl钠及其化合物之间的相互转化关系O2CO2H2OO2 点燃CO2Ca(OH)2CO2(少量)NaOH或加热CO2过量HClHClCl2点燃1.下列钠的化合物的用途,各利用了他们的什么性质?
用碳酸氢钠、氧化镁、和碳酸钙制成的药片治疗胃酸过多;_____________
实验时若不慎将酸液洒落桌面上,可用碳酸氢钠处理;____________
干粉灭火器里装有90%以上的碳酸氢钠用于灭火。
________________
练习:2.配置氯化亚铁溶液时,常加入一些___,目的是___,配置氯化铁溶液时,需加入少量___ ,目的是____。 3.除去氯化铁溶液中混有少量氯化亚铁,试剂为_____ ;除去氯化亚铁溶液中混有的少量氯化铁,试剂为____.
金属化合物南海艺术高中自然科组为什么金属元素在自然界中绝大多以化合态存在?一、氧化物1、金属氧化物的存在:
金属氧化物在自然界中常以矿物的形式存在,如Al2O3存在在矿物叫铝土矿;Fe2O3存在的矿物叫赤铁矿。
2、金属氧化物在水中的溶解性:
多数金属氧化物不溶于水,少数金属氧化物能跟水反应而溶解。(1)跟水反应:金属活动性顺序表中Al 之前的金属的氧化物能跟水反应,生成可溶或微溶的碱。
写出下列金属氧化物跟水反应的化学方程式Na2O CaO MgO
Na2O + H2O = 2NaOH
CaO + H2O = 2Ca(OH)2
MgO + H2O = 2Mg(OH)2
3、金属氧化物的化学性质:(2)跟酸反应三种金属氧化物的颜色:
实验现象:
氧化镁:白色粉末溶解,得到无色溶液;
氧化铁:红色粉末溶解,得到棕黄色溶液;
氧化铜:黑色粉末溶解,得到蓝色溶液;演示实验3-5:在三支分别装有氧化镁、氧化铁、
氧化铜粉末的试管中加入盐酸,振荡,观察现象。 反应原理:金属氧化物跟盐酸反应,生成金属氯化物和水。无色棕黄色MgO+2HCl=MgCl2+H2OFe2O3 +6HCl=2FeCl3+3H2OCuO+2HCl=CuCl2+H2O蓝色上面的反应是不是离子反应?如果是,请写出对应的离子方程式。试写出下列反应的化学方程式和离子方程式:氧
化镁和稀硫酸,氧化铁与稀硫酸,氧化铜与稀硝酸(3)Al2O3的特性补充实验:将两块铝箔分别放入盛有稀硫酸和稀NaOH溶液的小烧杯中。
实验现象:开始一段时间无明显现象,但过一会儿两烧杯都有气泡产生。
反应原理:铝箔的表面有一层氧化膜,成分为氧化铝,当加入稀硫酸和稀NaOH溶液后,氧化铝先溶解,其溶解过程没明显的现象 ,当氧化铝溶解后,内部的金属铝继续跟稀硫酸和稀 NaOH溶液反应,生成氢气。(两性氧化物)
Al2O3 +3H2SO4=2Al2(SO4)3+3H2O
Al2O3 +2NaOH = 2NaAlO2+H2O(4)金属氧化物的用途金属氧化物可作为冶炼金属的原料,如氧化铁用于冶炼铁,氧化铝用于冶炼铝,氧化铬用于冶炼铬。
氧化铁是一种红棕色的粉末,俗称铁红,常用于制造红色油漆和涂料。
氧化铝是一种白色难熔的物质,是一种较好的耐火材料,常用于制造耐火坩埚和耐火管等。
氧化铜呈黑色,可作为制造铜盐的原料
氧化亚铜(Cu2O)呈红色,可作为制造玻璃、搪瓷的红色颜料。P47 学与问:钠表面的氧化膜和铝的氧化膜都是金属氧化膜,它们的外观形态相似,但性质差别较大,Na2O能跟水、酸反应,而Al2O3 不能跟水反应,但能跟酸和强碱溶液反应。
它们对内层金属的保护作用不一样,钠的氧化膜不能保护内层的钠,而铝的氧化膜能保护内层有铝。二、氢氧化物指示剂:能使酸碱指示剂变色。
与酸反应:发生中和反应,生成盐和水。
写出下列反应的化学方程式
NaOH与H2SO4
澄清石灰水和盐酸
Ba(OH)2和H2SO4
1、碱的溶解性:
常见可溶性的碱有NaOH、KOH、Ba(OH)2、氨水(NH3·H2O)
微溶性的碱有Ca(OH)2;其它如Fe(OH)3、Mg(OH)2、
Cu(OH)2、Al(OH)3、Fe(OH)2等都是难溶的,但都可溶于酸中。2、碱的化学性质:与某些非金属氧化物反应,生成盐和水。
写出下列反应的化学方程式:
NaOH 与 CO2
Ba(OH)2 与 CO2
KOH溶液 与 SO2
3、铁的氢氧化物的制备和性质
(1)Fe(OH)3 和Fe(OH)2的制备演示实验3-6:在两支试管里分别加入少量的FeCl3和FeSO4溶液然后滴入NaOH溶液,观察现象。实验现象:向FeCl3溶液中滴加NaOH 溶液立即产生红褐色的沉淀;向FeSO4溶液中滴加NaOH 溶液后,先产生灰白色沉淀,然后迅速变为灰绿色,最后变为红褐色。
反应原理:
FeCl3+3NaOH =3NaCl +Fe(OH)3↓(红褐色)
FeSO4+2NaOH =Na2 SO4+Fe(OH)2↓(白色)
Fe(OH)2(白色)+O2+2H2O=4Fe(OH)3(红褐色)
说明:其它可溶性三价铁盐、可溶性亚铁盐都可跟可溶性碱分别生成Fe(OH)3和Fe(OH)2。
思考:若要使制得的Fe(OH)2不变色,应采取什么措施?
(1)Fe(OH)3 和Fe(OH)2的性质P48学与问: (1)Fe(OH)3 和Fe(OH)2都是难溶性弱碱,跟指示剂作用现象不明显,也不跟非金属氧化物反应,那么如何体现它的碱性呢?
可考虑中和反应,跟酸反应生成相对应的铁盐和水。
写出下列反应的化学方程式和离子方程式
Fe(OH)2和盐酸
Fe(OH)2和稀硫酸
Fe(OH)3和稀硫酸
(2)难溶性碱的共性——受热分解
加热Fe(OH)3时,它能失去水生成红棕色的
Fe2O3粉末,化学方程式为_________
基本规律:难溶性碱受热分解失去水,同时生成相应价态的金属氧化物.
写出下列难溶性碱受热分解的化学方程式:
Cu(OH)2 _____________________
Mg(OH)2 _____________________
AgOH _____________________ 2AgOH =AgO+H2O4、氢氧化铝的制取和性质实验现象:生成白色胶状沉淀。
反应原理:
Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4
Al3+ +3NH3·H2O= Al(OH)3↓+ 3NH4+
说明:其它可溶性铝盐溶液都可以跟氨水反应制备Al(OH)3
(1)氢氧化铝的制备演示实验3-7 在试管中加入10ml 0.5mol/L
Al2(SO4)3溶液,再滴加氨水至不再产生沉淀.实验现象:两支试管中的氢氧化铝沉淀都溶解了。
实验结论: Al(OH)3在酸或强碱溶液里都能溶解,这说明Al(OH)3既能和酸反应,又能跟强碱溶液起反应,我们称它为两性氢氧化物。(2)氢氧化铝的性质演示实验3-8:取一些上面实验中制得的氢
氧化铝沉淀,分别装在2支试管里,往一支试
管里滴加2mol/L盐酸,另一支试管里滴加2mol/L
NaOH溶液,边加边振荡。反应原理:
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+3H+=Al3++3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
Al(OH)3+OH-=AlO2-+2H2O
思考1:为什么实验室制取Al(OH)3用可溶性铝盐溶液跟氨水反应制备Al(OH)3而不用NaOH?
思考2:由上面学到的难溶性碱的共性,可看出Al(OH)3还有什么性质?(2)氢氧化铝的用途Al(OH)3是一种胶状物质,能凝聚水中的悬浮物,并能吸咐色素。因此生活和生产中常用明矾净水,明矾溶于水后能跟水作用生成Al(OH)3胶体,凝聚水中的悬浮物一同沉降,起到净水作用。(见课本P51资料卡片)
Al(OH)3能跟酸发生中和反应,可用作医用的胃酸中和剂,原因是它的碱性不强,不至于对胃壁产生强烈的剌激或腐蚀作用,但可以跟胃酸反应,使胃液的酸度降低,起到了中和过多胃酸的作用。三、盐俗名:Na2CO3----- 纯碱、苏打
NaHCO3------小苏打
性质:
(1)在水中的溶解性
(2)热稳定性
(3)其它化学性质1、碳酸钠和碳酸氢钠科学探究:碳酸钠和碳酸氢钠的性质(1)Na2CO3和NaHCO3在水中的溶解性123白色粉末,加水后结为晶体,用手摸试管底感觉温热白色细小晶体,加水
后变为糊状,用手摸
试管底不热晶体溶解,得到无色溶液晶体没有完全溶解溶液显红色溶液显浅红色实验初步结论:Na2CO3粉末遇少量的水生成含有结晶水的碳酸钠晶体,同时放出热量,使温度升高,而NaHCO3遇水不能形成晶体,没有放出热量.
Na2CO3溶解性在相同条件下比NaHCO3的溶解性大.
Na2CO3和NaHCO3溶液都显碱性,但Na2CO3溶液的碱性强于NaHCO3溶液,它们属于盐类,不属于碱类,因此被用作食用碱.(2)Na2CO3和NaHCO3的热稳定性受热后,澄清
石灰水未变浑
浊Na2CO3受热不
分解,说明
Na2CO3热稳定
性很强受热后,澄清
石灰水变浑浊,
在试管口处有
无色液体生成.NaHCO3受热
发生分解,说明
NaHCO3热稳
定性弱(3)Na2CO3和NaHCO3的其它化学性质跟盐酸反应:
Na2CO3 + 2HCl = 2NaCl +H2O +CO2 ↑
NaHCO3 + HCl = NaCl +H2O +CO2 ↑
与CaCl2溶液反应:已知Na2CO3溶液跟CaCl2溶液混合立即产生白色沉淀,但NaHCO3 跟CaCl2溶液相混没明显现象,试解释以上现象,并写出有关的化学方程式.
与Ca(OH)2的反应:都产生了白色的沉淀
相互转变: 2NaHCO3 = Na2CO3 + H2O + CO2 ↑
NaHCO3 + NaOH = Na2CO3 + H2O
Na2CO3 + CO2 + H2O = 2NaHCO3
怎样鉴别碳酸钠和碳酸氢钠? ⑴ 加热固体。产生能使石灰水变浑浊的无色气体
的是碳酸氢钠。2NaHCO3 = Na2CO3 + H2O + CO2△ ⑶ 在固体中加入相同浓度的盐酸,
反应剧烈的是碳酸氢钠。Na2CO3 + CaCl2 = 2NaCl + CaCO3 ⑵ 溶解,加入氯化钙溶液,产生沉淀的是碳酸钠。2、三价铁的氧化性科学探究一:铁盐和亚铁盐的一些性质(1)Fe3+的检验溶液立即变为血红色(不是沉淀)溶液无明显变化这一反应是Fe3+特有的,利用这一反应可
检验Fe3+的存在。
反应实质是Fe3+和SCN-发生反应。Fe3+具有较强的氧化性,能将Fe氧化为Fe2+,而本身被还原为Fe2+
Fe2+具有较强的还原性,能被氯气氧化为Fe3+
Fe2+ Fe3+(2)Fe3+的氧化性溶液未变血红色溶液变为血红色Cl2等较强的氧化剂Fe等较强的还原剂思考:如何确定溶液中含有Fe2+?设计思维: Fe2+没有特征检验方法,需借助Fe3+的检验方法,但实验要排除Fe3+的干扰。
检验方法:先向未知溶液中加入KSCN溶液,若不变色,再向溶液中滴加氯水,若溶液变为血红色,则确定未知溶液中含有Fe2+。科学探究二:铝盐和铁盐的净水作用(1)生活常识:当生活用水浑浊时,人们就会向水缸
加入少量的明矾,搅拌,过一段时间,在水缸底部会出
现很多絮状不溶物,而水却变得澄清了。(2)Al3+、Fe3+的净水实验 浑浊上部少量澄清,
其它部份仍浑浊上部澄清,中下
部出现絮状不溶物上部澄清,中下
部出现絮状不溶物完全变澄清,底部
有絮状不溶物完全变澄清,底部
有絮状不溶物3、焰色反应 多种金属用它们的化合物在燃烧或灼烧时呈现特殊的
颜色,这在化学上叫焰色反应.演示实验3-9:金属的焰色反应实验步骤:洗、烧、蘸、烧、观
钠和钾的焰色反应的颜色:
钠:黄色; 钾:紫色(透过蓝色钴玻璃)
讨论:焰色反应是金属或它们的化合物的化学性质吗?
应用:节日燃放的五彩缤纷的烟花,化学实验中用于鉴别某些离子的存在。 小结:物质结构和性质关系常见的金属氧化物都是碱性氧化物,都能跟酸反应
金属氢氧化物在水中都能电离出OH-,都能跟酸反应,可溶性碱除了跟酸反应外,还能跟指示剂、非金属氧化物反应等
Na2CO3和NaHCO3组成中都含有CO32-,都能跟盐酸反应产生CO2气体,跟Ca(OH)2产生沉淀
Al3+和Fe3+都带有三个正电荷,电荷数较多,常温下都能跟水作用生成氢氧化物的胶状物质而净水。(1)结构相似,必然性质相似(2)结构不同,性质不同金属表面氧化膜有的疏松,不能保护内层金属,如钠、铁等氧化膜,有的致密,可以保护内层金属不被继续氧化,如镁、铝的氧化膜。
铝的氧化物、氢氧化物具有两性,即既能跟酸反应,又能跟碱反应,这与铝元素既表现一定金属性,又表现一定的非金属性有关系,而钠、镁、铁等金属元素只表现金属性。Na2CO3和NaHCO3在组成上不同,即CO32-和HCO3-组成不同,表现在性质上也不同,如CaCO3是难溶的,而Ca(HCO3)2是可溶的;Na2CO3能与CaCl2产生沉淀,而NaHCO3不能与CaCl2反应;NaHCO3受热易分解,Na2CO3热稳定性很强等.
Fe3+与Fe2+所带的电荷不同,性质差别较大,如Fe3+具有较强的氧化性,而Fe2+有较强的还原性,Fe(OH)3呈红褐色,而Fe(OH)3呈灰白色,在空气中迅速变为灰绿色,最后变为红褐色,Fe3+遇KSCN溶液变为血红色,而Fe2+遇KSCN溶液不变色.
总之,物质的性质是由物质的结构决定的.NaNa2ONaOHNa2O2Na2CO3NaHCO3NaCl钠及其化合物之间的相互转化关系O2CO2H2OO2 点燃CO2Ca(OH)2CO2(少量)NaOH或加热CO2过量HClHClCl2点燃1.下列钠的化合物的用途,各利用了他们的什么性质?
用碳酸氢钠、氧化镁、和碳酸钙制成的药片治疗胃酸过多;_____________
实验时若不慎将酸液洒落桌面上,可用碳酸氢钠处理;____________
干粉灭火器里装有90%以上的碳酸氢钠用于灭火。
________________
练习:2.配置氯化亚铁溶液时,常加入一些___,目的是___,配置氯化铁溶液时,需加入少量___ ,目的是____。 3.除去氯化铁溶液中混有少量氯化亚铁,试剂为_____ ;除去氯化亚铁溶液中混有的少量氯化铁,试剂为____.
