几种重要的金属化合物(陆月勤)[上学期]
文档属性
| 名称 | 几种重要的金属化合物(陆月勤)[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 649.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2005-12-29 00:00:00 | ||
图片预览










文档简介
课件42张PPT。第二节 几种重要的金属化合物
江海中学
陆月勤
2005.11(补:训练《优化全析》98页2、4、6、7、11)一、氧化物:
思考:1、哪些金属氧化物能与水反应生成相应的
碱?哪些金属氧化物不能与水反应生成相应的碱?
你发现有何规律吗?
K2O、CaO、BaO、Na2O能与水反应生成相应的碱,
MgO与水反应缓慢反应生成Mg(OH)2
Al2O3、Fe2O3、CuO不能与水反应生成相应的碱
规律:可溶或微溶的强碱对应的氧化物可与水
反应,难溶的弱碱对应的氧化物不与水反应。
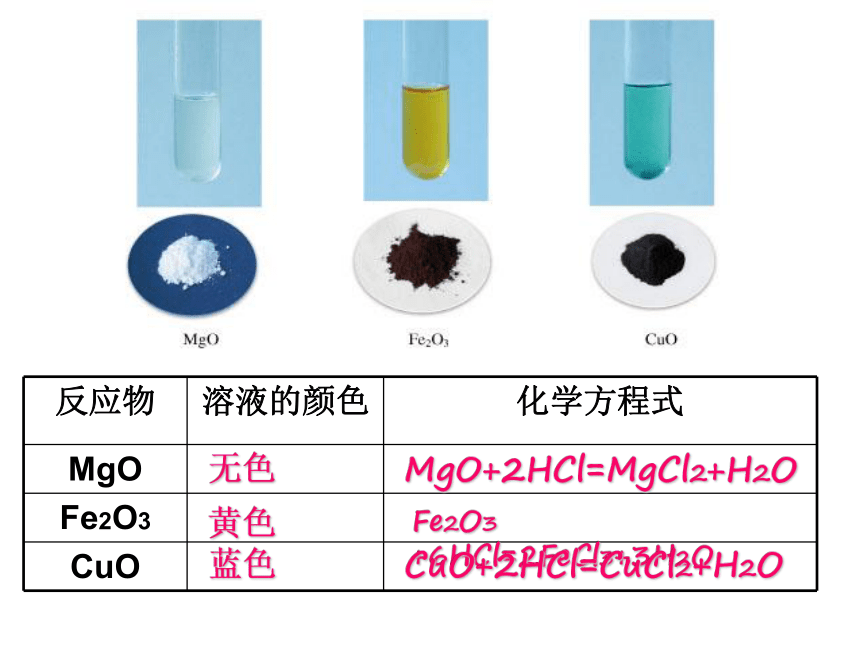
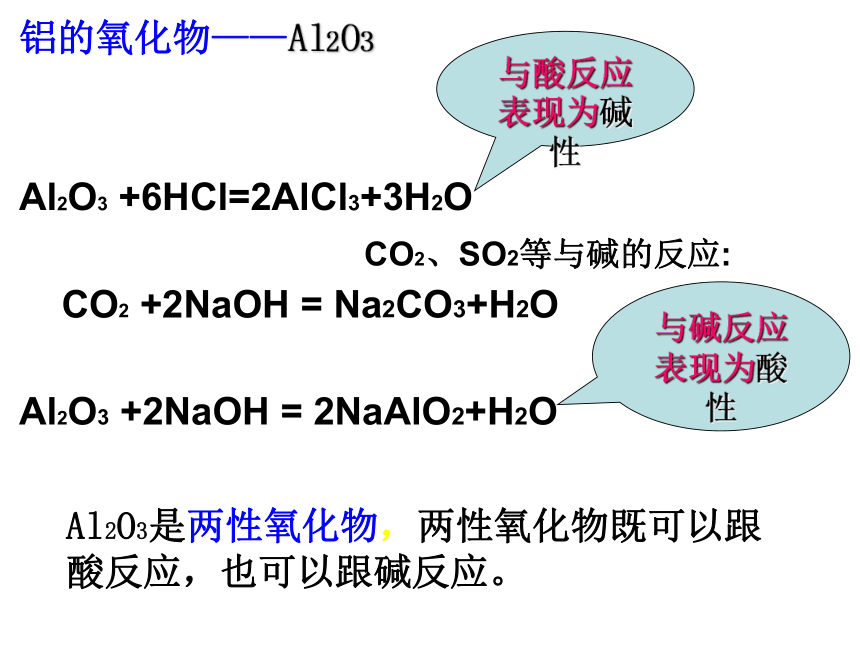
无色黄色MgO+2HCl=MgCl2+H2OFe2O3 +6HCl=2FeCl3+3H2OCuO+2HCl=CuCl2+H2O蓝色铝的氧化物——Al2O3Al2O3 +6HCl=2AlCl3+3H2O
回顾:酸性氧化物CO2、SO2等与碱的反应:
CO2 +2NaOH = Na2CO3+H2O
碳酸钠
Al2O3 +2NaOH = 2NaAlO2+H2O偏铝酸钠Al2O3是两性氧化物,两性氧化物既可以跟酸反应,也可以跟碱反应。与酸反应表现为碱性与碱反应表现为酸性2、两性氧化物指既能与 反应只生成盐和水,
又能与 反应只生成盐和水的氧化物。
分别写出Al2O3与HCl、NaOH溶液反应的离子
方程式。
?
酸碱Al2O3+6H+== 2Al3++3H2O
Al2O3+2OH-== 2AlO2-+H2O
3、金属氧化物一定是碱性氧化物吗?
碱性氧化物一定是金属氧化物吗?
金属氧化物不一定是碱性氧化物(如Al2O3
是两性氧化物,Mn2O7是酸性氧化物),碱性
氧化物一定是金属氧化物。 “学与问”:钠表面的氧化物和铝的氧化膜都是
金属氧化物,它们的外观形态和性质相同吗?
对内层金属的保护作用一样吗?
Na2O、Al2O3都是白色固体,但附在银白色的金属
钠或铝上均显暗灰色。化学性质不同:(1)Na2O
能溶于水生成NaOH。Al2O3不溶于水,与水不反
应。(2)Na2O能与酸反应,Al2O3既能与酸反应,
又能与强碱反应。Na2O疏松,对内层金属不起保护作用,而在空气
中Al表面的Al2O3是致密的薄层,对内层铝有很好
的保护作用。 1、金属氧化物在自然界中常以 的形式存在。铝土矿Al2O3赤铁矿Fe2O3矿物资料卡片常见的还有磁铁矿Fe3O4金属氧化物可作为冶炼金属的原料,如氧化铁用于冶炼铁,氧化铝用于冶炼铝。
氧化铁俗称铁红,常用于制造红色油漆和涂料。
氧化铝是一种白色难熔的物质,是一种较好的耐火材料,常用于制造耐火坩埚和耐火管等。资料卡片:金属氧化物的用途氧化铜呈黑色,可作为制造铜盐的原料
氧化亚铜(Cu2O)呈红色,可作为制造玻璃、搪瓷的红色颜料。资料卡片:金属氧化物的用途用Fe2O3制成的红棕色涂料含有Cu2O的红色玻璃用耐高温的Al2O3制成的坩埚用耐磨的Al2O3做成的轴承 小结:多数金属氧化物不溶于水;
少数金属氧化物能跟水反应生成碱。Na2O + H2O = 2NaOH
CaO + H2O = Ca(OH)2
K2O + H2O = 2KOH 金属氧化物一般是碱性氧化物,可以跟酸反应生成对应的盐和水。红棕色黑色白色不反应不反应不反应难溶难溶难溶难溶与水反应与水反应二、氢氧化物思考与交流:
谈谈你所了解的金属氢氧化物的主要性质。思考与练习1.若要使制得的Fe(OH)2沉淀迅速变色,你认为应采取什么措施?
2.若要使制得的Fe(OH)2沉淀保持灰白色,而不变色,你认为应采取什么措施?
1.铁的氢氧化物铁有两种氢氧化物
氢氧化铁[Fe(OH)3]
氢氧化亚铁[Fe(OH)2]红褐色沉淀白色絮状沉淀FeCl3 +3 NaOH == Fe(OH)3 ↓+3 NaClFeSO4 + 2NaOH == Fe(OH)2 ↓ + Na2SO4+3+2Fe2+ + 2OH-== Fe(OH)2 ↓ Fe3+ + 3OH-== Fe(OH)3 ↓ 实验3-6在两支试管中加入少量的FeCl3和FeSO4溶液,然后滴入NaOH溶液,观察现象。产生红褐色沉淀生成的灰白色沉
淀迅速变成灰绿
色,最红变成红褐色思考:你所看到的实验现象跟理论相吻合么?
为什么会出现这样的现象?氢氧化亚铁的不稳定性白色的氢氧化亚铁十分不稳定,被空气中的氧气氧化成红褐色的氢氧化铁。4Fe(OH)2 + O2 + H2O == 4Fe(OH)3思考:应该采用什么样的措施才能长时间观察到氢氧化亚铁的白色?加热氢氧化钠溶液赶尽空气、采用新制的硫酸
亚铁溶液,将吸有氢氧化钠溶液的胶头吸管插
到液面下,用植物油封液面……化合价降低,被还原化合价升高,被氧化氧化剂:?
还原剂:?
氧化产物:?
还原产物:?Fe(OH)2 O2 Fe(OH)3Fe(OH)3 【练习】用化学方程式表示下列物质的制备原理。
Mg(OH)2
Cu(OH)2 不溶性碱制备的一般原理:相应的可溶性盐与可溶性碱反应 MgCl2+2NaOH==Mg(OH)2↓+2NaClCuCl2+2NaOH==Cu(OH)2↓+2NaCl不溶性碱的化学性质 与酸反应
不稳定性 Fe(OH)3 + 3HCl == FeCl3 +3 H2O Cu(OH)2 + HNO3 —— 2 Fe(OH)3 ==== Fe2O3 + 3 H2O想一想:氢氧化亚铁若在空气中加热能否得氧化亚铁。为什么?△Cu(NO3)2+2H2O——24Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3
2 Fe(OH)3 ==== Fe2O3 + 3 H2O
△【练习】 下列物质加热,完成下列化学方程式
Mg(OH)2 ——
Cu(OH)2 ——
Fe(OH)3 —— MgO+H2OCuO+H2OFe2O3+3H2O2——————2.氢氧化铝实验3-7 氢氧化铝的制备
在试管中加入适量0.5mol/L Al2(SO4)3溶液,滴加氨水。
现象:产生白色胶状物质6NH3·H2O + Al2(SO4)3 == 3(NH4)2SO4 + 2Al(OH)3↓ 继续滴加氨水,有什么现象?宜用氢氧化钠溶液来制备吗?3NH3·H2O + Al3+ == 3NH4+ + Al(OH)3↓ 生成的沉淀不溶解实验3-8取一些上面实验中制得的氢氧化铝沉淀,分别在2支试管中,往一支试管滴加2mol/L盐酸,往另外一支试管滴加2mol/L氢氧化钠溶液,边加边振荡。Al(OH)3 + 3HCl == AlCl3 + 3H2OAl(OH)3 + NaOH == NaAlO2 + 2H2O两性氢氧化物:既能跟酸又能跟碱反应的氢氧化物。Al(OH)3 + 3H+ == Al3+ + 3H2OAl(OH)3 + OH-== AlO2- + 2H2OAl(OH)3受热分解加热时, Al(OH)3分解为氧化铝和水Al(OH)3重要用途Al(OH)3可以用作胃酸中和剂。Al(OH)3胶状物表面积大,有较强的吸附能力
可以吸附水中悬浮物或色素。可溶性盐与碱反应制得
Ca(OH)2+Na2CO3==CaCO3↓+2NaOH 白色红褐色白色蓝色难溶
难溶
难溶
不分解不分解分解分解分解分解分解练习1:
下列物质中,既能与盐酸反应又能与NaOH溶液反应的是( )
①NaHCO3 ②Al ③Al2O3 ④ Al(OH)3 ⑤AlCl3 ⑥CuO
A. ② ③ ④ ⑤ B. ① ③ ④ ⑥ C. ① ② ③ ④ D.全部C三 、盐 1.碳酸钠和碳酸氢钠小苏打纯碱、苏打白色粉末细小白色晶体易溶溶液变红,显碱性稳定,加热不分解NaHCO3+NaOH=Na2CO3+H2ONa2CO3+Ca(OH)2=CaCO3↓+2NaOH易溶Na2CO3>NaHCO3溶液变红,显碱性不稳定,加热分解2NaHCO3= Na2CO3+H2O+CO2CO32-+2H+=H2O+CO2↑HCO3-+H+=H2O+CO2↑反应速率:Na2CO3 ①Na2CO3(NaHCO3)固体
②NaHCO3(Na2CO3)2、同物质的量浓度同体积的Na2CO3和NaHCO3溶液分别跟过量稀盐酸反应,下列说法中正确的是( )
①NaHCO3消耗盐酸多 ②Na2CO3消耗盐酸多
③Na2CO3放出CO2多 ④NaHCO3放出CO2多
⑤Na2CO3放出CO2较快 ⑥NaHCO3放出CO2较快②⑥加热向溶液中通入过量CO22、铁盐和亚铁盐的性质不反应(遇KSCN溶液颜色无变化)遇KSCN 溶液变红(用于检验)Fe2++2OH-=Fe(OH)2↓Fe3++3OH-=Fe(OH)3↓还原性2FeCl2+Cl2=2FeCl3氧化性2FeCl3+Fe=3FeCl2(2)Fe3+的氧化性和Fe2+的还原性Fe、Fe2+、Fe3+的转化关系(铁三角)科学探究例1:下列4种铁的化合物溶于稀盐酸后,滴加KSCN溶液没有颜色变化,再加氯水呈红色的是( )
A.FeO B.Fe2O3 C.FeCl3 D.FeSO4A、D例2:为了防止试剂变质,配制FeSO4的溶液在试剂瓶中除加入少量H2SO4外,还要加入( )
A.加入Cu B.通入Cl2 C.加入Fe D.加入KSCNC阅读思考明矾为什么能够净水? 明矾溶于水与水反应,生成的Al(OH)3胶体可以吸附悬浮在水中的泥沙等固体物质,并形成沉淀沉降下来,从而使水澄清,因此可用明矾净水。3、铝盐和铁盐的净水作用(教材P51 4、铜盐 教材 P52 误食重金属盐中毒的原因:重金属离子使蛋白质变性,从而使蛋白质失去了生理活性。5、焰色反应实验步骤:①将铂丝放在酒精灯外焰上灼烧至火焰颜色与原来相同;
②用铂丝蘸取待测液(如碳酸钠溶液)放在外焰上灼烧,观察火焰颜色;
③用盐酸洗净铂丝,在外焰上灼烧至火焰无色后,再蘸取第二种待测液(如碳酸钾溶液)在外焰上灼烧,观察火焰颜色(透过蓝色的钴玻璃观察火焰的颜色)。注意:①每次实验必须用盐酸洗净铂丝,并灼烧至火焰与原来相同;
②钾的焰色必须透过蓝色的钴玻璃观察。(避免钠等杂质
的焰色的干扰。)实验3-9几种金属的焰色: Li Na K Ca Sr Ba Cu紫红 黄 紫 砖红 洋红 黄绿 绿利用焰色反应可制成节日烟花 探究:1、可用两种方法制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2
的蒸馏水配制的NaOH溶液反应制备。(1)用硫酸
亚铁晶体配制上述FeSO4溶液时,为防止氧化,还需
加入 。(2)除去蒸馏水中的O2常采用 方法。
(3)用长滴管吸取不含O2的NaOH溶液,插入
FeSO4溶液液面下,再挤出NaOH溶液,这种操作
的理由 返回 滴管使用特例,一般不能用此法方法二:在图2装置中 用 NaOH溶液、铁屑、
稀H2SO4等试剂制备。 (1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入
试剂,打开止水夹,塞紧塞子后的实验步骤
是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,
其理由 。 ??
?
返回 课外训练1. 课本P54:1、2、3、4、6、7
2. 《学习辅导》P42和P44 的 [基础训练]
3. 《创新思维》P41 1、2、3、5、6、 7、8、12、13、14、15、18、23、24。写到作业本
江海中学
陆月勤
2005.11(补:训练《优化全析》98页2、4、6、7、11)一、氧化物:
思考:1、哪些金属氧化物能与水反应生成相应的
碱?哪些金属氧化物不能与水反应生成相应的碱?
你发现有何规律吗?
K2O、CaO、BaO、Na2O能与水反应生成相应的碱,
MgO与水反应缓慢反应生成Mg(OH)2
Al2O3、Fe2O3、CuO不能与水反应生成相应的碱
规律:可溶或微溶的强碱对应的氧化物可与水
反应,难溶的弱碱对应的氧化物不与水反应。
无色黄色MgO+2HCl=MgCl2+H2OFe2O3 +6HCl=2FeCl3+3H2OCuO+2HCl=CuCl2+H2O蓝色铝的氧化物——Al2O3Al2O3 +6HCl=2AlCl3+3H2O
回顾:酸性氧化物CO2、SO2等与碱的反应:
CO2 +2NaOH = Na2CO3+H2O
碳酸钠
Al2O3 +2NaOH = 2NaAlO2+H2O偏铝酸钠Al2O3是两性氧化物,两性氧化物既可以跟酸反应,也可以跟碱反应。与酸反应表现为碱性与碱反应表现为酸性2、两性氧化物指既能与 反应只生成盐和水,
又能与 反应只生成盐和水的氧化物。
分别写出Al2O3与HCl、NaOH溶液反应的离子
方程式。
?
酸碱Al2O3+6H+== 2Al3++3H2O
Al2O3+2OH-== 2AlO2-+H2O
3、金属氧化物一定是碱性氧化物吗?
碱性氧化物一定是金属氧化物吗?
金属氧化物不一定是碱性氧化物(如Al2O3
是两性氧化物,Mn2O7是酸性氧化物),碱性
氧化物一定是金属氧化物。 “学与问”:钠表面的氧化物和铝的氧化膜都是
金属氧化物,它们的外观形态和性质相同吗?
对内层金属的保护作用一样吗?
Na2O、Al2O3都是白色固体,但附在银白色的金属
钠或铝上均显暗灰色。化学性质不同:(1)Na2O
能溶于水生成NaOH。Al2O3不溶于水,与水不反
应。(2)Na2O能与酸反应,Al2O3既能与酸反应,
又能与强碱反应。Na2O疏松,对内层金属不起保护作用,而在空气
中Al表面的Al2O3是致密的薄层,对内层铝有很好
的保护作用。 1、金属氧化物在自然界中常以 的形式存在。铝土矿Al2O3赤铁矿Fe2O3矿物资料卡片常见的还有磁铁矿Fe3O4金属氧化物可作为冶炼金属的原料,如氧化铁用于冶炼铁,氧化铝用于冶炼铝。
氧化铁俗称铁红,常用于制造红色油漆和涂料。
氧化铝是一种白色难熔的物质,是一种较好的耐火材料,常用于制造耐火坩埚和耐火管等。资料卡片:金属氧化物的用途氧化铜呈黑色,可作为制造铜盐的原料
氧化亚铜(Cu2O)呈红色,可作为制造玻璃、搪瓷的红色颜料。资料卡片:金属氧化物的用途用Fe2O3制成的红棕色涂料含有Cu2O的红色玻璃用耐高温的Al2O3制成的坩埚用耐磨的Al2O3做成的轴承 小结:多数金属氧化物不溶于水;
少数金属氧化物能跟水反应生成碱。Na2O + H2O = 2NaOH
CaO + H2O = Ca(OH)2
K2O + H2O = 2KOH 金属氧化物一般是碱性氧化物,可以跟酸反应生成对应的盐和水。红棕色黑色白色不反应不反应不反应难溶难溶难溶难溶与水反应与水反应二、氢氧化物思考与交流:
谈谈你所了解的金属氢氧化物的主要性质。思考与练习1.若要使制得的Fe(OH)2沉淀迅速变色,你认为应采取什么措施?
2.若要使制得的Fe(OH)2沉淀保持灰白色,而不变色,你认为应采取什么措施?
1.铁的氢氧化物铁有两种氢氧化物
氢氧化铁[Fe(OH)3]
氢氧化亚铁[Fe(OH)2]红褐色沉淀白色絮状沉淀FeCl3 +3 NaOH == Fe(OH)3 ↓+3 NaClFeSO4 + 2NaOH == Fe(OH)2 ↓ + Na2SO4+3+2Fe2+ + 2OH-== Fe(OH)2 ↓ Fe3+ + 3OH-== Fe(OH)3 ↓ 实验3-6在两支试管中加入少量的FeCl3和FeSO4溶液,然后滴入NaOH溶液,观察现象。产生红褐色沉淀生成的灰白色沉
淀迅速变成灰绿
色,最红变成红褐色思考:你所看到的实验现象跟理论相吻合么?
为什么会出现这样的现象?氢氧化亚铁的不稳定性白色的氢氧化亚铁十分不稳定,被空气中的氧气氧化成红褐色的氢氧化铁。4Fe(OH)2 + O2 + H2O == 4Fe(OH)3思考:应该采用什么样的措施才能长时间观察到氢氧化亚铁的白色?加热氢氧化钠溶液赶尽空气、采用新制的硫酸
亚铁溶液,将吸有氢氧化钠溶液的胶头吸管插
到液面下,用植物油封液面……化合价降低,被还原化合价升高,被氧化氧化剂:?
还原剂:?
氧化产物:?
还原产物:?Fe(OH)2 O2 Fe(OH)3Fe(OH)3 【练习】用化学方程式表示下列物质的制备原理。
Mg(OH)2
Cu(OH)2 不溶性碱制备的一般原理:相应的可溶性盐与可溶性碱反应 MgCl2+2NaOH==Mg(OH)2↓+2NaClCuCl2+2NaOH==Cu(OH)2↓+2NaCl不溶性碱的化学性质 与酸反应
不稳定性 Fe(OH)3 + 3HCl == FeCl3 +3 H2O Cu(OH)2 + HNO3 —— 2 Fe(OH)3 ==== Fe2O3 + 3 H2O想一想:氢氧化亚铁若在空气中加热能否得氧化亚铁。为什么?△Cu(NO3)2+2H2O——24Fe(OH)2 + O2 + 2H2O == 4Fe(OH)3
2 Fe(OH)3 ==== Fe2O3 + 3 H2O
△【练习】 下列物质加热,完成下列化学方程式
Mg(OH)2 ——
Cu(OH)2 ——
Fe(OH)3 —— MgO+H2OCuO+H2OFe2O3+3H2O2——————2.氢氧化铝实验3-7 氢氧化铝的制备
在试管中加入适量0.5mol/L Al2(SO4)3溶液,滴加氨水。
现象:产生白色胶状物质6NH3·H2O + Al2(SO4)3 == 3(NH4)2SO4 + 2Al(OH)3↓ 继续滴加氨水,有什么现象?宜用氢氧化钠溶液来制备吗?3NH3·H2O + Al3+ == 3NH4+ + Al(OH)3↓ 生成的沉淀不溶解实验3-8取一些上面实验中制得的氢氧化铝沉淀,分别在2支试管中,往一支试管滴加2mol/L盐酸,往另外一支试管滴加2mol/L氢氧化钠溶液,边加边振荡。Al(OH)3 + 3HCl == AlCl3 + 3H2OAl(OH)3 + NaOH == NaAlO2 + 2H2O两性氢氧化物:既能跟酸又能跟碱反应的氢氧化物。Al(OH)3 + 3H+ == Al3+ + 3H2OAl(OH)3 + OH-== AlO2- + 2H2OAl(OH)3受热分解加热时, Al(OH)3分解为氧化铝和水Al(OH)3重要用途Al(OH)3可以用作胃酸中和剂。Al(OH)3胶状物表面积大,有较强的吸附能力
可以吸附水中悬浮物或色素。可溶性盐与碱反应制得
Ca(OH)2+Na2CO3==CaCO3↓+2NaOH 白色红褐色白色蓝色难溶
难溶
难溶
不分解不分解分解分解分解分解分解练习1:
下列物质中,既能与盐酸反应又能与NaOH溶液反应的是( )
①NaHCO3 ②Al ③Al2O3 ④ Al(OH)3 ⑤AlCl3 ⑥CuO
A. ② ③ ④ ⑤ B. ① ③ ④ ⑥ C. ① ② ③ ④ D.全部C三 、盐 1.碳酸钠和碳酸氢钠小苏打纯碱、苏打白色粉末细小白色晶体易溶溶液变红,显碱性稳定,加热不分解NaHCO3+NaOH=Na2CO3+H2ONa2CO3+Ca(OH)2=CaCO3↓+2NaOH易溶Na2CO3>NaHCO3溶液变红,显碱性不稳定,加热分解2NaHCO3= Na2CO3+H2O+CO2CO32-+2H+=H2O+CO2↑HCO3-+H+=H2O+CO2↑反应速率:Na2CO3
②NaHCO3(Na2CO3)2、同物质的量浓度同体积的Na2CO3和NaHCO3溶液分别跟过量稀盐酸反应,下列说法中正确的是( )
①NaHCO3消耗盐酸多 ②Na2CO3消耗盐酸多
③Na2CO3放出CO2多 ④NaHCO3放出CO2多
⑤Na2CO3放出CO2较快 ⑥NaHCO3放出CO2较快②⑥加热向溶液中通入过量CO22、铁盐和亚铁盐的性质不反应(遇KSCN溶液颜色无变化)遇KSCN 溶液变红(用于检验)Fe2++2OH-=Fe(OH)2↓Fe3++3OH-=Fe(OH)3↓还原性2FeCl2+Cl2=2FeCl3氧化性2FeCl3+Fe=3FeCl2(2)Fe3+的氧化性和Fe2+的还原性Fe、Fe2+、Fe3+的转化关系(铁三角)科学探究例1:下列4种铁的化合物溶于稀盐酸后,滴加KSCN溶液没有颜色变化,再加氯水呈红色的是( )
A.FeO B.Fe2O3 C.FeCl3 D.FeSO4A、D例2:为了防止试剂变质,配制FeSO4的溶液在试剂瓶中除加入少量H2SO4外,还要加入( )
A.加入Cu B.通入Cl2 C.加入Fe D.加入KSCNC阅读思考明矾为什么能够净水? 明矾溶于水与水反应,生成的Al(OH)3胶体可以吸附悬浮在水中的泥沙等固体物质,并形成沉淀沉降下来,从而使水澄清,因此可用明矾净水。3、铝盐和铁盐的净水作用(教材P51 4、铜盐 教材 P52 误食重金属盐中毒的原因:重金属离子使蛋白质变性,从而使蛋白质失去了生理活性。5、焰色反应实验步骤:①将铂丝放在酒精灯外焰上灼烧至火焰颜色与原来相同;
②用铂丝蘸取待测液(如碳酸钠溶液)放在外焰上灼烧,观察火焰颜色;
③用盐酸洗净铂丝,在外焰上灼烧至火焰无色后,再蘸取第二种待测液(如碳酸钾溶液)在外焰上灼烧,观察火焰颜色(透过蓝色的钴玻璃观察火焰的颜色)。注意:①每次实验必须用盐酸洗净铂丝,并灼烧至火焰与原来相同;
②钾的焰色必须透过蓝色的钴玻璃观察。(避免钠等杂质
的焰色的干扰。)实验3-9几种金属的焰色: Li Na K Ca Sr Ba Cu紫红 黄 紫 砖红 洋红 黄绿 绿利用焰色反应可制成节日烟花 探究:1、可用两种方法制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2
的蒸馏水配制的NaOH溶液反应制备。(1)用硫酸
亚铁晶体配制上述FeSO4溶液时,为防止氧化,还需
加入 。(2)除去蒸馏水中的O2常采用 方法。
(3)用长滴管吸取不含O2的NaOH溶液,插入
FeSO4溶液液面下,再挤出NaOH溶液,这种操作
的理由 返回 滴管使用特例,一般不能用此法方法二:在图2装置中 用 NaOH溶液、铁屑、
稀H2SO4等试剂制备。 (1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入
试剂,打开止水夹,塞紧塞子后的实验步骤
是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,
其理由 。 ??
?
返回 课外训练1. 课本P54:1、2、3、4、6、7
2. 《学习辅导》P42和P44 的 [基础训练]
3. 《创新思维》P41 1、2、3、5、6、 7、8、12、13、14、15、18、23、24。写到作业本
