新课本人教版第三章第一节 金属的化学性质(必修1)[上学期]
文档属性
| 名称 | 新课本人教版第三章第一节 金属的化学性质(必修1)[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 680.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-01-20 00:00:00 | ||
图片预览










文档简介
课件33张PPT。第三章
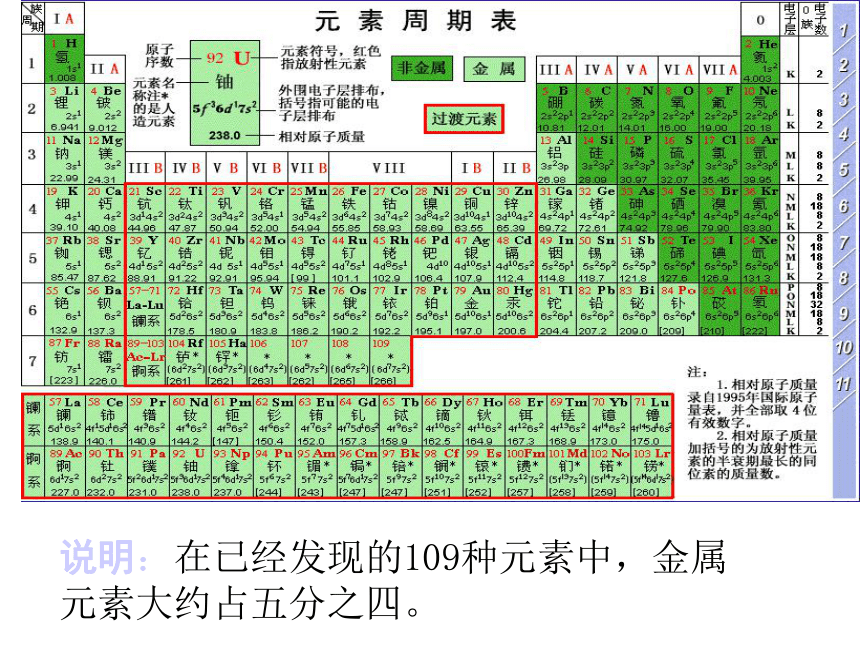
金属及其化合物主讲教师:解大方第一节 金属的化学性质上海南浦大桥歼6---超音速战斗机说明:在已经发现的109种元素中,金属 元素大约占五分之四。1、金属的化学性质【自主学习】请同学们阅读课本38页图3-1,图3-2
“思考与交流”,然后完成教学案第一页
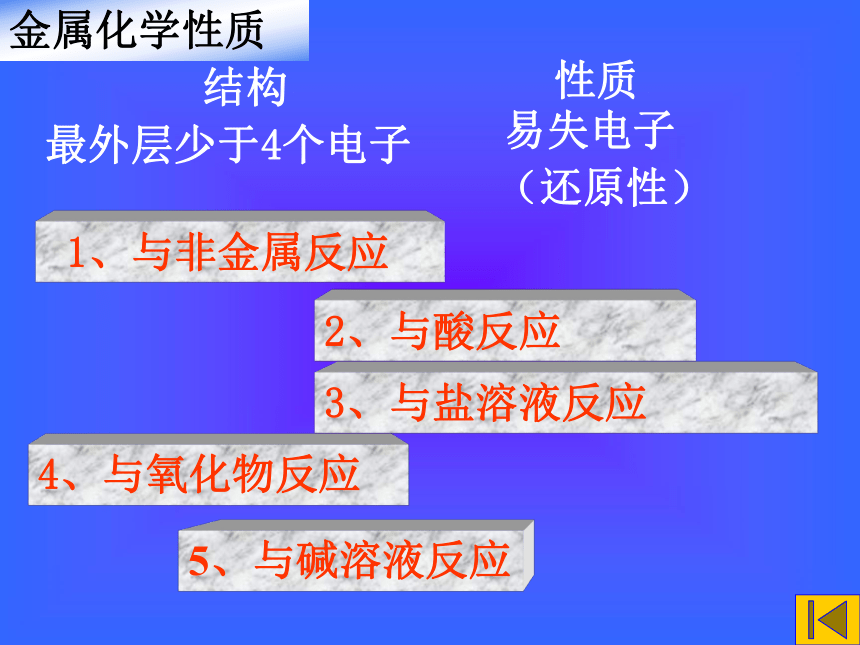
“学生讨论”和“课堂练习”。金属化学性质结构 (还原性) 1、与非金属反应 2、与酸反应 3、与盐溶液反应 4、与氧化物反应 性质最外层少于4个电子 易失电子5、与碱溶液反应一、金属与氧气反应【实验探究】课本39页实验3-1你能不能简单描述钠的物理性质?【实验探究】课本39页实验3-2钠与氧气反应在常温下和加热条件下一样吗?钠的物理性质 颜色:银白色密度:比水( ) (轻或重)质地:较软 (可用刀切开)熔点:较( ) (低或高)实验钠是电和热的良导体钠与氧气反应1常温下4Na + O2 = 2Na2O银白色的切面很快变成白色白色Na2O不稳定实验 加热下2Na + O2 = Na2O2△黄色火焰,生成黄色Na2O2钠与氧气反应200+1-1实验思考: Na2O2有什么用途?是否是碱性氧化物?练习:写出过氧化钠与盐酸反应的化学方程式2Na2O2 + 4HCl = 4NaCl + 2H2O + O2思考:过氧化钠是碱性氧化物吗? 答:不是。因为过氧化钠与酸反应,除了生成盐和水外,还生成氧气。1与水反应:2Na2O2+2H2O=4NaOH + O2
2与CO2反应:2Na2O+2CO2=2Na2CO3 + O2过氧化钠用途:是强氧化剂,漂白织物、麦秆、羽毛。用作呼吸面具上和潜艇里的供氧剂。【科学视野】课本第40页呼吸面具附表1:氧化钠与过氧化钠的比较—白色固体 淡黄色固体 -2价 -1价 常温 点燃 不稳定 稳定 Na2O+H2O=2NaOH Na2O+CO2=Na2CO3 强氧化性、漂白性 供氧剂、漂白剂 2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2解释现象 取一小块金属钠,去掉表面的煤油,露置于空气中,可观察到的现象是:银白色逐渐变暗,固体消失变成液滴,液滴消失变成白色粉末。解释上述现象,写出有关反应的化学方程式。 4Na + O2 = 2Na2ONa2O + H2O = 2NaOH 2NaOH + CO2 = Na2CO3 + H2O 生成氧化钠而变暗 氢氧化钠吸水潮解形成溶液2 Na + S = Na2S反应剧烈,甚至爆炸研磨2Na + Cl2 = 2NaCl点燃2Na + Cl2 = 2NaCl燃烧,有白烟实验4钠与其他非金属反应铝与氧气反应【科学探究】见课本40页,完成教学案第二页“归 纳与整理”(1)实验现象:铝箔熔化,失去光泽,熔化的铝不滴落。(2)原理分析:构成薄膜的氧化铝的熔点高于铝的熔点,
铝很活泼,磨去原来的氧化膜后,在空气中又会很快生成
一层新的氧化膜。(3)氧化膜的作用:保护内部金属不被氧化。(4)化学反应4Al + 3O2 = 2Al2O3(白色不溶于水的固体)【思考与交流】见教学案第2页最后。△1、切开的光亮的金属钠断面在空气中会 ,原因是
, 反应的化学方程式为
,若金属钠在空气中燃烧,则生成的是________________,燃烧时火焰呈______色,反应的化学方程式 。
2、下列叙述正确的是( )
A.钠燃烧的火焰为浅蓝色
B.刚切开的金属钠截面变暗淡是由于生成了过氧化钠
C.钠与单质硫可剧烈化合
D.钠通常作氧化剂 变暗钠在空气中被氧化淡黄色固体黄C2Na + O2 = Na2O24Na+ O2 = 2Na2O【课堂练习】点燃3、教学案【课时作业】5、6、8、9、10二、金属与水的反应【实验探究】见课本41页,实验3-3【思考与交流】
1、实验现象?
2、钠为什么会浮在水面上?
3、为什么烧杯上方出现水雾?
4、钠为什么会熔化成一个小球?实 验 现 象 讨 论1、钠与水反应2Na + 2H2O = 2NaOH + H2↑分析:2Na + 2H2O = 2NaOH + H2↑0+1+10还原剂:氧化剂:NaH2O还原性:>NaH2电子转移数:2个+1得 2e失 2e离子方程式:2Na + 2H2O = 2Na+ + 2OH- +H2↑--钠与氯化铜溶液是否发生置换反应?试
根据所学的知识分析实验的现象及原因。
是离子反应的写出离子方程式。
【思考与交流】知识拓展钠与盐溶液反应在FeCl3溶液中加入钠,写出化学方程式和离子方程式?2Na + 2H2O = 2NaOH + H2↑FeCl3+3NaOH = Fe(OH)3↓+3NaClFe3++3Cl-+3Na++3OH- Fe(OH)3↓+3Na++3Cl-Fe3++ 3OH- = Fe(OH)3↓溶液中有气泡产生,同时生成红棕色沉淀2Na + 2H2O = 2Na+ + 2OH- +H2↑【让你试试】2Na+2H2O===2NaOH+H2↑ ………………(1)CuCl2+2NaOH==Cu(OH)2↓+2NaCl…... (2)2Na+CuCl2+2H2O== Cu(OH)2↓+2NaCl +H2↑
……………………(3) 改写为离子方程式:2Na +Cu2++2H2O== Cu(OH)2↓ +2Na++H2↑钠的保存 保存在煤油里 易与空气中的氧气反应 易与水、二氧化碳反应钠着火的处理:性质:用砂子扑灭*向你请教 金属钠为何保存在煤油中? 因金属钠与空气中的 O2 和 H2O 容易反应,
所以应将金属钠与空气隔绝。 金属钠为何能保存在煤油中? 因金属钠的密度比煤油大且不与煤油反应 金属钠能否保存在四氯化碳中? 不能,因钠的密度比CCl4 小,浮在液面。高压钠灯及其用途2、铁与水蒸气反应【科学探究】实验装置:请你设计,见课本42页。实验现象:红热的铁能跟水蒸气起反应,放出气体,这种气体靠近火焰点火时,能发出爆鸣声,这是氢气。 化学方程式:3Fe+4H2O(g) =Fe3O4+4H2↑ 【课堂练习】见教学案第3页“课堂练习”。△课 堂 练 习1.下列液体可以用来保存金属钠的是……….( )
A.水 B.浓NaOH溶液 C.煤油 D.CCl4(d>1g/cm3)
2.钠与水反应时的现象与钠的下列性质无关的是( )
A.钠的熔点低 B.钠的密度小
C.钠的硬度小 D.钠有强还原性
3.下列关于金属钠的叙述,错误的是…………( )
A.很软,具有银白色光泽 B.是电和热的良导体
C.比水轻,比煤油重,熔点低于100℃
D.和FeCl3溶液反应可以置换出单质铁CCD4.钠在空气中长时间放置最终将转化为————————,有关的化学方程式为—————————————————;
—————————————;————————————————————;
————————————————————————。5.将一小块金属钠投入氯化铁溶液中的化学反应方
程式为______________________________________;
离子反应方程式为 _____________________________。Na2CO34Na+O2=2Na2ONa2O+H2O=2NaOH2NaOH+CO2+9 H2O =Na2CO3·10 H2ONa2CO3·10 H2O == Na2CO3 +10H2O。课 堂 练 习再见!
金属及其化合物主讲教师:解大方第一节 金属的化学性质上海南浦大桥歼6---超音速战斗机说明:在已经发现的109种元素中,金属 元素大约占五分之四。1、金属的化学性质【自主学习】请同学们阅读课本38页图3-1,图3-2
“思考与交流”,然后完成教学案第一页
“学生讨论”和“课堂练习”。金属化学性质结构 (还原性) 1、与非金属反应 2、与酸反应 3、与盐溶液反应 4、与氧化物反应 性质最外层少于4个电子 易失电子5、与碱溶液反应一、金属与氧气反应【实验探究】课本39页实验3-1你能不能简单描述钠的物理性质?【实验探究】课本39页实验3-2钠与氧气反应在常温下和加热条件下一样吗?钠的物理性质 颜色:银白色密度:比水( ) (轻或重)质地:较软 (可用刀切开)熔点:较( ) (低或高)实验钠是电和热的良导体钠与氧气反应1常温下4Na + O2 = 2Na2O银白色的切面很快变成白色白色Na2O不稳定实验 加热下2Na + O2 = Na2O2△黄色火焰,生成黄色Na2O2钠与氧气反应200+1-1实验思考: Na2O2有什么用途?是否是碱性氧化物?练习:写出过氧化钠与盐酸反应的化学方程式2Na2O2 + 4HCl = 4NaCl + 2H2O + O2思考:过氧化钠是碱性氧化物吗? 答:不是。因为过氧化钠与酸反应,除了生成盐和水外,还生成氧气。1与水反应:2Na2O2+2H2O=4NaOH + O2
2与CO2反应:2Na2O+2CO2=2Na2CO3 + O2过氧化钠用途:是强氧化剂,漂白织物、麦秆、羽毛。用作呼吸面具上和潜艇里的供氧剂。【科学视野】课本第40页呼吸面具附表1:氧化钠与过氧化钠的比较—白色固体 淡黄色固体 -2价 -1价 常温 点燃 不稳定 稳定 Na2O+H2O=2NaOH Na2O+CO2=Na2CO3 强氧化性、漂白性 供氧剂、漂白剂 2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2解释现象 取一小块金属钠,去掉表面的煤油,露置于空气中,可观察到的现象是:银白色逐渐变暗,固体消失变成液滴,液滴消失变成白色粉末。解释上述现象,写出有关反应的化学方程式。 4Na + O2 = 2Na2ONa2O + H2O = 2NaOH 2NaOH + CO2 = Na2CO3 + H2O 生成氧化钠而变暗 氢氧化钠吸水潮解形成溶液2 Na + S = Na2S反应剧烈,甚至爆炸研磨2Na + Cl2 = 2NaCl点燃2Na + Cl2 = 2NaCl燃烧,有白烟实验4钠与其他非金属反应铝与氧气反应【科学探究】见课本40页,完成教学案第二页“归 纳与整理”(1)实验现象:铝箔熔化,失去光泽,熔化的铝不滴落。(2)原理分析:构成薄膜的氧化铝的熔点高于铝的熔点,
铝很活泼,磨去原来的氧化膜后,在空气中又会很快生成
一层新的氧化膜。(3)氧化膜的作用:保护内部金属不被氧化。(4)化学反应4Al + 3O2 = 2Al2O3(白色不溶于水的固体)【思考与交流】见教学案第2页最后。△1、切开的光亮的金属钠断面在空气中会 ,原因是
, 反应的化学方程式为
,若金属钠在空气中燃烧,则生成的是________________,燃烧时火焰呈______色,反应的化学方程式 。
2、下列叙述正确的是( )
A.钠燃烧的火焰为浅蓝色
B.刚切开的金属钠截面变暗淡是由于生成了过氧化钠
C.钠与单质硫可剧烈化合
D.钠通常作氧化剂 变暗钠在空气中被氧化淡黄色固体黄C2Na + O2 = Na2O24Na+ O2 = 2Na2O【课堂练习】点燃3、教学案【课时作业】5、6、8、9、10二、金属与水的反应【实验探究】见课本41页,实验3-3【思考与交流】
1、实验现象?
2、钠为什么会浮在水面上?
3、为什么烧杯上方出现水雾?
4、钠为什么会熔化成一个小球?实 验 现 象 讨 论1、钠与水反应2Na + 2H2O = 2NaOH + H2↑分析:2Na + 2H2O = 2NaOH + H2↑0+1+10还原剂:氧化剂:NaH2O还原性:>NaH2电子转移数:2个+1得 2e失 2e离子方程式:2Na + 2H2O = 2Na+ + 2OH- +H2↑--钠与氯化铜溶液是否发生置换反应?试
根据所学的知识分析实验的现象及原因。
是离子反应的写出离子方程式。
【思考与交流】知识拓展钠与盐溶液反应在FeCl3溶液中加入钠,写出化学方程式和离子方程式?2Na + 2H2O = 2NaOH + H2↑FeCl3+3NaOH = Fe(OH)3↓+3NaClFe3++3Cl-+3Na++3OH- Fe(OH)3↓+3Na++3Cl-Fe3++ 3OH- = Fe(OH)3↓溶液中有气泡产生,同时生成红棕色沉淀2Na + 2H2O = 2Na+ + 2OH- +H2↑【让你试试】2Na+2H2O===2NaOH+H2↑ ………………(1)CuCl2+2NaOH==Cu(OH)2↓+2NaCl…... (2)2Na+CuCl2+2H2O== Cu(OH)2↓+2NaCl +H2↑
……………………(3) 改写为离子方程式:2Na +Cu2++2H2O== Cu(OH)2↓ +2Na++H2↑钠的保存 保存在煤油里 易与空气中的氧气反应 易与水、二氧化碳反应钠着火的处理:性质:用砂子扑灭*向你请教 金属钠为何保存在煤油中? 因金属钠与空气中的 O2 和 H2O 容易反应,
所以应将金属钠与空气隔绝。 金属钠为何能保存在煤油中? 因金属钠的密度比煤油大且不与煤油反应 金属钠能否保存在四氯化碳中? 不能,因钠的密度比CCl4 小,浮在液面。高压钠灯及其用途2、铁与水蒸气反应【科学探究】实验装置:请你设计,见课本42页。实验现象:红热的铁能跟水蒸气起反应,放出气体,这种气体靠近火焰点火时,能发出爆鸣声,这是氢气。 化学方程式:3Fe+4H2O(g) =Fe3O4+4H2↑ 【课堂练习】见教学案第3页“课堂练习”。△课 堂 练 习1.下列液体可以用来保存金属钠的是……….( )
A.水 B.浓NaOH溶液 C.煤油 D.CCl4(d>1g/cm3)
2.钠与水反应时的现象与钠的下列性质无关的是( )
A.钠的熔点低 B.钠的密度小
C.钠的硬度小 D.钠有强还原性
3.下列关于金属钠的叙述,错误的是…………( )
A.很软,具有银白色光泽 B.是电和热的良导体
C.比水轻,比煤油重,熔点低于100℃
D.和FeCl3溶液反应可以置换出单质铁CCD4.钠在空气中长时间放置最终将转化为————————,有关的化学方程式为—————————————————;
—————————————;————————————————————;
————————————————————————。5.将一小块金属钠投入氯化铁溶液中的化学反应方
程式为______________________________________;
离子反应方程式为 _____________________________。Na2CO34Na+O2=2Na2ONa2O+H2O=2NaOH2NaOH+CO2+9 H2O =Na2CO3·10 H2ONa2CO3·10 H2O == Na2CO3 +10H2O。课 堂 练 习再见!
