金属的化学性质(1)[上学期]
文档属性
| 名称 | 金属的化学性质(1)[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 618.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2005-11-09 00:00:00 | ||
图片预览




文档简介
课件10张PPT。第三章
金属及其化合物第一节
金属的化学性质(1)教学目标了解金属在自然界中的存在;
了解钠、铝、铁、铜等金属及其重要化合物的主要化学元素性质;
掌握钠的氧化、钠与水的反应
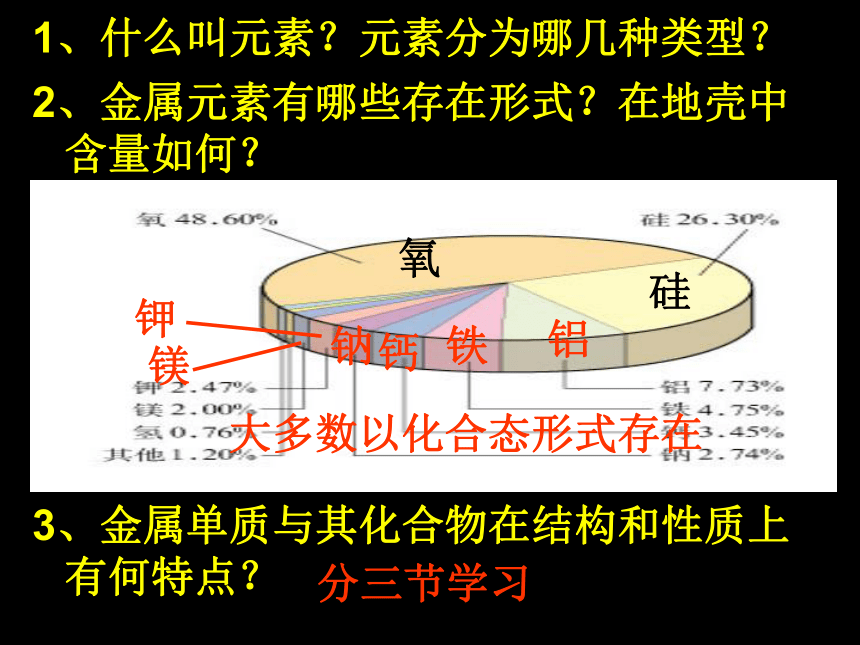
掌握铝与强碱的反应。1、什么叫元素?元素分为哪几种类型?2、金属元素有哪些存在形式?在地壳中含量如何?
3、金属单质与其化合物在结构和性质上有何特点?氧硅铝铁钙钠钾镁大多数以化合态形式存在分三节学习第一节 金属的化学性质金属的物理性质:(共性)
有金属光泽、易传热、易导电,有延展性、可塑性,除汞以外都是固体 。
P.38思考与交流
金属有哪些共同的化学性质??
2Al+3Cu2+=2Al3++3Cu
2Mg+O2=2MgO
Cu+2Ag+=Cu2++2Ag
Mg+2H+=Mg2++H2↑ 金属单质中元素的化合价升高,表现还原性。钠:银白色,较软,比水轻,熔点较低,保存在煤油中。一、金属与氧气的反应4Na + O2 === 2Na2O常温下:银白色的切面很快变成白色白色Na2O不稳定, 2Na2O + O2 ==2Na2O2 1、钠和氧气反应
Na2O2的特殊用途:
2Na2O2+2CO2=Na2CO3+O2
2Na2O2+2H2O=4NaOH+O2↑
钠和氯气反应:帮助呼吸是不是碱性氧化物?现象:黄色火焰,生成淡黄色Na2O22Na+Cl2=2NaCl2、铝和氧气反应: 活泼金属在空气中容易与氧气反应,表面生成一层氧化物。有的氧化末疏松,不能保护内层金属,如铁等;有的氧化膜致密,可以保护内层金属不被继续氧化,如镁、铝等。
4Fe+3O2=2Fe2O3
Mg+O2=2MgO 2Cu+O2=2CuO
结论:(一般)金属+O2→金属氧化物
金属+Cl2→金属氯化物
2Fe+3Cl2=2FeCl3 2Al+3Cl2=2AlCl3二、金属和水的反应1、钠和水的反应:(实验3-3)
钠浮在水面上钠熔化成小球钠在水面上游动有嘶嘶的声音滴有酚酞的液体变成了红色钠比水轻反应放出了热量
钠的熔点较低反应放出了气体生成物呈碱性反应放出的热量多
气体是可燃性气体2Na+H2O=2NaOH+H2↑2、铁和水蒸气的反应实验探究:P.42 铁与水蒸气的反应
如果给你3支试管、水槽、蒸发皿、橡皮塞、导管、酒精喷灯等,请画出设计简图
如果按下图设计……小结: 金属元素在化学变化中通常从0价升为正价,被氧化,表现出了较强的还原性。 金属在自然界中多以化合态存在。
思考:金属钠长期放置在空气中的最终产物是什么?
布置作业:P.45 1、2、3、4(1)
金属的化学性质(1)教学目标了解金属在自然界中的存在;
了解钠、铝、铁、铜等金属及其重要化合物的主要化学元素性质;
掌握钠的氧化、钠与水的反应
掌握铝与强碱的反应。1、什么叫元素?元素分为哪几种类型?2、金属元素有哪些存在形式?在地壳中含量如何?
3、金属单质与其化合物在结构和性质上有何特点?氧硅铝铁钙钠钾镁大多数以化合态形式存在分三节学习第一节 金属的化学性质金属的物理性质:(共性)
有金属光泽、易传热、易导电,有延展性、可塑性,除汞以外都是固体 。
P.38思考与交流
金属有哪些共同的化学性质??
2Al+3Cu2+=2Al3++3Cu
2Mg+O2=2MgO
Cu+2Ag+=Cu2++2Ag
Mg+2H+=Mg2++H2↑ 金属单质中元素的化合价升高,表现还原性。钠:银白色,较软,比水轻,熔点较低,保存在煤油中。一、金属与氧气的反应4Na + O2 === 2Na2O常温下:银白色的切面很快变成白色白色Na2O不稳定, 2Na2O + O2 ==2Na2O2 1、钠和氧气反应
Na2O2的特殊用途:
2Na2O2+2CO2=Na2CO3+O2
2Na2O2+2H2O=4NaOH+O2↑
钠和氯气反应:帮助呼吸是不是碱性氧化物?现象:黄色火焰,生成淡黄色Na2O22Na+Cl2=2NaCl2、铝和氧气反应: 活泼金属在空气中容易与氧气反应,表面生成一层氧化物。有的氧化末疏松,不能保护内层金属,如铁等;有的氧化膜致密,可以保护内层金属不被继续氧化,如镁、铝等。
4Fe+3O2=2Fe2O3
Mg+O2=2MgO 2Cu+O2=2CuO
结论:(一般)金属+O2→金属氧化物
金属+Cl2→金属氯化物
2Fe+3Cl2=2FeCl3 2Al+3Cl2=2AlCl3二、金属和水的反应1、钠和水的反应:(实验3-3)
钠浮在水面上钠熔化成小球钠在水面上游动有嘶嘶的声音滴有酚酞的液体变成了红色钠比水轻反应放出了热量
钠的熔点较低反应放出了气体生成物呈碱性反应放出的热量多
气体是可燃性气体2Na+H2O=2NaOH+H2↑2、铁和水蒸气的反应实验探究:P.42 铁与水蒸气的反应
如果给你3支试管、水槽、蒸发皿、橡皮塞、导管、酒精喷灯等,请画出设计简图
如果按下图设计……小结: 金属元素在化学变化中通常从0价升为正价,被氧化,表现出了较强的还原性。 金属在自然界中多以化合态存在。
思考:金属钠长期放置在空气中的最终产物是什么?
布置作业:P.45 1、2、3、4(1)
