无机非金属材料-硅[上学期]
文档属性
| 名称 | 无机非金属材料-硅[上学期] |  | |
| 格式 | rar | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2005-10-31 20:39:00 | ||
图片预览






文档简介
课件21张PPT。第一节
无机非金属材料的主角—硅一、硅和碳最外层电子数相同,都有4个电子,化学性质相似1、硅:在常温下,化学性质不活泼,除F2、HF酸和强碱外,不跟其它物质起反应Si+2F2=SiF4 Si+4HF=SiF4+2H2? Si+2NaOH+H2O=Na2SiO3+2H2?2、碳:在常温下,化学性质不活泼,随着温度升高,碳的活动性大大增强3、硅的制法、存在及用途(2)存在:自然界中,只以化合态在(SiO2或硅酸盐的形式存在)存在于地壳的矿物和岩石里,在地壳中,硅的含量居第二位
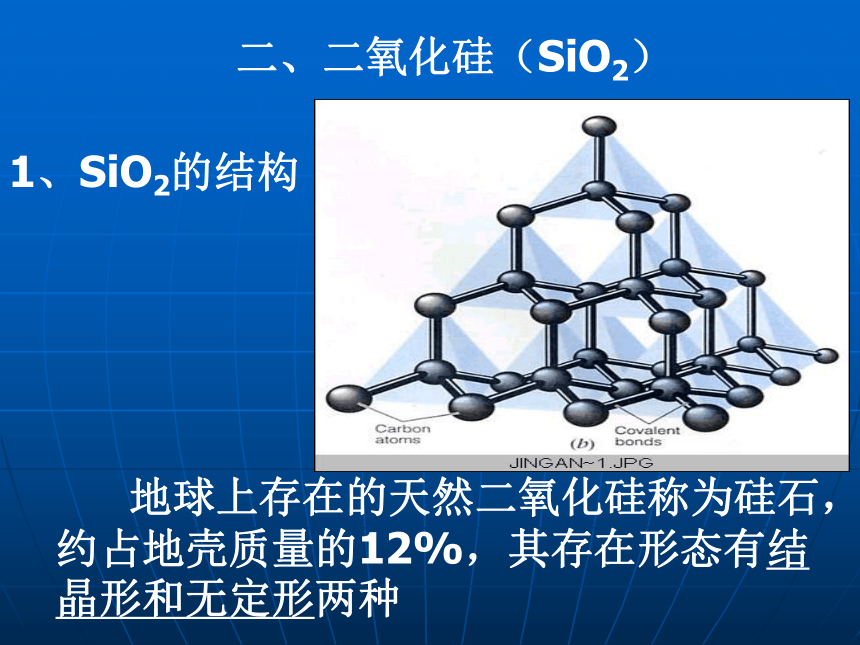
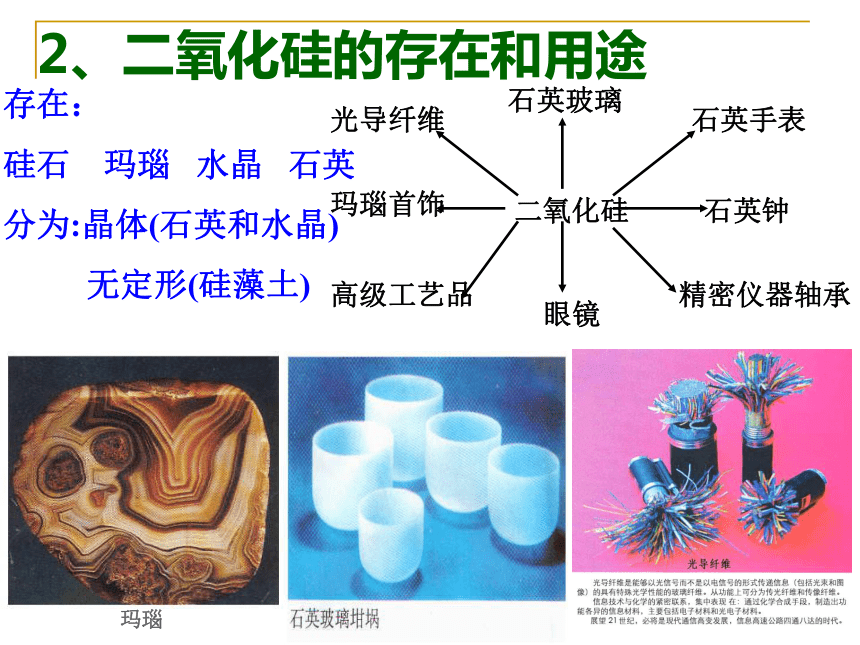
(3)用途:硅是重要的半导体材料,在电子工业上有广泛的用途二、二氧化硅(SiO2)1、SiO2的结构 地球上存在的天然二氧化硅称为硅石,约占地壳质量的12%,其存在形态有结晶形和无定形两种2、二氧化硅的存在和用途玛瑙存在:
硅石 玛瑙 水晶 石英
分为:晶体(石英和水晶)
无定形(硅藻土)
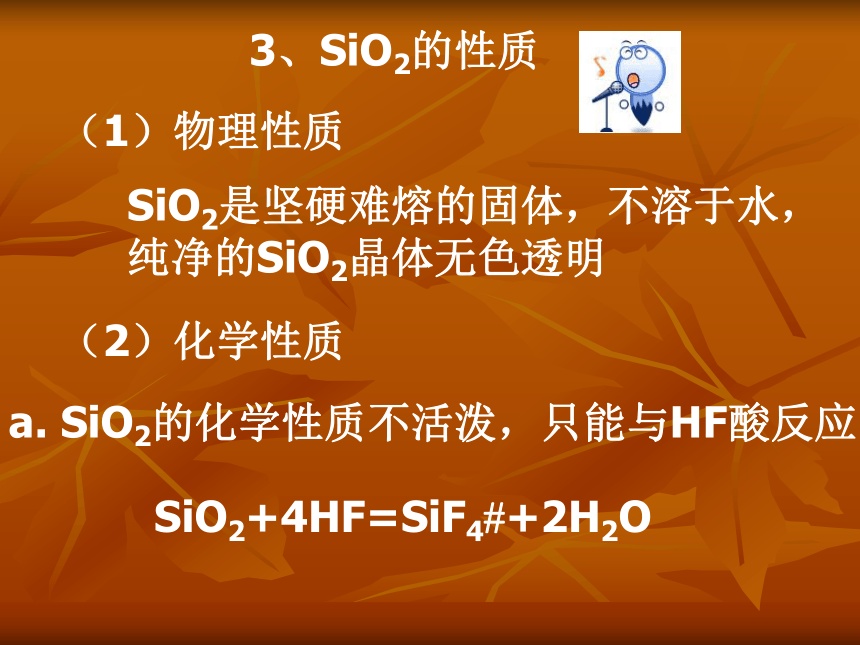
3、SiO2的性质(1)物理性质SiO2是坚硬难熔的固体,不溶于水,纯净的SiO2晶体无色透明(2)化学性质a. SiO2的化学性质不活泼,只能与HF酸反应SiO2+4HF=SiF4?+2H2O思考为什么可用氢氟酸雕刻玻璃?用什么容器来盛HF酸? 因为玻璃中含有SiO2,而SiO2可以跟HF酸发生反应,所以HF酸可以腐蚀玻璃,从而可用氢氟酸雕刻玻璃;故不能用玻璃瓶盛HF酸,而用塑料瓶。b. SiO2是酸性氧化物:在常温下与强碱溶液发生反应,生成盐和水SiO2+2NaOH=Na2SiO3+H2O 当玻璃瓶配玻璃塞时,瓶口内壁和瓶塞外壁都进行了磨砂处理。玻璃中含有SiO2,磨砂玻璃遇到强碱溶液时,SiO2与强碱 NaOH溶液反应生成了硅酸盐Na2SiO3,由于Na2SiO3溶液有良好的黏结性使瓶口与瓶塞黏在一起而难以开启。故凡是盛放碱性溶液的玻璃试剂瓶,均不可用玻璃塞,而要用橡皮塞、塑料塞或软木塞。为什么实验室中盛放NaOH溶液的试剂瓶要用橡皮塞而不能用玻璃塞?c. 在高温下,SiO2与碱性氧化物反应生成盐d. 在一定条件下,SiO2显现出弱氧化性2、硅酸(H2SiO3) SiO2对应水化物是硅酸,SiO2是硅酸的酸酐(1)制法:由于SiO2不溶于水,所以硅酸只能通过可溶性硅酸盐与其它酸反应制得Na2SiO3+2HCl=H2SiO3?+2NaClSiO32-+2H+=H2SiO3?(2)硅酸为白色固体,难溶于水硅酸浓度较大时,就会形成“硅胶”(3)硅酸的酸性很弱,比H2CO3酸性还弱,与碱反应时只能与强碱反应H2SiO3+2NaOH=Na2SiO3+2H2OH2SiO3+2OH-=SiO32-+2H2O比较碳酸和硅酸的酸性,如何证明?Na2SiO3+CO2+H2O=Na2CO3+H2SiO3?(4)硅酸的热稳定性很弱,受热分解为二氧化硅和水A三、硅酸盐首先变干,后又燃烧仅是变干,而不燃烧Na2SiO3的水溶液可用作木材的防火剂硅酸钠(Na2SiO3)1、物理性质:白色固体,易溶于水;俗名水玻璃或泡花碱水玻璃是无色黏稠的液体,黏结性很强,是一种矿物胶2、化学性质:热稳定性强,易跟碳酸(CO2+H2O)及更强的酸反应Na2SiO3+CO2+H2O=H2SiO3?+Na2CO3Na2SiO3+2HCl=H2SiO3?+2NaCl硅酸盐的组成的表示方法
(1)盐化学法——组成简单的硅酸盐
如硅酸钠(Na2SiO3)、硅酸钙(CaSiO3)
(2)氧化物法
如:高岭石Al2O3·2SiO2·2H2O
练习:例1 某硅酸盐化学式为Mg2Si3O8·n H2O试用氧化物形式表示其组成
例2 正长石的组成表示为KAlSi3Ox,
则x= 用氧化物的形式表示,其组成为为什么土壤具有保肥能力? 硅酸盐长期在水的侵蚀下,风化为黏土,并形成土壤胶体土壤胶体一般带负电,能吸收NH4+、K+等数十种生物所需的营养离子,元代的精美瓷器硅酸盐材料 水泥玻璃陶瓷单晶硅
无机非金属材料的主角—硅一、硅和碳最外层电子数相同,都有4个电子,化学性质相似1、硅:在常温下,化学性质不活泼,除F2、HF酸和强碱外,不跟其它物质起反应Si+2F2=SiF4 Si+4HF=SiF4+2H2? Si+2NaOH+H2O=Na2SiO3+2H2?2、碳:在常温下,化学性质不活泼,随着温度升高,碳的活动性大大增强3、硅的制法、存在及用途(2)存在:自然界中,只以化合态在(SiO2或硅酸盐的形式存在)存在于地壳的矿物和岩石里,在地壳中,硅的含量居第二位
(3)用途:硅是重要的半导体材料,在电子工业上有广泛的用途二、二氧化硅(SiO2)1、SiO2的结构 地球上存在的天然二氧化硅称为硅石,约占地壳质量的12%,其存在形态有结晶形和无定形两种2、二氧化硅的存在和用途玛瑙存在:
硅石 玛瑙 水晶 石英
分为:晶体(石英和水晶)
无定形(硅藻土)
3、SiO2的性质(1)物理性质SiO2是坚硬难熔的固体,不溶于水,纯净的SiO2晶体无色透明(2)化学性质a. SiO2的化学性质不活泼,只能与HF酸反应SiO2+4HF=SiF4?+2H2O思考为什么可用氢氟酸雕刻玻璃?用什么容器来盛HF酸? 因为玻璃中含有SiO2,而SiO2可以跟HF酸发生反应,所以HF酸可以腐蚀玻璃,从而可用氢氟酸雕刻玻璃;故不能用玻璃瓶盛HF酸,而用塑料瓶。b. SiO2是酸性氧化物:在常温下与强碱溶液发生反应,生成盐和水SiO2+2NaOH=Na2SiO3+H2O 当玻璃瓶配玻璃塞时,瓶口内壁和瓶塞外壁都进行了磨砂处理。玻璃中含有SiO2,磨砂玻璃遇到强碱溶液时,SiO2与强碱 NaOH溶液反应生成了硅酸盐Na2SiO3,由于Na2SiO3溶液有良好的黏结性使瓶口与瓶塞黏在一起而难以开启。故凡是盛放碱性溶液的玻璃试剂瓶,均不可用玻璃塞,而要用橡皮塞、塑料塞或软木塞。为什么实验室中盛放NaOH溶液的试剂瓶要用橡皮塞而不能用玻璃塞?c. 在高温下,SiO2与碱性氧化物反应生成盐d. 在一定条件下,SiO2显现出弱氧化性2、硅酸(H2SiO3) SiO2对应水化物是硅酸,SiO2是硅酸的酸酐(1)制法:由于SiO2不溶于水,所以硅酸只能通过可溶性硅酸盐与其它酸反应制得Na2SiO3+2HCl=H2SiO3?+2NaClSiO32-+2H+=H2SiO3?(2)硅酸为白色固体,难溶于水硅酸浓度较大时,就会形成“硅胶”(3)硅酸的酸性很弱,比H2CO3酸性还弱,与碱反应时只能与强碱反应H2SiO3+2NaOH=Na2SiO3+2H2OH2SiO3+2OH-=SiO32-+2H2O比较碳酸和硅酸的酸性,如何证明?Na2SiO3+CO2+H2O=Na2CO3+H2SiO3?(4)硅酸的热稳定性很弱,受热分解为二氧化硅和水A三、硅酸盐首先变干,后又燃烧仅是变干,而不燃烧Na2SiO3的水溶液可用作木材的防火剂硅酸钠(Na2SiO3)1、物理性质:白色固体,易溶于水;俗名水玻璃或泡花碱水玻璃是无色黏稠的液体,黏结性很强,是一种矿物胶2、化学性质:热稳定性强,易跟碳酸(CO2+H2O)及更强的酸反应Na2SiO3+CO2+H2O=H2SiO3?+Na2CO3Na2SiO3+2HCl=H2SiO3?+2NaCl硅酸盐的组成的表示方法
(1)盐化学法——组成简单的硅酸盐
如硅酸钠(Na2SiO3)、硅酸钙(CaSiO3)
(2)氧化物法
如:高岭石Al2O3·2SiO2·2H2O
练习:例1 某硅酸盐化学式为Mg2Si3O8·n H2O试用氧化物形式表示其组成
例2 正长石的组成表示为KAlSi3Ox,
则x= 用氧化物的形式表示,其组成为为什么土壤具有保肥能力? 硅酸盐长期在水的侵蚀下,风化为黏土,并形成土壤胶体土壤胶体一般带负电,能吸收NH4+、K+等数十种生物所需的营养离子,元代的精美瓷器硅酸盐材料 水泥玻璃陶瓷单晶硅
