氯气的实验室制法[上学期]
文档属性
| 名称 | 氯气的实验室制法[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 855.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2007-01-12 00:00:00 | ||
图片预览





文档简介
课件22张PPT。氯气有哪些主要的性质和用途氯气能与金属、非金属、水、碱等物质反应。
用途:消毒、制漂白粉,以及农药、化肥等。结构决定性质,
性质决定用途。氯气的实验室制法1、原料MnO2(固)、浓盐酸(液)1.稀盐酸与二氧化锰不反应。
2.此反应必须加热
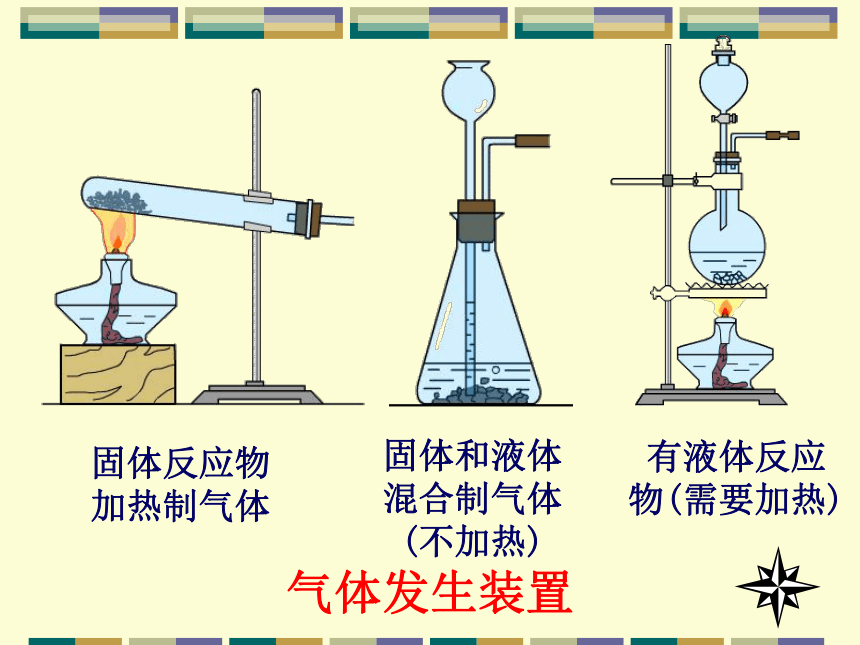
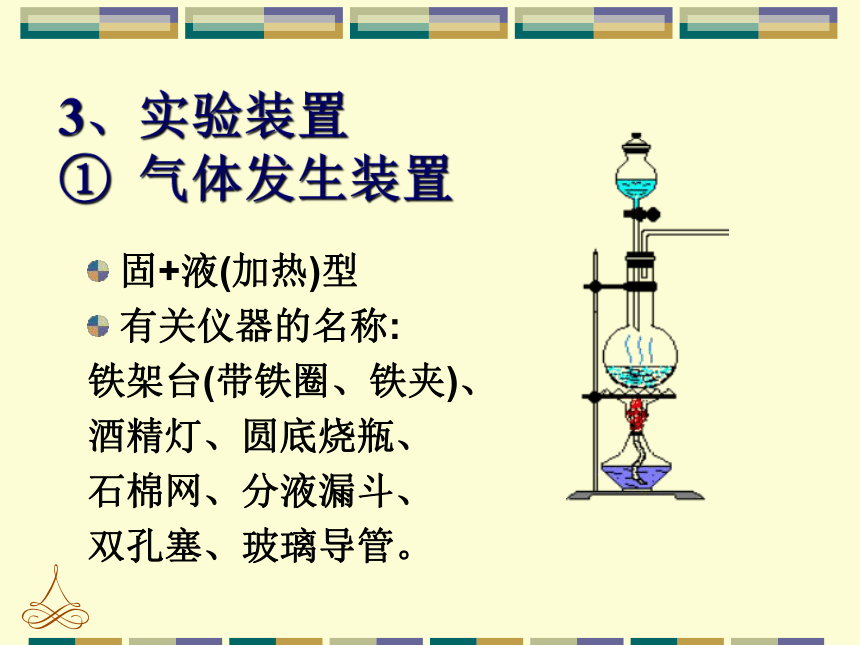
3.二氧化锰为难溶于水的黑色固体。 。2、反应原理实验室制备气体装置固体反应物加热制气体固体和液体混合制气体(不加热)有液体反应物(需要加热)气体发生装置固+液(加热)型
有关仪器的名称:
铁架台(带铁圈、铁夹)、
酒精灯、圆底烧瓶、
石棉网、分液漏斗、
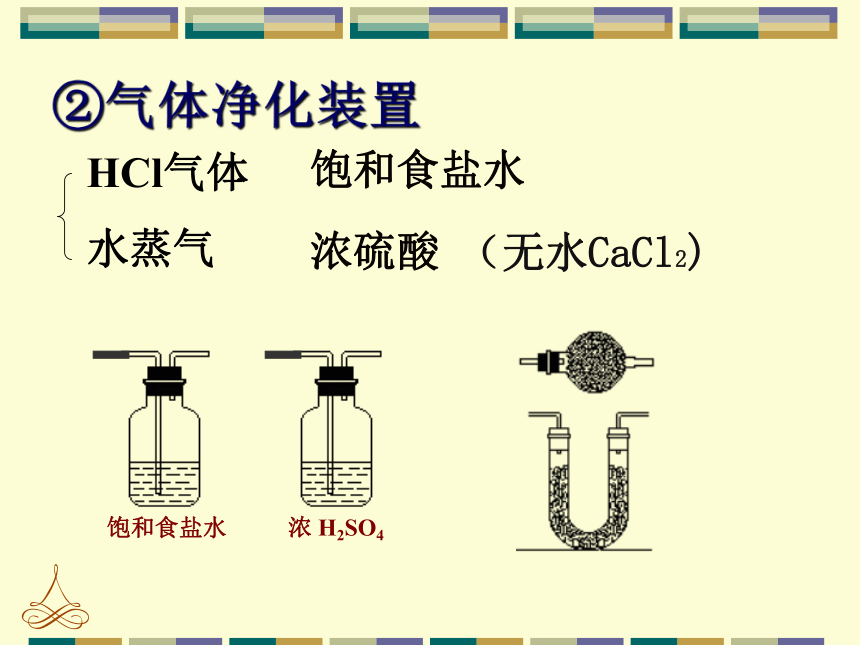
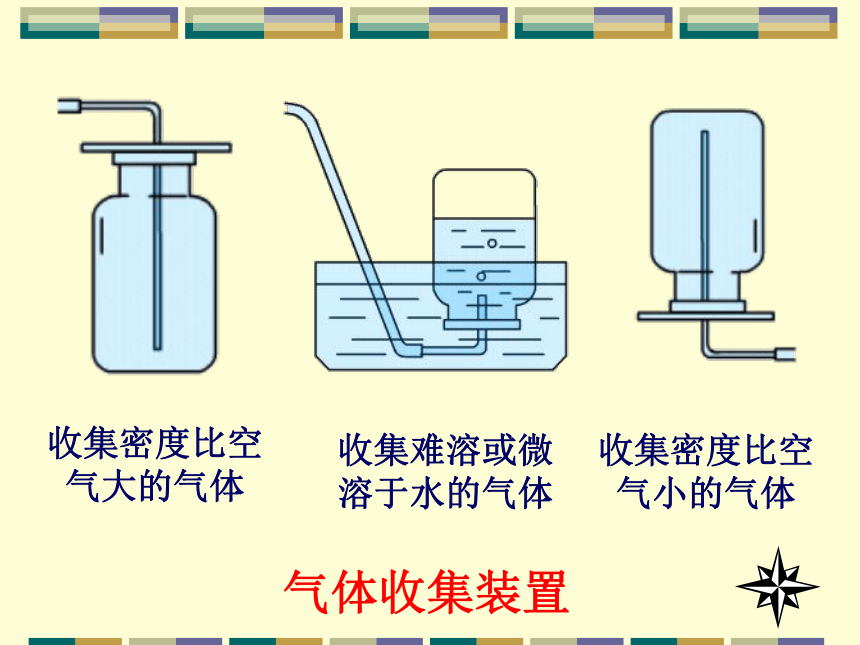
双孔塞、玻璃导管。3、实验装置 ① 气体发生装置水蒸气②气体净化装置HCl气体(无水CaCl2)收集密度比空气大的气体收集难溶或微溶于水的气体收集密度比空气小的气体气体收集装置b. 排饱和食盐水法③气体收集装置方法:a. 向上排空气法难以吸收的可燃气体可以点燃处理吸收气体 少量尾气可以集于气球中尾气处理装置④尾气处理装置 Cl2 + 2NaOH == NaCl + NaClO + H2O ①长颈漏斗应改成分液漏斗.
②烧瓶下应垫石棉网.
③应用酒精灯加热.
④稀盐酸应改为浓盐酸.
⑤多余Cl2应通入NaOH溶液中1、该制氯气的装置图中有哪几处是错误的?
应怎样改正?实验装置图2、实验室制氯气时有如下操作,操作顺序
正确的是 ( )
①连接好装置,检查气密性
②缓缓加热,加快反应,使气体均匀逸出
③在烧瓶中加入二氧化锰粉末
④往分液漏斗中加入浓盐酸,再缓缓滴入烧瓶中
⑤用向上排空气法收集氯气,尾气导入吸收剂中
A ①②③④⑤ B ④③①②⑤
C ①③④②⑤ D ①④③②⑤C答:浓盐酸有较强的挥发性,若加强热会使氯气中有大量的氯化氢杂质,另外也降低了HCl的利用率。答:Ca(OH)2微溶于水,用石灰水吸收效果不好。答:①颜色;
②湿润的紫色石蕊试纸;
③湿润的有色布条;
④湿润的淀粉KI试纸。④湿润的淀粉KI试纸。
实验室制氯气:
1、原料
2、原理
3、实验装置
4、验满方法MnO2(固体)、浓盐酸(液体) △
MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O小 结用湿润的淀粉KI试纸根据反应物的状态和
反应条件为思路选用
气体的发生装置。根据气体的水溶性和对空气的相对密度选用收集装置。尾气有毒或污
染空气,不能
直接排空,需
要尾气处理。向上排空气法
向下排空气法
排液法点燃、
用试剂吸收、气球收集 1、根据下面给出的实验室制HCl和NH3 的
反应原理分别设计制备气体的发生装置
2NaCl(s)+H2SO4(浓) = Na2SO4+2HCl↑
Ca(OH)2 (s) +2NH4Cl (s) = CaCl2+2H2O+2NH3↑作业:△△2、《优化设计》相关练习
3、预习第二节《卤族元素》再见
GOODBYE
用途:消毒、制漂白粉,以及农药、化肥等。结构决定性质,
性质决定用途。氯气的实验室制法1、原料MnO2(固)、浓盐酸(液)1.稀盐酸与二氧化锰不反应。
2.此反应必须加热
3.二氧化锰为难溶于水的黑色固体。 。2、反应原理实验室制备气体装置固体反应物加热制气体固体和液体混合制气体(不加热)有液体反应物(需要加热)气体发生装置固+液(加热)型
有关仪器的名称:
铁架台(带铁圈、铁夹)、
酒精灯、圆底烧瓶、
石棉网、分液漏斗、
双孔塞、玻璃导管。3、实验装置 ① 气体发生装置水蒸气②气体净化装置HCl气体(无水CaCl2)收集密度比空气大的气体收集难溶或微溶于水的气体收集密度比空气小的气体气体收集装置b. 排饱和食盐水法③气体收集装置方法:a. 向上排空气法难以吸收的可燃气体可以点燃处理吸收气体 少量尾气可以集于气球中尾气处理装置④尾气处理装置 Cl2 + 2NaOH == NaCl + NaClO + H2O ①长颈漏斗应改成分液漏斗.
②烧瓶下应垫石棉网.
③应用酒精灯加热.
④稀盐酸应改为浓盐酸.
⑤多余Cl2应通入NaOH溶液中1、该制氯气的装置图中有哪几处是错误的?
应怎样改正?实验装置图2、实验室制氯气时有如下操作,操作顺序
正确的是 ( )
①连接好装置,检查气密性
②缓缓加热,加快反应,使气体均匀逸出
③在烧瓶中加入二氧化锰粉末
④往分液漏斗中加入浓盐酸,再缓缓滴入烧瓶中
⑤用向上排空气法收集氯气,尾气导入吸收剂中
A ①②③④⑤ B ④③①②⑤
C ①③④②⑤ D ①④③②⑤C答:浓盐酸有较强的挥发性,若加强热会使氯气中有大量的氯化氢杂质,另外也降低了HCl的利用率。答:Ca(OH)2微溶于水,用石灰水吸收效果不好。答:①颜色;
②湿润的紫色石蕊试纸;
③湿润的有色布条;
④湿润的淀粉KI试纸。④湿润的淀粉KI试纸。
实验室制氯气:
1、原料
2、原理
3、实验装置
4、验满方法MnO2(固体)、浓盐酸(液体) △
MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O小 结用湿润的淀粉KI试纸根据反应物的状态和
反应条件为思路选用
气体的发生装置。根据气体的水溶性和对空气的相对密度选用收集装置。尾气有毒或污
染空气,不能
直接排空,需
要尾气处理。向上排空气法
向下排空气法
排液法点燃、
用试剂吸收、气球收集 1、根据下面给出的实验室制HCl和NH3 的
反应原理分别设计制备气体的发生装置
2NaCl(s)+H2SO4(浓) = Na2SO4+2HCl↑
Ca(OH)2 (s) +2NH4Cl (s) = CaCl2+2H2O+2NH3↑作业:△△2、《优化设计》相关练习
3、预习第二节《卤族元素》再见
GOODBYE
