第四章第二节 富集在海水中的元素-氯[上学期]
文档属性
| 名称 | 第四章第二节 富集在海水中的元素-氯[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 171.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2005-12-03 00:00:00 | ||
图片预览






文档简介
课件27张PPT。 第二节
富集在海水中的元素----氯Cl2*小知识: 海水中的盐类1、地球的表面积有多少是被海洋覆盖的? -------约71%
2、海水能直接饮用吗?为什么? ------不能直接饮用,因为海水中含有多 种盐类,使海水又咸又苦。
3、海洋中的盐类主要有那几种?平均含量是多少?------主要是NaCl 及MgCl2、MgSO4等;
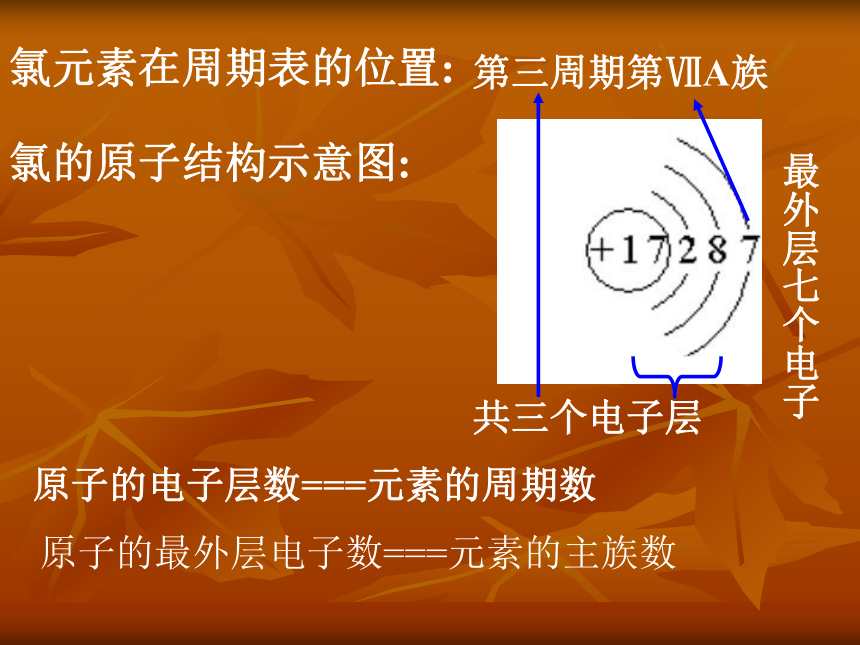
含量约占海水的3%氯元素在周期表的位置:第三周期第ⅦA族氯的原子结构示意图:共三个电子层最外层七个电子原子的电子层数===元素的周期数原子的最外层电子数===元素的主族数一、活泼的黄绿色气体:氯气*科学史话(P70):氯气的发现和确认
(1)最早发现氯气的化学家:舍勒
(2)最早确认氯气是新元素单质的化学家:戴维
*思考与交流(P71):
1、从氯气的发现到确认为一种新的元素,时间长达三十多年。你从这一史实中得到什么启示?
P71 思考与交流1、从氯气的发现到确认为一种新的元素,时间长达三十多年。你从这一史实中得到什么启示?启示 1. 科学研究需要有正确的理论指导启示 2. 科学研究需要以大量事实为根据启示 3. 科学研究需要有热爱科学的思想
和奉献 科学的精神2、舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。请写出舍勒发现氯气的化学方程式:MnO2 + 4HCl ===MnCl2 + 2H2O + Cl2一、活泼的黄绿色气体:氯气
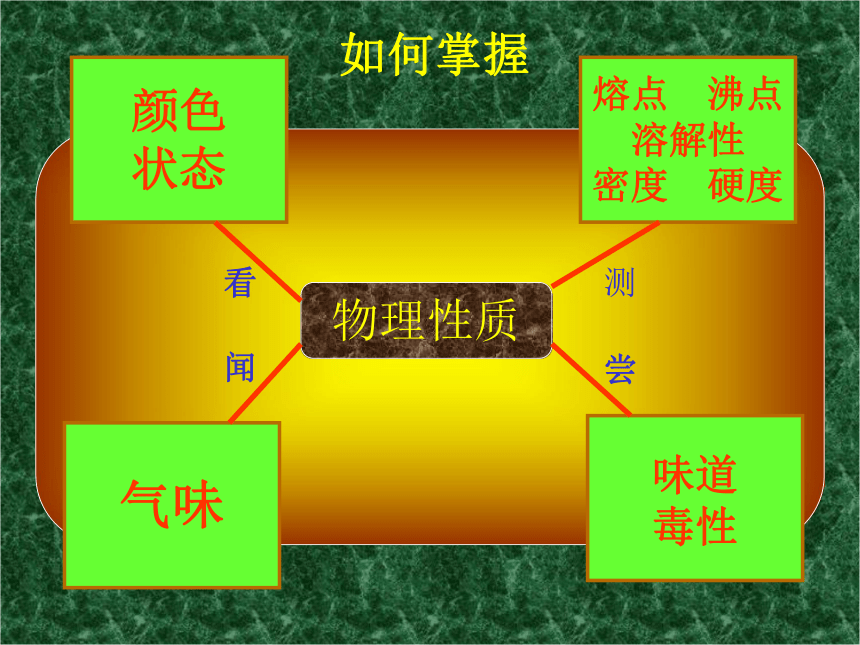
Cl2的物理性质Cl2的化学性质与金属反应与非金属反应与水的反应与NaOH的反应氯离子(Cl-)的检验物理性质颜色
状态
味道
毒性
气味熔点 沸点
溶解性
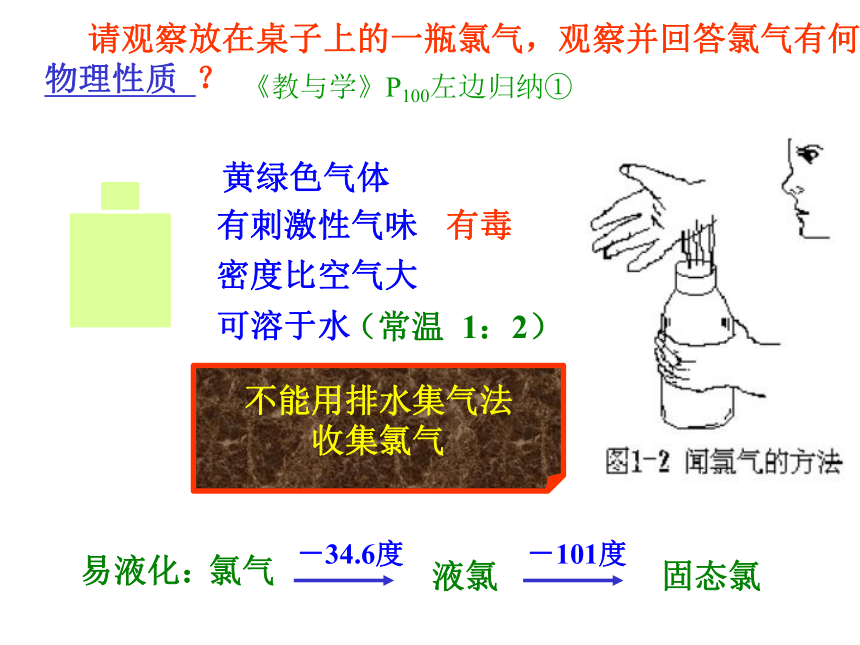
密度 硬度看尝闻测如何掌握 请观察放在桌子上的一瓶氯气,观察并回答氯气有何 物理性质 ?不能用排水集气法
收集氯气黄绿色气体有刺激性气味有毒密度比空气大可溶于水(常温 1:2)氯气液氯固态氯-34.6度-101度易液化:《教与学》P100左边归纳①Cl222易断裂易得电子分子结构不稳定原子结构不稳定化学性质很活泼 (做氧化剂) 结构决定性质ClCl -返回氯气的化学性质1、与金属反应燃烧,黄光,白烟燃烧,棕黄色烟 注意:不生成 FeCl2燃烧,棕褐色的烟注:Cl2与金属反应,生成高价的金属氯化物《教与学》P100右边第5题氯气与钠反应氯气与铜的反应氯气与铁的反应氯气的化学性质2、与非金属反应 P71 实验4-3:氢在氯气中燃烧H2 +Cl2 ===2HCl点燃安静燃烧,苍白色火焰,瓶口有白雾,有刺激性气味气体生成思考与交流通过氢气在氯气中燃烧的验,你对燃烧的条件及本质有什么新的认识? 可燃物跟空气中的氧气发生的一种发光发热的剧烈
的氧化反应叫做燃烧。(初中课本) 可燃物是否一定有氧气才能燃烧呢? 金属钠、铜和铁,非金属氢气等都可以在氯气中燃烧,这四个反应有何相同的现象? 的剧烈的化学反应叫做燃烧。任何发光发热想一想燃烧的本质:是氧化还原反应可燃物、助燃剂、着火点点燃和燃烧有何区别? 点燃是一种反应条件 燃烧是一种剧烈的化学反应,特点是有发光发
热的现象。 在化学方程式等号的上方或下方
书写的是反应条件,因此只能写点燃
而不能写燃烧。白烟棕黄色的烟苍白色火焰、
白雾爆炸反应装置及主要现象描述反应现象要注意的事项:烟-固体小颗粒分散在空气中雾-小液滴分散在空气中2. 不要把现象和结果混淆不要说成是:有氯化铜生成。(这是反应的结果)1. 区分烟和雾:氯气与铜反应的现象是:有棕黄色的烟产生返回*学与问:(P72)你是否偶尔碰到过这样的情形:打开自来水龙头,会闻到一股刺激性的气味。你想过这是什么原因吗?
——因为自来水厂常用Cl2进行消毒,所以自来水中溶解有少量的氯气,有刺激性气味。氯气溶于水为什么能杀菌消毒呢?氯气的化学性质3、氯气与水的反应
Cl2 + H2O = HCl + HClO (次氯酸)
氯气的水溶液称为“氯水”
氯水的成分:
*次氯酸(HClO)具强氧性(漂白作用)
*次氯酸是一种弱酸,不稳定:
2HClO == 2HCl + O2↑光照三分子: Cl2 、 H2O 、 HClO 四离子:H+、 Cl- 、 ClO - 、OH-氯水是混合物液氯是纯净物实验4-4:氯水的漂白作用 将有色纸条或布条、有色花瓣放入盛有1/3容积新制氯水的广口瓶中,盖上玻璃片,观察现象。有色纸条褪色氯气与水反应生成次氯酸,次氯酸有漂白性*实验4-5:干燥的氯气能否漂白物质 将有色纸条或布条、有色花辨放入盛满干燥氯气的集气瓶中,盖上玻璃片,观察现象。返回有色纸条不褪色干燥的氯气没有漂白性1班氯气的化学性质4、与碱的反应
Cl2 + 2NaOH = NaCl + NaClO + H2O
次氯酸钠
*漂白液的有效成份是NaClO
*次氯酸盐比次氯酸稳定,容易储运。工业上就是利用氯气和碱生成稳定的次氯酸盐,制成用于自来水杀菌消毒的漂白粉和漂粉精,它们的有效成份就是次氯酸钙。
2Ca(OH)2 + 2Cl2 = Ca(ClO)2 + CaCl2 + 2H2O
消石灰 ( 漂白粉)课本P75 习题 3、4、*小知识:次氯酸盐的用途(1)漂白液、漂白粉和漂粉精既可作漂白棉、麻、纸张的漂白剂,又可用作游泳池及环境(如医院)的消毒剂。
(2)漂白原理:
在潮湿空气中: Ca(ClO)2 吸收 CO2 和 H2O
Ca(ClO)2 +CO2 + H2O = CaCO3 + 2HClO
(3)保存:密闭保存,注意防潮湿。返回课本P75 5、3班二、氯离子的检验P74实验4-6:内容略 均有白色沉淀无白色沉淀沉淀不溶解沉淀不溶解沉淀不溶解沉淀溶解有气泡无现象生成AgCl不溶于硝酸生成AgCl不溶于硝酸生成AgCl不溶于硝酸生成碳酸银溶于硝酸并有二氧化碳生成蒸馏水没有Cl-离子二、氯离子的检验(1)检验氯离子时,为什么滴加AgNO3溶液后还要再加稀硝酸呢?
课本P76 习题9科学视野:成盐元素--卤素1、所含元素:
氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At)
2、周期表位置:第ⅦA族
3、原子结构特征:最外电子层都有7个电子
4、卤素单质:均为双原子分子
5、单质活泼性:F2 > Cl2 > Br2 > I2
6、卤素单质与氢气的反应:
H2 + X2 = 2HX
7、卤素单质与水的反应:
2F2 + 2H2O = 4HF + O2
X2 + H2O = HX + HXO
课本P76 习题10作业 P75 习题1、7、8
富集在海水中的元素----氯Cl2*小知识: 海水中的盐类1、地球的表面积有多少是被海洋覆盖的? -------约71%
2、海水能直接饮用吗?为什么? ------不能直接饮用,因为海水中含有多 种盐类,使海水又咸又苦。
3、海洋中的盐类主要有那几种?平均含量是多少?------主要是NaCl 及MgCl2、MgSO4等;
含量约占海水的3%氯元素在周期表的位置:第三周期第ⅦA族氯的原子结构示意图:共三个电子层最外层七个电子原子的电子层数===元素的周期数原子的最外层电子数===元素的主族数一、活泼的黄绿色气体:氯气*科学史话(P70):氯气的发现和确认
(1)最早发现氯气的化学家:舍勒
(2)最早确认氯气是新元素单质的化学家:戴维
*思考与交流(P71):
1、从氯气的发现到确认为一种新的元素,时间长达三十多年。你从这一史实中得到什么启示?
P71 思考与交流1、从氯气的发现到确认为一种新的元素,时间长达三十多年。你从这一史实中得到什么启示?启示 1. 科学研究需要有正确的理论指导启示 2. 科学研究需要以大量事实为根据启示 3. 科学研究需要有热爱科学的思想
和奉献 科学的精神2、舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一。请写出舍勒发现氯气的化学方程式:MnO2 + 4HCl ===MnCl2 + 2H2O + Cl2一、活泼的黄绿色气体:氯气
Cl2的物理性质Cl2的化学性质与金属反应与非金属反应与水的反应与NaOH的反应氯离子(Cl-)的检验物理性质颜色
状态
味道
毒性
气味熔点 沸点
溶解性
密度 硬度看尝闻测如何掌握 请观察放在桌子上的一瓶氯气,观察并回答氯气有何 物理性质 ?不能用排水集气法
收集氯气黄绿色气体有刺激性气味有毒密度比空气大可溶于水(常温 1:2)氯气液氯固态氯-34.6度-101度易液化:《教与学》P100左边归纳①Cl222易断裂易得电子分子结构不稳定原子结构不稳定化学性质很活泼 (做氧化剂) 结构决定性质ClCl -返回氯气的化学性质1、与金属反应燃烧,黄光,白烟燃烧,棕黄色烟 注意:不生成 FeCl2燃烧,棕褐色的烟注:Cl2与金属反应,生成高价的金属氯化物《教与学》P100右边第5题氯气与钠反应氯气与铜的反应氯气与铁的反应氯气的化学性质2、与非金属反应 P71 实验4-3:氢在氯气中燃烧H2 +Cl2 ===2HCl点燃安静燃烧,苍白色火焰,瓶口有白雾,有刺激性气味气体生成思考与交流通过氢气在氯气中燃烧的验,你对燃烧的条件及本质有什么新的认识? 可燃物跟空气中的氧气发生的一种发光发热的剧烈
的氧化反应叫做燃烧。(初中课本) 可燃物是否一定有氧气才能燃烧呢? 金属钠、铜和铁,非金属氢气等都可以在氯气中燃烧,这四个反应有何相同的现象? 的剧烈的化学反应叫做燃烧。任何发光发热想一想燃烧的本质:是氧化还原反应可燃物、助燃剂、着火点点燃和燃烧有何区别? 点燃是一种反应条件 燃烧是一种剧烈的化学反应,特点是有发光发
热的现象。 在化学方程式等号的上方或下方
书写的是反应条件,因此只能写点燃
而不能写燃烧。白烟棕黄色的烟苍白色火焰、
白雾爆炸反应装置及主要现象描述反应现象要注意的事项:烟-固体小颗粒分散在空气中雾-小液滴分散在空气中2. 不要把现象和结果混淆不要说成是:有氯化铜生成。(这是反应的结果)1. 区分烟和雾:氯气与铜反应的现象是:有棕黄色的烟产生返回*学与问:(P72)你是否偶尔碰到过这样的情形:打开自来水龙头,会闻到一股刺激性的气味。你想过这是什么原因吗?
——因为自来水厂常用Cl2进行消毒,所以自来水中溶解有少量的氯气,有刺激性气味。氯气溶于水为什么能杀菌消毒呢?氯气的化学性质3、氯气与水的反应
Cl2 + H2O = HCl + HClO (次氯酸)
氯气的水溶液称为“氯水”
氯水的成分:
*次氯酸(HClO)具强氧性(漂白作用)
*次氯酸是一种弱酸,不稳定:
2HClO == 2HCl + O2↑光照三分子: Cl2 、 H2O 、 HClO 四离子:H+、 Cl- 、 ClO - 、OH-氯水是混合物液氯是纯净物实验4-4:氯水的漂白作用 将有色纸条或布条、有色花瓣放入盛有1/3容积新制氯水的广口瓶中,盖上玻璃片,观察现象。有色纸条褪色氯气与水反应生成次氯酸,次氯酸有漂白性*实验4-5:干燥的氯气能否漂白物质 将有色纸条或布条、有色花辨放入盛满干燥氯气的集气瓶中,盖上玻璃片,观察现象。返回有色纸条不褪色干燥的氯气没有漂白性1班氯气的化学性质4、与碱的反应
Cl2 + 2NaOH = NaCl + NaClO + H2O
次氯酸钠
*漂白液的有效成份是NaClO
*次氯酸盐比次氯酸稳定,容易储运。工业上就是利用氯气和碱生成稳定的次氯酸盐,制成用于自来水杀菌消毒的漂白粉和漂粉精,它们的有效成份就是次氯酸钙。
2Ca(OH)2 + 2Cl2 = Ca(ClO)2 + CaCl2 + 2H2O
消石灰 ( 漂白粉)课本P75 习题 3、4、*小知识:次氯酸盐的用途(1)漂白液、漂白粉和漂粉精既可作漂白棉、麻、纸张的漂白剂,又可用作游泳池及环境(如医院)的消毒剂。
(2)漂白原理:
在潮湿空气中: Ca(ClO)2 吸收 CO2 和 H2O
Ca(ClO)2 +CO2 + H2O = CaCO3 + 2HClO
(3)保存:密闭保存,注意防潮湿。返回课本P75 5、3班二、氯离子的检验P74实验4-6:内容略 均有白色沉淀无白色沉淀沉淀不溶解沉淀不溶解沉淀不溶解沉淀溶解有气泡无现象生成AgCl不溶于硝酸生成AgCl不溶于硝酸生成AgCl不溶于硝酸生成碳酸银溶于硝酸并有二氧化碳生成蒸馏水没有Cl-离子二、氯离子的检验(1)检验氯离子时,为什么滴加AgNO3溶液后还要再加稀硝酸呢?
课本P76 习题9科学视野:成盐元素--卤素1、所含元素:
氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At)
2、周期表位置:第ⅦA族
3、原子结构特征:最外电子层都有7个电子
4、卤素单质:均为双原子分子
5、单质活泼性:F2 > Cl2 > Br2 > I2
6、卤素单质与氢气的反应:
H2 + X2 = 2HX
7、卤素单质与水的反应:
2F2 + 2H2O = 4HF + O2
X2 + H2O = HX + HXO
课本P76 习题10作业 P75 习题1、7、8
