氨气[上学期]
图片预览





文档简介
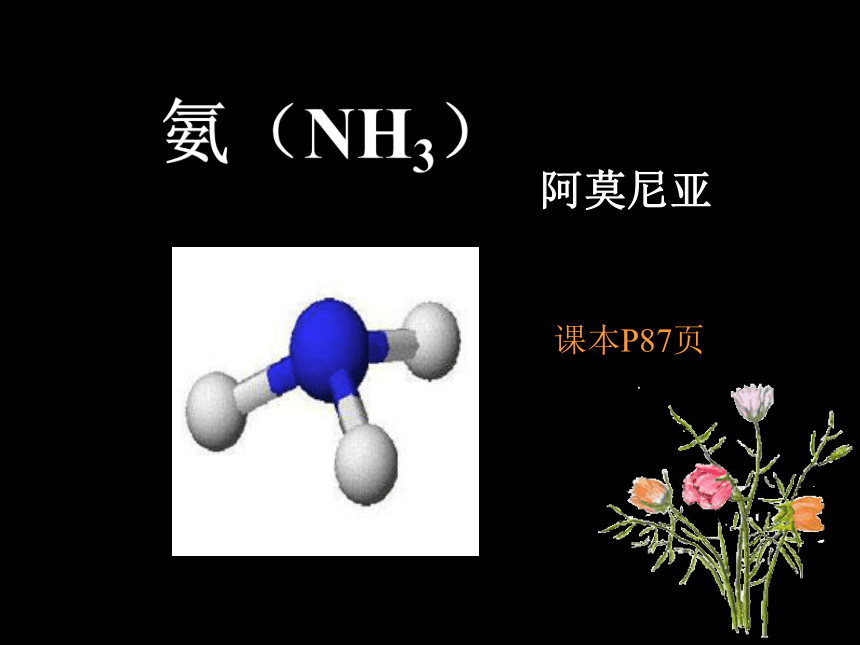
课件14张PPT。氨(NH3)课本P87页阿莫尼亚物理性质化学性质实验室制法用途1、物理性质:
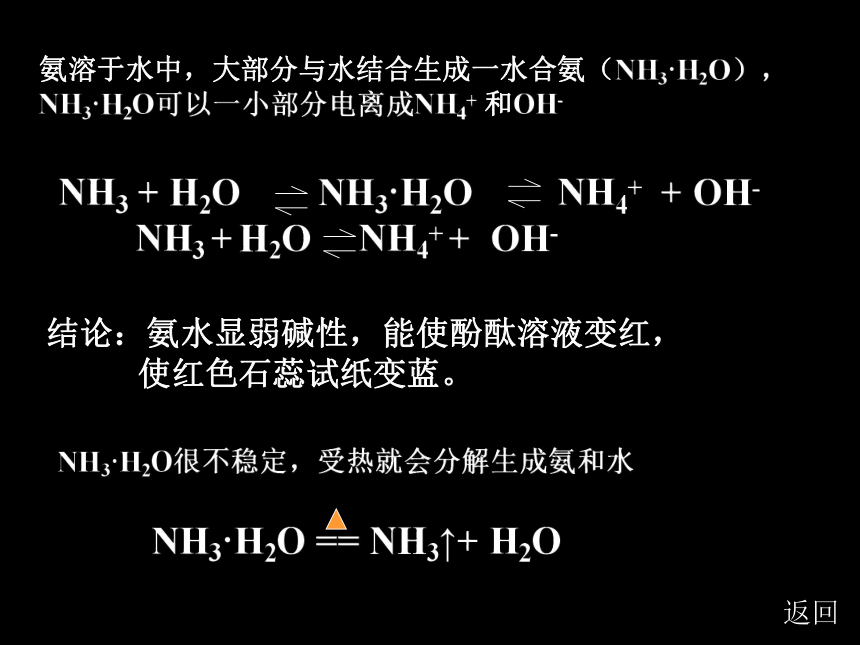
(1) 氨是一种无色、有刺激性气味的气体(3)极易溶于水(1:700),水溶液叫“氨水”(4)氨易液化→“液氨”,常作致冷剂返回(2)密度比空气小2、化学性质:(1)氨与水反应 (实验4-9)(2)氨与酸的反应返回NH3·H2O == NH3↑+ H2O氨溶于水中,大部分与水结合生成一水合氨(NH3·H2O), NH3·H2O可以一小部分电离成NH4+ 和OH-结论:氨水显弱碱性,能使酚酞溶液变红,
使红色石蕊试纸变蓝。NH3·H2O很不稳定,受热就会分解生成氨和水返回[实验4-9]根据现象,思考并回答下列问题:
(1)烧瓶内为什么会形成喷泉?
(2)溶液为什么变成红色?水由玻璃管进入烧瓶,形成美丽的喷泉,
液体呈红色
氨易溶于水,氨与水反应生成了氨水,
使溶液显碱性。
返回氨能跟酸化合而生成铵盐HCl + NH3 = NH4Cl
H2SO4 + 2NH3 = (NH4)2SO4
NH3+HNO3=NH4NO3实验(P87图4-32) 现象:解释:在两根玻璃棒之间产生白烟返回返回空瓶生烟在工农业生产上有重要的用途
大量的铵盐用作氮肥硝酸铵还用来制作药氯化铵常用于印染和制干电池,也用在金属焊接上,以除去金属表面上的氧化物薄层。
返回铵盐易溶于水受热易分解与碱反应放出氨气返回反应原理:
2NH4Cl + Ca(OH)2 = CaCl2 + 2H2O + 2NH3 ↑问题思考:
(1)试管要 如何安装?
(2)氨气只能用什么方法收集,为什么?
(3)收集的氨气如何检满,为什么?
( 4 ) 尾气能直接排放到空气中吗?返回*小知识:氨的用途注意短期内吸入大量氨气会引起中毒的 出现流泪、咽痛、声音嘶哑、咳嗽 ,
伴有头晕、头痛、恶心、呕吐、乏力等 处理 应迅速脱离现场, 至空气新鲜处,维持呼吸功能,卧床静息 ,给对症、支持治疗 。
(1) 氨是一种无色、有刺激性气味的气体(3)极易溶于水(1:700),水溶液叫“氨水”(4)氨易液化→“液氨”,常作致冷剂返回(2)密度比空气小2、化学性质:(1)氨与水反应 (实验4-9)(2)氨与酸的反应返回NH3·H2O == NH3↑+ H2O氨溶于水中,大部分与水结合生成一水合氨(NH3·H2O), NH3·H2O可以一小部分电离成NH4+ 和OH-结论:氨水显弱碱性,能使酚酞溶液变红,
使红色石蕊试纸变蓝。NH3·H2O很不稳定,受热就会分解生成氨和水返回[实验4-9]根据现象,思考并回答下列问题:
(1)烧瓶内为什么会形成喷泉?
(2)溶液为什么变成红色?水由玻璃管进入烧瓶,形成美丽的喷泉,
液体呈红色
氨易溶于水,氨与水反应生成了氨水,
使溶液显碱性。
返回氨能跟酸化合而生成铵盐HCl + NH3 = NH4Cl
H2SO4 + 2NH3 = (NH4)2SO4
NH3+HNO3=NH4NO3实验(P87图4-32) 现象:解释:在两根玻璃棒之间产生白烟返回返回空瓶生烟在工农业生产上有重要的用途
大量的铵盐用作氮肥硝酸铵还用来制作药氯化铵常用于印染和制干电池,也用在金属焊接上,以除去金属表面上的氧化物薄层。
返回铵盐易溶于水受热易分解与碱反应放出氨气返回反应原理:
2NH4Cl + Ca(OH)2 = CaCl2 + 2H2O + 2NH3 ↑问题思考:
(1)试管要 如何安装?
(2)氨气只能用什么方法收集,为什么?
(3)收集的氨气如何检满,为什么?
( 4 ) 尾气能直接排放到空气中吗?返回*小知识:氨的用途注意短期内吸入大量氨气会引起中毒的 出现流泪、咽痛、声音嘶哑、咳嗽 ,
伴有头晕、头痛、恶心、呕吐、乏力等 处理 应迅速脱离现场, 至空气新鲜处,维持呼吸功能,卧床静息 ,给对症、支持治疗 。
