硝酸[上学期]
图片预览








文档简介
课件32张PPT。第三节 硝酸NH →NO→NO →HNO ↑←←←←←NO323+硝酸是一种强酸,具有酸的通性,
能与碱及碱性氧化物等反应……硝酸又是一种强氧化性酸,它
与金属反应一般不生成氢气,……学习目标三.重点、难点:
硝酸的不稳定性
硝酸的强氧化性学习目标二.掌握硝酸的化性要了解1.纯HNO3是 色、易 ,有 气味一、物理性质 2.能与水任意比互溶. 3.纯HNO3的沸点是83℃,密度为1.5027g/cm3,常用浓硝酸质量分数为69%.挥发刺激性无的液体.质量分数为98%以上的硝酸为“发烟硝酸”。
二、化学性质1、硝酸具有酸的通性:硝酸是一元强酸二、化学性质2、硝酸的不稳定性:久置浓硝酸为什么呈黄色? 久置硝酸分解
产生的NO2溶于溶液
中,使得溶液变黄!硝酸应如何保存?密封于
棕色瓶中,并放在
阴暗处!1、硝酸具有酸的通性:一般而言,硝酸越浓,越不稳定。 由于HNO3中得N处在最高价,故硝酸
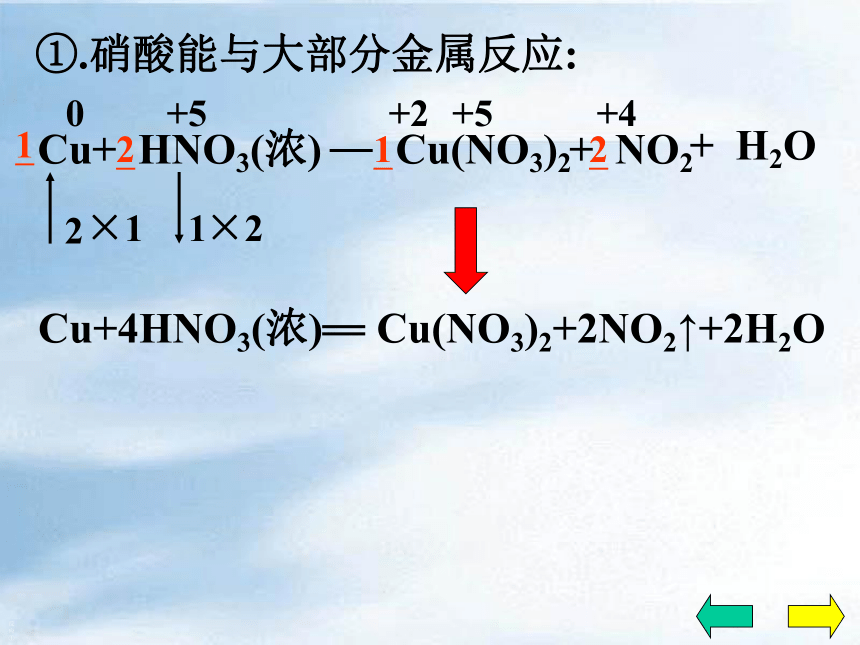
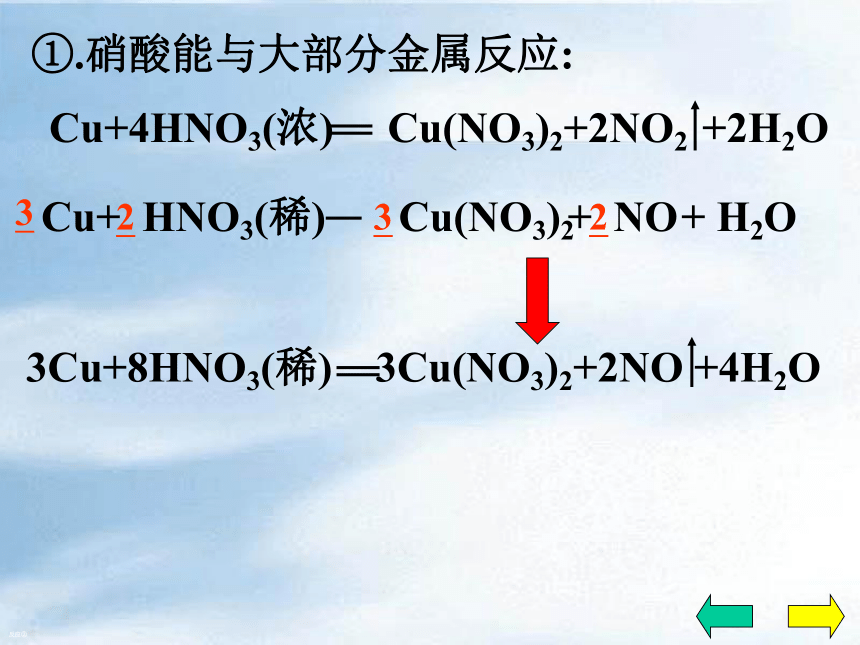
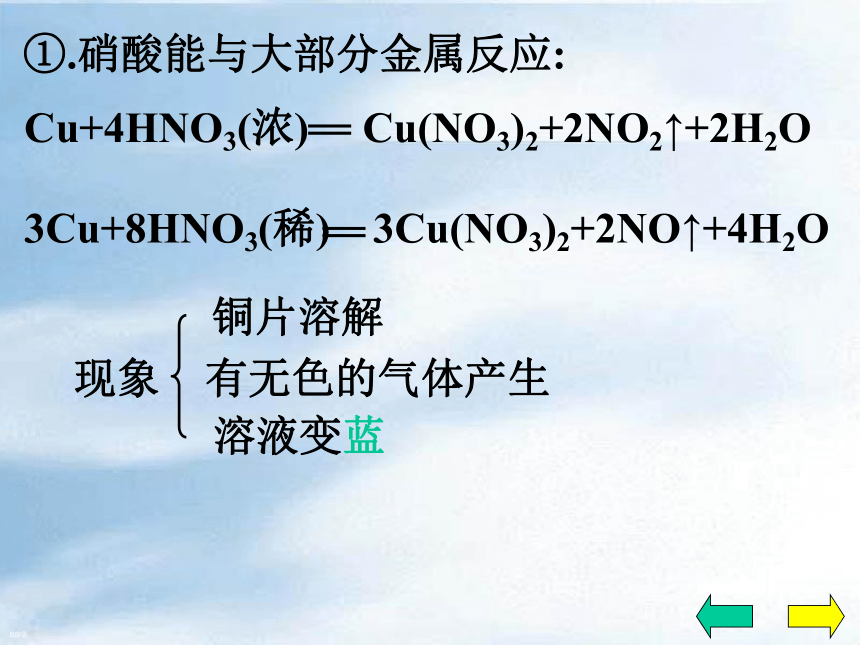
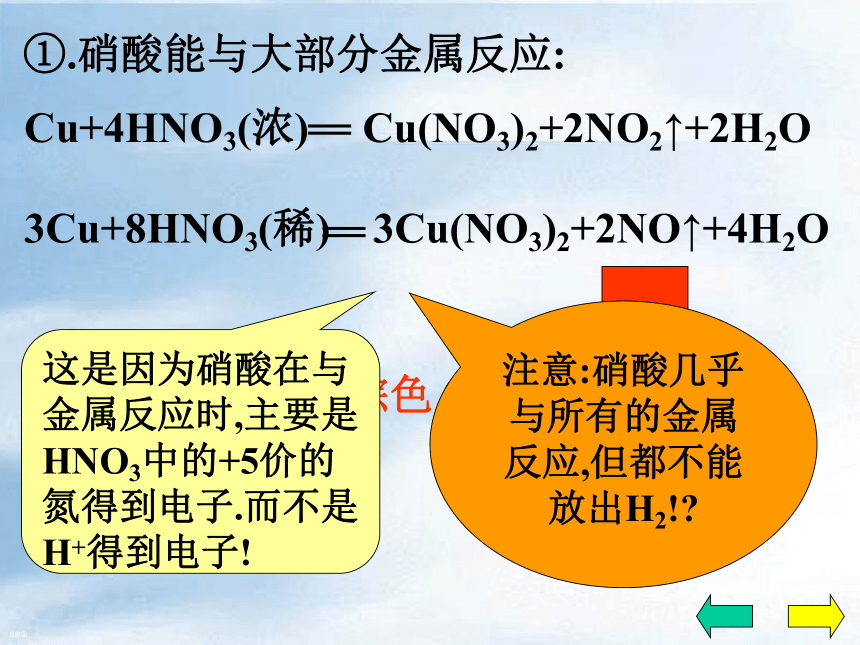
具有较强的得电子能力……二、化学性质1、酸的通性:2、不稳定性:3、强氧化性稀硝酸和浓硝酸都有强氧化性①.硝酸能与大部分金属反应:反应①0+2+5+5+4×1×2+ H2OCu(NO3)2+ NO2①.硝酸能与大部分金属反应:反应①1.HNO3的作用?2.离子方程式?n(氧化剂):n(酸)=1:1Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O①.硝酸能与大部分金属反应:现象溶液变蓝有红棕色的气体产生反应①铜片溶解,常温下反应剧烈①.硝酸能与大部分金属反应:反应② Cu(NO3)2+ NO+ H2O①.硝酸能与大部分金属反应:反应②现象溶液变蓝有无色的气体产生铜片溶解①.硝酸能与大部分金属反应:无色气体→红棕色 2NO+O2=2NO2反应②注意:硝酸几乎与所有的金属反应,但都不能放出H2!?这是因为硝酸在与金属反应时,主要是HNO3中的+5价的氮得到电子.而不是H+得到电子!①.硝酸能与大部分金属反应: 反应③Al、Fe等在浓硝酸中发生钝化现象硝酸几乎能与所有的金属发生氧化还原反应
除金、铂之外.但……反应④①.硝酸能与大部分金属反应: Al、Fe等在浓硝酸中发生钝化现象②.硝酸能与许多非金属反应:硝酸具有强氧化性,所以Fe2+ 、S2-、I-、SO32-
等一些还原性的物质不能与硝酸共存!☆NO3-很稳定,在中性和碱性溶液中几乎与所有的离子能共存,但在酸性溶液中,NO3-/H+
具有了强氧化性,与Fe2+、SO32-等不能共存! ☆例:Fe(NO3)2能在溶液中稳定存在,但如果在
溶液中加入盐酸,溶液将由浅绿色变为棕
黄色.这说明Fe2+被NO3-/H+氧化成了Fe3+.二、化学性质1、硝酸具有酸的通性:2、硝酸的不稳定性:3、硝酸的强氧化性①.硝酸能与大部分金属反应②.硝酸能与许多非金属反应应立即用大量的水冲洗,再用小苏打或肥皂洗涤.万一不慎将
浓硝酸弄到
皮肤上,应
如何处理?③.NO3-/H+也有强氧化性硝酸的用途硝酸是一种重要的化工原料,它可以
制造染料、炸药、硝酸盐,还可以做
塑料等。在实验室里,硝酸是一种重
要的化学试剂。练习1.纯HNO3是无色、易挥发,有刺激性气味
的液体.物理性质 2.能与水任意比互溶. 3.纯HNO3的沸点是83℃,密度为1.5027g/cm3,常用浓硝酸质量分数为69%.质量分数为98%以上的硝酸为发烟硝酸。总结1化学性质1、硝酸具有酸的通性:2、硝酸的不稳定性:3、硝酸的强氧化性①.硝酸能与大部分金属反应②.硝酸能与许多非金属反应总结2③.NO3-/H+也有强氧化性硝酸与金属反应的规律 (1)Fe、Al、等金属和稀HNO3能反应,但在冷的
浓HNO3中钝化。
(2)金属与硝酸反应时金属被氧化成相应的硝
酸盐,浓HNO3的还原产物一般是NO2,
稀HNO3还原产物一般是NO。
(3)浓HNO3不能氧化金和铂,但1体积浓HNO3
和3体积浓HCl组成的王水却能溶解金和铂。总结3谢谢,再见!句容市第三中学 吴林华
1.硝酸能使紫色的石蕊试液变红
2.硝酸能与某些金属氧化物起反应
2HNO3+CuO=Cu(NO3)2+H2O
3.硝酸能与某些盐起反应
2HNO3 +CaCO3=Ca(NO3)2+CO2 +H2O
4.硝酸能与碱起反应
HNO3+NaOH=NaNO3+H2O酸的通性发烟硝酸为什么?
硝酸虽具有强氧化性,但不能氧化金、
铂。但金、铂能被王水氧化,王水是浓HNO3
和浓HCl按1:3的体积比混合成的氧化性更
强的溶液.王水 有的金属如铝、铁等在冷的浓硝酸或浓硫酸
中会发生钝化现象,这是因为浓硝酸和浓硫酸把
它们的表面氧化成一层致密的氧化物薄膜,阻止
了反应的进一步进行.钝化使金属的化学活动性
大大降低,耐腐蚀性大大增强.因此在常温下可以
用铝槽车装运浓硝酸和浓硫酸.
钝 化.. 浓、稀HNO3分别与Cu反应,为何 不同?
还原产物不同是因为硝酸浓度和性质不同所致。
硝酸被铜还原时,首先生成亚硝酸,而亚硝酸不稳定,
分解成NO 2和NO:
2HNO2====NO2+NO+H2O
①因浓HNO3氧化性强,NO 被浓HNO3氧化成NO2:
NO+2HNO3(浓)====3NO2+H2O
②而稀HNO3氧化性相对弱些,不能将NO氧化.同时
NO2和NO在水中存在:
3NO2+H 2O====2HNO3+NO
故:浓HNO3的产物主要是NO2;硝酸稀的产物主要是NO。
产物随堂测试1.硝酸应如何贮存? 2.解释为什么实验室制H2可用稀盐酸或稀硫酸,而不能用稀的硝酸? 答:应放于棕色瓶中,储存于阴暗处.答:因为硝酸不论浓稀都具有强氧化性。
用金属与硝酸反应时,H+不能得到电子,
只能是HNO3中的N得到电子,故不能得到
氢气! 随堂测试3.如何洗净一支内壁镀银的试管? 答:用稀硝酸洗涤 课堂练习3.填空酸的通性不稳定性强氧化性5.下列关于硝酸正确的是( )
A.稀硝酸能与Fe发生反应,浓硝酸不能
B.浓硝酸和稀硝酸都是强氧化剂
C.稀硝酸是弱酸,浓硝酸是强酸
D. 稀硝酸与Cu反应,生成NO2,而浓硝酸
与Cu反应只生成NO,稀硝酸得电子
更多,故稀硝酸氧化性大于浓硝酸课堂练习4.常温下能用铝制容器盛放的是( )
A.浓盐酸 B.浓硝酸
C.浓硫酸 D.稀硝酸BCB足量的Cu中加入少量的浓硝酸,可能会发
生什么反应?反应停止后,如果在溶液中再加入足量盐酸
会出现什么情况?溶液中存在NO3-,它遇到H+后,会继续氧化
铜,当然此时NO3-/H+的溶度较稀.思考题思考题1、工业上拟用Cu与适量的硝酸来制备Cu(NO3)2
下面是三位同学提出的三个方案:甲:铜浓硝酸乙:铜稀硝酸丙:铜空气△硝酸请问:那一种方案最好?为什么?Cu(NO3)2Cu(NO3)2Cu(NO3)2CuO
能与碱及碱性氧化物等反应……硝酸又是一种强氧化性酸,它
与金属反应一般不生成氢气,……学习目标三.重点、难点:
硝酸的不稳定性
硝酸的强氧化性学习目标二.掌握硝酸的化性要了解1.纯HNO3是 色、易 ,有 气味一、物理性质 2.能与水任意比互溶. 3.纯HNO3的沸点是83℃,密度为1.5027g/cm3,常用浓硝酸质量分数为69%.挥发刺激性无的液体.质量分数为98%以上的硝酸为“发烟硝酸”。
二、化学性质1、硝酸具有酸的通性:硝酸是一元强酸二、化学性质2、硝酸的不稳定性:久置浓硝酸为什么呈黄色? 久置硝酸分解
产生的NO2溶于溶液
中,使得溶液变黄!硝酸应如何保存?密封于
棕色瓶中,并放在
阴暗处!1、硝酸具有酸的通性:一般而言,硝酸越浓,越不稳定。 由于HNO3中得N处在最高价,故硝酸
具有较强的得电子能力……二、化学性质1、酸的通性:2、不稳定性:3、强氧化性稀硝酸和浓硝酸都有强氧化性①.硝酸能与大部分金属反应:反应①0+2+5+5+4×1×2+ H2OCu(NO3)2+ NO2①.硝酸能与大部分金属反应:反应①1.HNO3的作用?2.离子方程式?n(氧化剂):n(酸)=1:1Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O①.硝酸能与大部分金属反应:现象溶液变蓝有红棕色的气体产生反应①铜片溶解,常温下反应剧烈①.硝酸能与大部分金属反应:反应② Cu(NO3)2+ NO+ H2O①.硝酸能与大部分金属反应:反应②现象溶液变蓝有无色的气体产生铜片溶解①.硝酸能与大部分金属反应:无色气体→红棕色 2NO+O2=2NO2反应②注意:硝酸几乎与所有的金属反应,但都不能放出H2!?这是因为硝酸在与金属反应时,主要是HNO3中的+5价的氮得到电子.而不是H+得到电子!①.硝酸能与大部分金属反应: 反应③Al、Fe等在浓硝酸中发生钝化现象硝酸几乎能与所有的金属发生氧化还原反应
除金、铂之外.但……反应④①.硝酸能与大部分金属反应: Al、Fe等在浓硝酸中发生钝化现象②.硝酸能与许多非金属反应:硝酸具有强氧化性,所以Fe2+ 、S2-、I-、SO32-
等一些还原性的物质不能与硝酸共存!☆NO3-很稳定,在中性和碱性溶液中几乎与所有的离子能共存,但在酸性溶液中,NO3-/H+
具有了强氧化性,与Fe2+、SO32-等不能共存! ☆例:Fe(NO3)2能在溶液中稳定存在,但如果在
溶液中加入盐酸,溶液将由浅绿色变为棕
黄色.这说明Fe2+被NO3-/H+氧化成了Fe3+.二、化学性质1、硝酸具有酸的通性:2、硝酸的不稳定性:3、硝酸的强氧化性①.硝酸能与大部分金属反应②.硝酸能与许多非金属反应应立即用大量的水冲洗,再用小苏打或肥皂洗涤.万一不慎将
浓硝酸弄到
皮肤上,应
如何处理?③.NO3-/H+也有强氧化性硝酸的用途硝酸是一种重要的化工原料,它可以
制造染料、炸药、硝酸盐,还可以做
塑料等。在实验室里,硝酸是一种重
要的化学试剂。练习1.纯HNO3是无色、易挥发,有刺激性气味
的液体.物理性质 2.能与水任意比互溶. 3.纯HNO3的沸点是83℃,密度为1.5027g/cm3,常用浓硝酸质量分数为69%.质量分数为98%以上的硝酸为发烟硝酸。总结1化学性质1、硝酸具有酸的通性:2、硝酸的不稳定性:3、硝酸的强氧化性①.硝酸能与大部分金属反应②.硝酸能与许多非金属反应总结2③.NO3-/H+也有强氧化性硝酸与金属反应的规律 (1)Fe、Al、等金属和稀HNO3能反应,但在冷的
浓HNO3中钝化。
(2)金属与硝酸反应时金属被氧化成相应的硝
酸盐,浓HNO3的还原产物一般是NO2,
稀HNO3还原产物一般是NO。
(3)浓HNO3不能氧化金和铂,但1体积浓HNO3
和3体积浓HCl组成的王水却能溶解金和铂。总结3谢谢,再见!句容市第三中学 吴林华
1.硝酸能使紫色的石蕊试液变红
2.硝酸能与某些金属氧化物起反应
2HNO3+CuO=Cu(NO3)2+H2O
3.硝酸能与某些盐起反应
2HNO3 +CaCO3=Ca(NO3)2+CO2 +H2O
4.硝酸能与碱起反应
HNO3+NaOH=NaNO3+H2O酸的通性发烟硝酸为什么?
硝酸虽具有强氧化性,但不能氧化金、
铂。但金、铂能被王水氧化,王水是浓HNO3
和浓HCl按1:3的体积比混合成的氧化性更
强的溶液.王水 有的金属如铝、铁等在冷的浓硝酸或浓硫酸
中会发生钝化现象,这是因为浓硝酸和浓硫酸把
它们的表面氧化成一层致密的氧化物薄膜,阻止
了反应的进一步进行.钝化使金属的化学活动性
大大降低,耐腐蚀性大大增强.因此在常温下可以
用铝槽车装运浓硝酸和浓硫酸.
钝 化.. 浓、稀HNO3分别与Cu反应,为何 不同?
还原产物不同是因为硝酸浓度和性质不同所致。
硝酸被铜还原时,首先生成亚硝酸,而亚硝酸不稳定,
分解成NO 2和NO:
2HNO2====NO2+NO+H2O
①因浓HNO3氧化性强,NO 被浓HNO3氧化成NO2:
NO+2HNO3(浓)====3NO2+H2O
②而稀HNO3氧化性相对弱些,不能将NO氧化.同时
NO2和NO在水中存在:
3NO2+H 2O====2HNO3+NO
故:浓HNO3的产物主要是NO2;硝酸稀的产物主要是NO。
产物随堂测试1.硝酸应如何贮存? 2.解释为什么实验室制H2可用稀盐酸或稀硫酸,而不能用稀的硝酸? 答:应放于棕色瓶中,储存于阴暗处.答:因为硝酸不论浓稀都具有强氧化性。
用金属与硝酸反应时,H+不能得到电子,
只能是HNO3中的N得到电子,故不能得到
氢气! 随堂测试3.如何洗净一支内壁镀银的试管? 答:用稀硝酸洗涤 课堂练习3.填空酸的通性不稳定性强氧化性5.下列关于硝酸正确的是( )
A.稀硝酸能与Fe发生反应,浓硝酸不能
B.浓硝酸和稀硝酸都是强氧化剂
C.稀硝酸是弱酸,浓硝酸是强酸
D. 稀硝酸与Cu反应,生成NO2,而浓硝酸
与Cu反应只生成NO,稀硝酸得电子
更多,故稀硝酸氧化性大于浓硝酸课堂练习4.常温下能用铝制容器盛放的是( )
A.浓盐酸 B.浓硝酸
C.浓硫酸 D.稀硝酸BCB足量的Cu中加入少量的浓硝酸,可能会发
生什么反应?反应停止后,如果在溶液中再加入足量盐酸
会出现什么情况?溶液中存在NO3-,它遇到H+后,会继续氧化
铜,当然此时NO3-/H+的溶度较稀.思考题思考题1、工业上拟用Cu与适量的硝酸来制备Cu(NO3)2
下面是三位同学提出的三个方案:甲:铜浓硝酸乙:铜稀硝酸丙:铜空气△硝酸请问:那一种方案最好?为什么?Cu(NO3)2Cu(NO3)2Cu(NO3)2CuO
