硫酸(第二课时)[下学期]
文档属性
| 名称 | 硫酸(第二课时)[下学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 361.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-05-14 00:00:00 | ||
图片预览






文档简介
课件18张PPT。第三节 硫 酸 (第二课时)复习:浓硫酸有哪些特性?
写出浓硫酸与碳、铜反应的
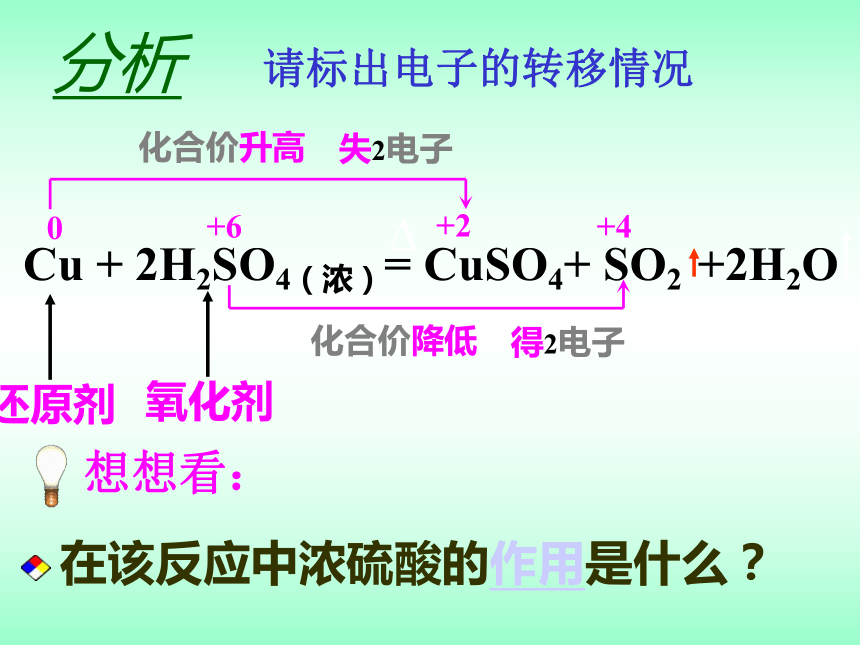
化学方程式。 想想看:Cu是H之后的较不活泼金属,那么H之前的金属是否就更容易被浓H2SO4氧化呢? 0+6+4+2化合价升高化合价降低 想想看:在该反应中浓硫酸的作用是什么?失2电子得2电子分析请标出电子的转移情况
注
意
⑴ 参加反应的硫酸只有一半被还原 ⑵ 在与铜的反应中,浓硫酸既表现出 氧化性,又表现出酸性。现象: 常温无明显变化,加热后能
反应。解释: 常温下,浓硫酸能使铁、铝等金
属表面生成一层致密的氧化物保护膜,
阻止内部金属继续跟硫酸起反应。此
现象称 “钝化”。
2、加热时—— 与绝大多数金属反应1、不产生 ,浓硫酸被 为 .—— 与活泼金属(如Zn)反应3、常温下发生钝化表面生成 .Al、Fe与 的 硫酸接触钝化条件:加热后:会剧烈反应H2还原SO2致密的氧化物薄膜冷浓浓硫酸与金属反应的规律:总结浓硫酸的特性⑴ 吸水性⑶ 强氧化性① 加热时浓硫酸能与大多数金属反应,但不生成氢气。常温下使铁铝钝化⑵ 脱水性Cu + 2H2SO4 (浓) = CuSO4 + SO2 + 2H2O△② 与某些非金属反应C + 2H2SO4 (浓) = CO2 + SO2 + 2H2O△③ 与硫化氢、溴化氢、碘化氢等还原剂反应H2S + H2SO4 (浓) = S + SO2 + 2H2O 在实验室中常用浓硫酸作气体的干燥剂。下列气体中,哪些不能用浓硫酸干燥?O2 (2) HCl (3) HBr (4) HI
(5) SO2 (6) H2S (7) NH3不能干燥溴化氢、碘化氢、硫化氢和氨气,因为:二、硫酸根离子的检验 有白色沉淀生成沉淀不溶解有白色沉淀生成沉淀不溶解有白色沉淀生成沉淀溶解产生气体小结:H2SO4和硫酸盐溶于水时都会产生SO42-,可以利用BaSO4的不溶性来检验SO42-的存在。使用试剂是:可溶性钡盐和盐酸(或稀硝酸)。 演 示 实 验6-6SO42- + Ba2+ = BaSO4↓SO42- + Ba2+ = BaSO4↓CO32- + Ba2+ = BaCO3↓BaCO3 + 2H+ = Ba2+ + H2O + CO2↑ 想想看:NaCl、Na2SO4、Na2SO3、NaNO3、Na2CO3有白色沉淀生成无白色沉淀生成Na2SO4、Na2SO3、Na2CO3NaCl、NaNO3继续加HCl取原溶液加AgNO3溶液白色沉淀消失
有无味气体产生白色沉淀
不消失有白色沉
淀生成无白色沉
淀生成Na2CO3Na2SO4NaClNaNO3Na2SO3沉淀消失,有刺激性气味气体产生+ BaCl2溶液 方法之一:NaCl、Na2SO4、Na2SO3、NaNO3、Na2CO3无所泡生成有气体生成Na2SO4、 NaCl、NaNO3 Na2SO3、Na2CO3加HCl(aq) NaNO3 、 NaCl产生气体无气味有白色沉淀无白色沉
淀生成Na2CO3Na2SO4NaClNaNO3Na2SO3产生气体为刺激性气味取原溶液加BaCl2溶液方法之二:取原溶液加AgNO3溶液有白色沉淀无白色沉
淀生成课堂小结:一、浓硫酸的特性:
1、难挥发性;2、吸水性;3、脱水性;4、强氧化性(氧化非金属单质、金属单质和还原性化合物等)二、硫酸根离子的检验: 先用盐酸把溶液酸化,以排除CO32-、SO32-、Ag+等可能造成的干扰,再加入BaCl2溶液,根据是否有白色沉淀出现来阐明原溶液中是否有SO42-存在。 如何鉴别Na2CO3、Na2SO4、 Na2SO3三种溶液? ⑴ 用三支试管分别取少量未知溶液并编号 ⑵ 分别向三支试管中滴入少量BaCl2溶液,均有
白色沉淀产生。 ⑶ 再分别注入少量稀盐酸,白色沉淀不溶解的则
原溶液是Na2SO4 。另两支试管中白色沉淀消失并产生
气体。 ⑷ 将产生的气体分别通入品红溶液中,能使品红
溶液褪色的则原溶液是Na2SO3 , 无明显变化的则原溶
液为Na2CO3。( 能否用石灰水鉴别?) 如何鉴别Na2CO3、Na2SO4、 Na2SO3三种溶液?注意步骤:取样,操作,现象,结论,方程式1、硫酸在下列用途或反应中各表现的性质是:
A、强酸性 B、难挥发性C、吸水性D、脱水性E、强氧化性
(1)实验室制SO2气体________;
(2)干燥H2、SO2等气体________;
(3)用铝槽车装运浓硫酸________;
(4)清洗镀件表面氧化物________;
(5)浓硫酸使湿润石蕊试纸变红,后来又变黑________ 2.请设计一个实验来鉴别稀H2SO4 和 Na2SO3溶液,要求只能使用BaCl2溶液及试管,并写出操作的过程和结论同学们,再见!2006.04.29
写出浓硫酸与碳、铜反应的
化学方程式。 想想看:Cu是H之后的较不活泼金属,那么H之前的金属是否就更容易被浓H2SO4氧化呢? 0+6+4+2化合价升高化合价降低 想想看:在该反应中浓硫酸的作用是什么?失2电子得2电子分析请标出电子的转移情况
注
意
⑴ 参加反应的硫酸只有一半被还原 ⑵ 在与铜的反应中,浓硫酸既表现出 氧化性,又表现出酸性。现象: 常温无明显变化,加热后能
反应。解释: 常温下,浓硫酸能使铁、铝等金
属表面生成一层致密的氧化物保护膜,
阻止内部金属继续跟硫酸起反应。此
现象称 “钝化”。
2、加热时—— 与绝大多数金属反应1、不产生 ,浓硫酸被 为 .—— 与活泼金属(如Zn)反应3、常温下发生钝化表面生成 .Al、Fe与 的 硫酸接触钝化条件:加热后:会剧烈反应H2还原SO2致密的氧化物薄膜冷浓浓硫酸与金属反应的规律:总结浓硫酸的特性⑴ 吸水性⑶ 强氧化性① 加热时浓硫酸能与大多数金属反应,但不生成氢气。常温下使铁铝钝化⑵ 脱水性Cu + 2H2SO4 (浓) = CuSO4 + SO2 + 2H2O△② 与某些非金属反应C + 2H2SO4 (浓) = CO2 + SO2 + 2H2O△③ 与硫化氢、溴化氢、碘化氢等还原剂反应H2S + H2SO4 (浓) = S + SO2 + 2H2O 在实验室中常用浓硫酸作气体的干燥剂。下列气体中,哪些不能用浓硫酸干燥?O2 (2) HCl (3) HBr (4) HI
(5) SO2 (6) H2S (7) NH3不能干燥溴化氢、碘化氢、硫化氢和氨气,因为:二、硫酸根离子的检验 有白色沉淀生成沉淀不溶解有白色沉淀生成沉淀不溶解有白色沉淀生成沉淀溶解产生气体小结:H2SO4和硫酸盐溶于水时都会产生SO42-,可以利用BaSO4的不溶性来检验SO42-的存在。使用试剂是:可溶性钡盐和盐酸(或稀硝酸)。 演 示 实 验6-6SO42- + Ba2+ = BaSO4↓SO42- + Ba2+ = BaSO4↓CO32- + Ba2+ = BaCO3↓BaCO3 + 2H+ = Ba2+ + H2O + CO2↑ 想想看:NaCl、Na2SO4、Na2SO3、NaNO3、Na2CO3有白色沉淀生成无白色沉淀生成Na2SO4、Na2SO3、Na2CO3NaCl、NaNO3继续加HCl取原溶液加AgNO3溶液白色沉淀消失
有无味气体产生白色沉淀
不消失有白色沉
淀生成无白色沉
淀生成Na2CO3Na2SO4NaClNaNO3Na2SO3沉淀消失,有刺激性气味气体产生+ BaCl2溶液 方法之一:NaCl、Na2SO4、Na2SO3、NaNO3、Na2CO3无所泡生成有气体生成Na2SO4、 NaCl、NaNO3 Na2SO3、Na2CO3加HCl(aq) NaNO3 、 NaCl产生气体无气味有白色沉淀无白色沉
淀生成Na2CO3Na2SO4NaClNaNO3Na2SO3产生气体为刺激性气味取原溶液加BaCl2溶液方法之二:取原溶液加AgNO3溶液有白色沉淀无白色沉
淀生成课堂小结:一、浓硫酸的特性:
1、难挥发性;2、吸水性;3、脱水性;4、强氧化性(氧化非金属单质、金属单质和还原性化合物等)二、硫酸根离子的检验: 先用盐酸把溶液酸化,以排除CO32-、SO32-、Ag+等可能造成的干扰,再加入BaCl2溶液,根据是否有白色沉淀出现来阐明原溶液中是否有SO42-存在。 如何鉴别Na2CO3、Na2SO4、 Na2SO3三种溶液? ⑴ 用三支试管分别取少量未知溶液并编号 ⑵ 分别向三支试管中滴入少量BaCl2溶液,均有
白色沉淀产生。 ⑶ 再分别注入少量稀盐酸,白色沉淀不溶解的则
原溶液是Na2SO4 。另两支试管中白色沉淀消失并产生
气体。 ⑷ 将产生的气体分别通入品红溶液中,能使品红
溶液褪色的则原溶液是Na2SO3 , 无明显变化的则原溶
液为Na2CO3。( 能否用石灰水鉴别?) 如何鉴别Na2CO3、Na2SO4、 Na2SO3三种溶液?注意步骤:取样,操作,现象,结论,方程式1、硫酸在下列用途或反应中各表现的性质是:
A、强酸性 B、难挥发性C、吸水性D、脱水性E、强氧化性
(1)实验室制SO2气体________;
(2)干燥H2、SO2等气体________;
(3)用铝槽车装运浓硫酸________;
(4)清洗镀件表面氧化物________;
(5)浓硫酸使湿润石蕊试纸变红,后来又变黑________ 2.请设计一个实验来鉴别稀H2SO4 和 Na2SO3溶液,要求只能使用BaCl2溶液及试管,并写出操作的过程和结论同学们,再见!2006.04.29
