硫酸(第一课时)[下学期]
图片预览





文档简介
课件17张PPT。第三节 硫 酸制作人:马凤莲
颜色:
状态:
沸点:
密度:
溶解性:
无色油状液体高,难挥发比水重以任意比与水互溶
放出大量的热一、硫酸的物理性质 先在烧杯中加入少量的水,然后沿烧杯内壁慢慢注入浓硫酸,并用玻璃棒不断搅拌。思考如何稀释浓硫酸? 现有体积相同的浓硫酸和浓盐酸,分别放
在等质量的两个试剂瓶中,不用化学方法怎样
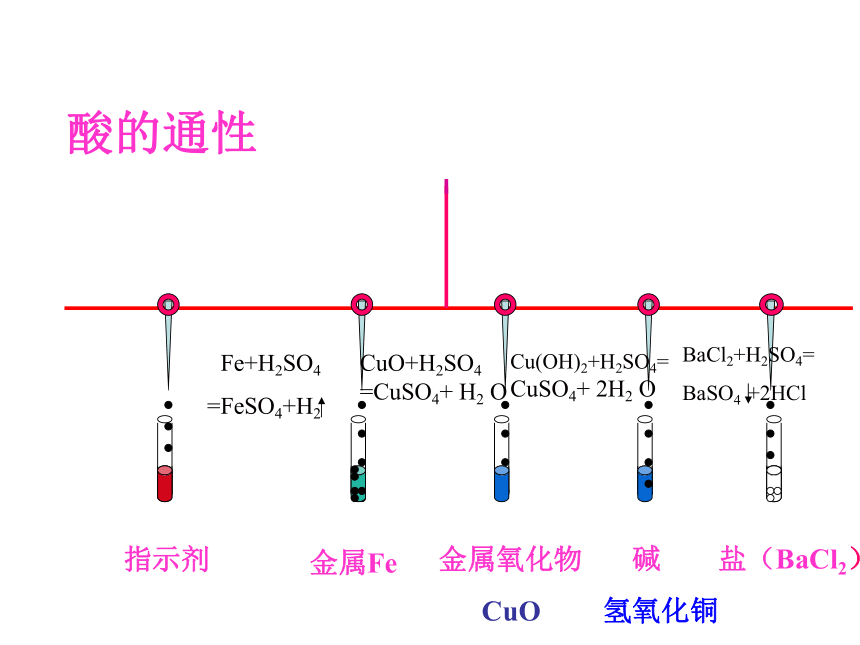
识别?提起试剂瓶,重者是浓硫酸;振动试剂瓶,液体呈油状的是浓硫酸;打开试剂瓶,瓶口不生白雾者是浓硫酸;打开试剂瓶,无刺激性气味的是浓硫酸。Fe+H2SO4
=FeSO4+H2CuO+H2SO4 =CuSO4+ H2 OCu(OH)2+H2SO4= CuSO4+ 2H2 OBaCl2+H2SO4=
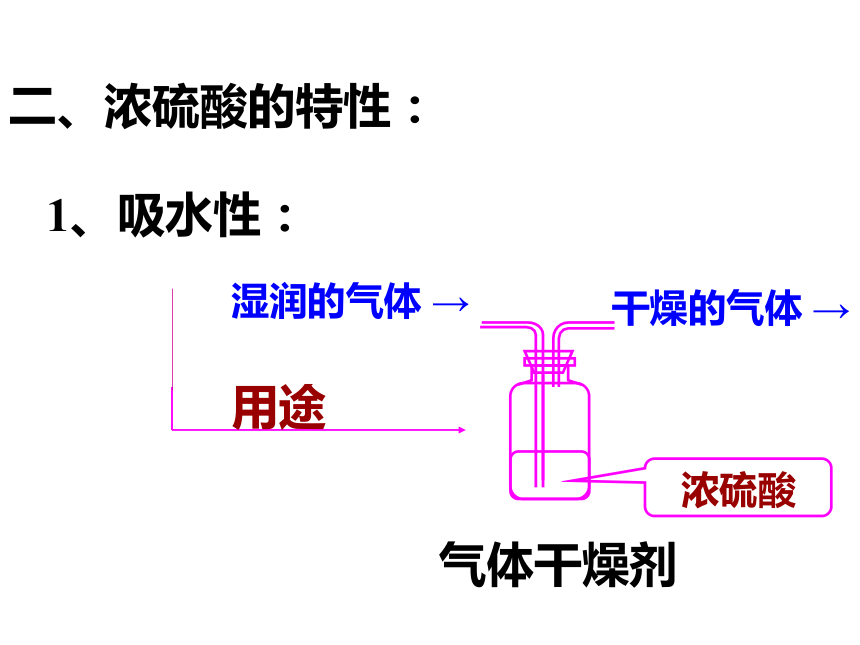
BaSO4 +2HCl酸的通性二、浓硫酸的特性:1、吸水性:气体干燥剂浓硫酸湿润的气体 →干燥的气体 →现象: 蔗糖变黑,体积膨胀,放出大
量热,放出有刺激性气味的气体。反应方程式:结论:体现出浓硫酸的脱水性和氧化性2H2SO4 (浓) + C
= CO2 + 2H2O + 2SO2△ 演 示 实 验——蔗糖中加入浓硫酸2、脱水性:将H、O按H2O组成比脱去比较学习 浓硫酸的吸水性和脱水性有什么区别?吸水性是指浓硫酸直接与水分子结合。 脱水性是指浓硫酸将许多有机物中的
氢、氧元素按水的比例脱去。吸收现成的水反应生成水现象: 加热能反应,产生的气
体能使品红溶液褪色,溶液稀
释后呈蓝色。
反应方程式:Cu + 2H2SO4(浓)
= CuSO4 + SO2 + 2H2O结论:浓硫酸有氧化性△ 演 示 实 验0+6+4+2化合价升高化合价降低 想想看:在该反应中浓硫酸的作用是什么?失2电子得2电子分析请标出电子的转移情况
注
意
⑴ 参加反应的硫酸只有一半被还原 ⑵ 在与铜的反应中,浓硫酸既表现出 氧化性,又表现出酸性。浓硫酸稀硫酸 H2SO4量 变 引 起 质 变 !浓硫酸的特性小结1、吸水性2、脱水性3、强氧化性 规范使用,妥善保存正确处理 当堂训练:1、浓硫酸具有下列性质:
A、酸性 B、强氧化性 C、难挥发性 D、吸水性
E、脱水性,下列实验或事实主要表现了浓硫酸
的什么性质,将适当的序号填入括号中。
①浓硫酸可作气体干燥剂。………………………( )
②浓硫酸不能干燥氨气。…………………………( )
③棉布上滴上浓硫酸出现破洞。…………………( )
④浓硫酸不能干燥硫化氢。………………………( )
⑤铁片投入浓硫酸中不溶解。……………………( )
DAEBB1、下列叙述或操作正确的是………………( )
A、浓硫酸具有强氧化性,稀硫酸不具有氧化性
B、浓硫酸不慎沾到皮肤上,应立即用布拭去,再用
水冲洗
C、稀释浓硫酸时应将浓硫酸沿着烧杯壁慢慢注入盛
有水的烧杯中,并不断搅拌
D、浓硫酸与铜的反应中,浓硫酸仅表现出强氧化性B C 当堂训练: 当堂训练:2、浓硫酸具有下列性质:
A、酸性 B、强氧化性 C、难挥发性 D、吸水性 E、脱水性,
下列实验或事实主要表现了浓硫酸的什么性质,将适当的序号填入括号中。
①浓硫酸可作气体干燥剂。………………………( )
②浓硫酸不能干燥氨气。…………………………( )
③棉布上滴上浓硫酸出现破洞。…………………( )
④铁片投入浓硫酸中不溶解。……………………( )
DAEBB
颜色:
状态:
沸点:
密度:
溶解性:
无色油状液体高,难挥发比水重以任意比与水互溶
放出大量的热一、硫酸的物理性质 先在烧杯中加入少量的水,然后沿烧杯内壁慢慢注入浓硫酸,并用玻璃棒不断搅拌。思考如何稀释浓硫酸? 现有体积相同的浓硫酸和浓盐酸,分别放
在等质量的两个试剂瓶中,不用化学方法怎样
识别?提起试剂瓶,重者是浓硫酸;振动试剂瓶,液体呈油状的是浓硫酸;打开试剂瓶,瓶口不生白雾者是浓硫酸;打开试剂瓶,无刺激性气味的是浓硫酸。Fe+H2SO4
=FeSO4+H2CuO+H2SO4 =CuSO4+ H2 OCu(OH)2+H2SO4= CuSO4+ 2H2 OBaCl2+H2SO4=
BaSO4 +2HCl酸的通性二、浓硫酸的特性:1、吸水性:气体干燥剂浓硫酸湿润的气体 →干燥的气体 →现象: 蔗糖变黑,体积膨胀,放出大
量热,放出有刺激性气味的气体。反应方程式:结论:体现出浓硫酸的脱水性和氧化性2H2SO4 (浓) + C
= CO2 + 2H2O + 2SO2△ 演 示 实 验——蔗糖中加入浓硫酸2、脱水性:将H、O按H2O组成比脱去比较学习 浓硫酸的吸水性和脱水性有什么区别?吸水性是指浓硫酸直接与水分子结合。 脱水性是指浓硫酸将许多有机物中的
氢、氧元素按水的比例脱去。吸收现成的水反应生成水现象: 加热能反应,产生的气
体能使品红溶液褪色,溶液稀
释后呈蓝色。
反应方程式:Cu + 2H2SO4(浓)
= CuSO4 + SO2 + 2H2O结论:浓硫酸有氧化性△ 演 示 实 验0+6+4+2化合价升高化合价降低 想想看:在该反应中浓硫酸的作用是什么?失2电子得2电子分析请标出电子的转移情况
注
意
⑴ 参加反应的硫酸只有一半被还原 ⑵ 在与铜的反应中,浓硫酸既表现出 氧化性,又表现出酸性。浓硫酸稀硫酸 H2SO4量 变 引 起 质 变 !浓硫酸的特性小结1、吸水性2、脱水性3、强氧化性 规范使用,妥善保存正确处理 当堂训练:1、浓硫酸具有下列性质:
A、酸性 B、强氧化性 C、难挥发性 D、吸水性
E、脱水性,下列实验或事实主要表现了浓硫酸
的什么性质,将适当的序号填入括号中。
①浓硫酸可作气体干燥剂。………………………( )
②浓硫酸不能干燥氨气。…………………………( )
③棉布上滴上浓硫酸出现破洞。…………………( )
④浓硫酸不能干燥硫化氢。………………………( )
⑤铁片投入浓硫酸中不溶解。……………………( )
DAEBB1、下列叙述或操作正确的是………………( )
A、浓硫酸具有强氧化性,稀硫酸不具有氧化性
B、浓硫酸不慎沾到皮肤上,应立即用布拭去,再用
水冲洗
C、稀释浓硫酸时应将浓硫酸沿着烧杯壁慢慢注入盛
有水的烧杯中,并不断搅拌
D、浓硫酸与铜的反应中,浓硫酸仅表现出强氧化性B C 当堂训练: 当堂训练:2、浓硫酸具有下列性质:
A、酸性 B、强氧化性 C、难挥发性 D、吸水性 E、脱水性,
下列实验或事实主要表现了浓硫酸的什么性质,将适当的序号填入括号中。
①浓硫酸可作气体干燥剂。………………………( )
②浓硫酸不能干燥氨气。…………………………( )
③棉布上滴上浓硫酸出现破洞。…………………( )
④铁片投入浓硫酸中不溶解。……………………( )
DAEBB
