化学反应速率与化学平衡综合运用图像题[上学期]
文档属性
| 名称 | 化学反应速率与化学平衡综合运用图像题[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 260.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2005-12-02 00:00:00 | ||
图片预览


文档简介
课件21张PPT。《化学反应速率 化学平衡》知识要点题型一、“定一议二”图象的判断
题型二:“先拐先平”图象的应用
题型三:改变某种条件“ C—t”变化的
图象应用
题型4:“v—t”图象的应用
题型五:利用图象进行计算及综合应用
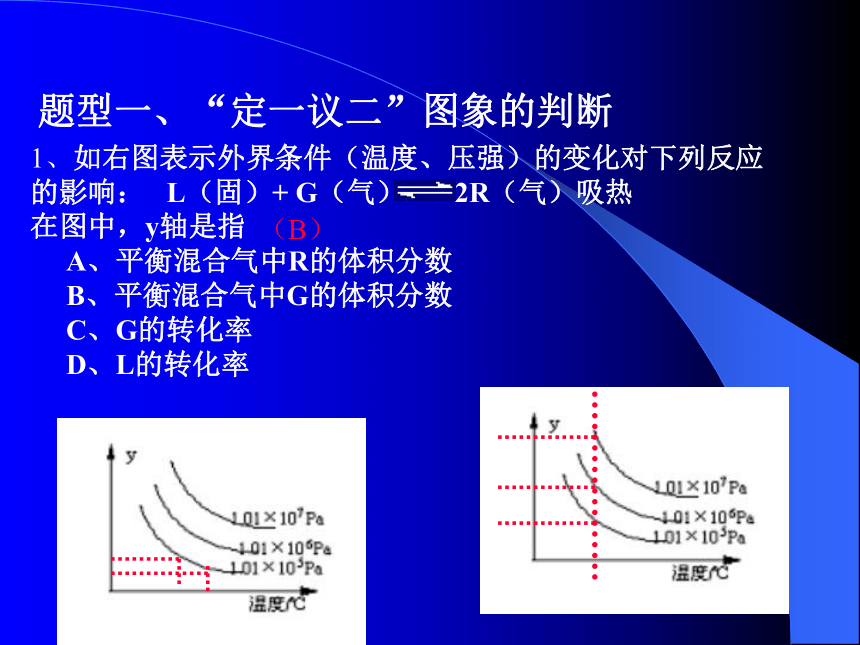
题型六:图象中有未平衡点的题型应用化学反应速率、化学平衡的综合应用--图象题题型一、“定一议二”图象的判断1、如右图表示外界条件(温度、压强)的变化对下列反应
的影响: L(固)+ G(气) 2R(气)吸热
在图中,y轴是指
A、平衡混合气中R的体积分数
B、平衡混合气中G的体积分数
C、G的转化率
D、L的转化率
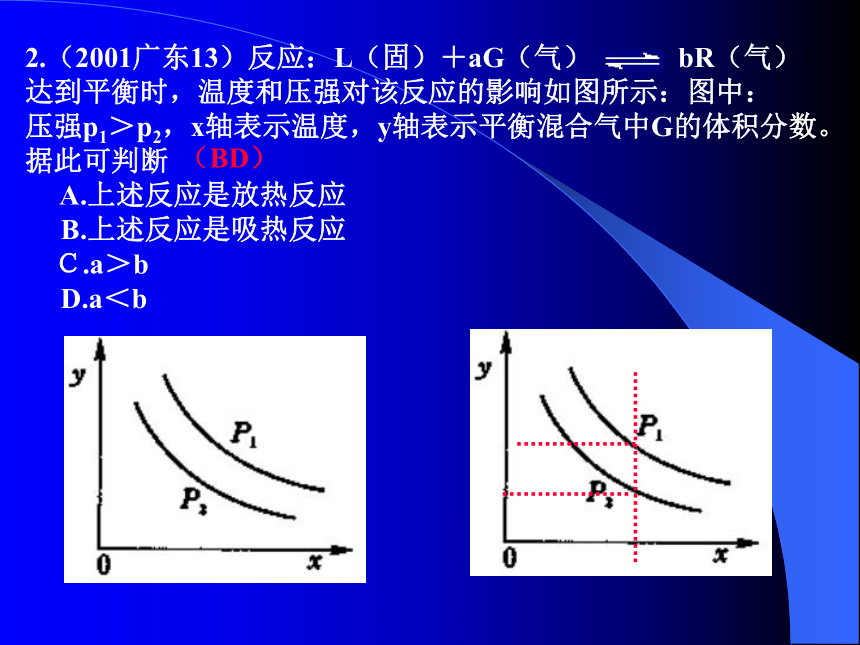
(B)2.(2001广东13)反应:L(固)+aG(气) bR(气)
达到平衡时,温度和压强对该反应的影响如图所示:图中:
压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。
据此可判断
A.上述反应是放热反应
B.上述反应是吸热反应
C.a>b
D.a<b
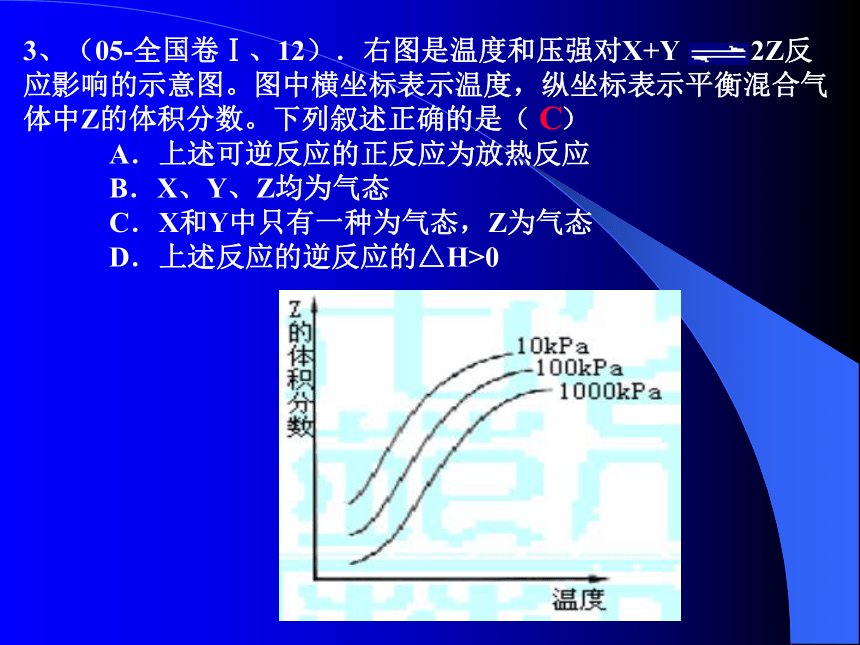
(BD)3、(05-全国卷Ⅰ、12).右图是温度和压强对X+Y 2Z反
应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气
体中Z的体积分数。下列叙述正确的是( )
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种为气态,Z为气态
D.上述反应的逆反应的△H>0
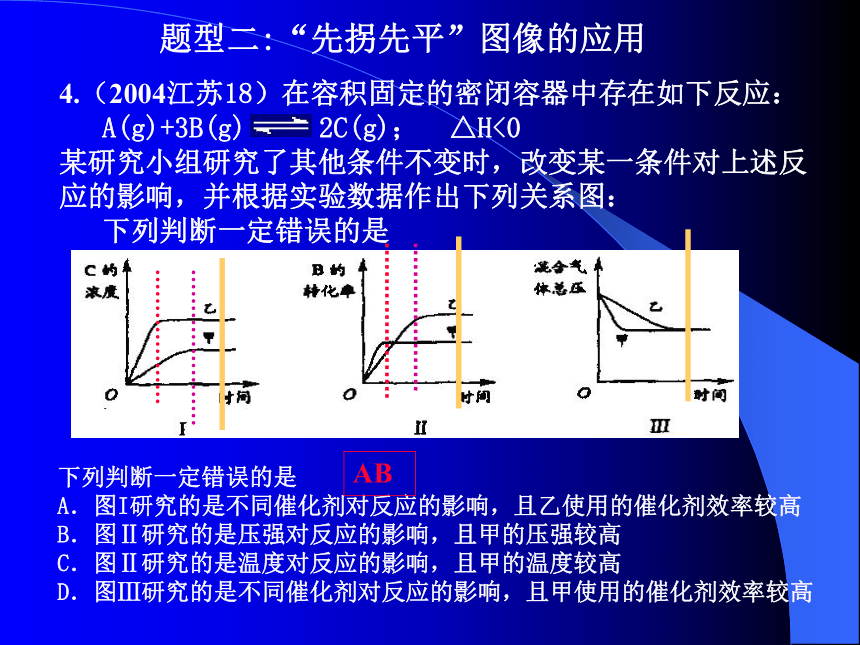
C题型二:“先拐先平”图像的应用4.(2004江苏18)在容积固定的密闭容器中存在如下反应:
A(g)+3B(g) 2C(g); △H<0
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
下列判断一定错误的是下列判断一定错误的是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
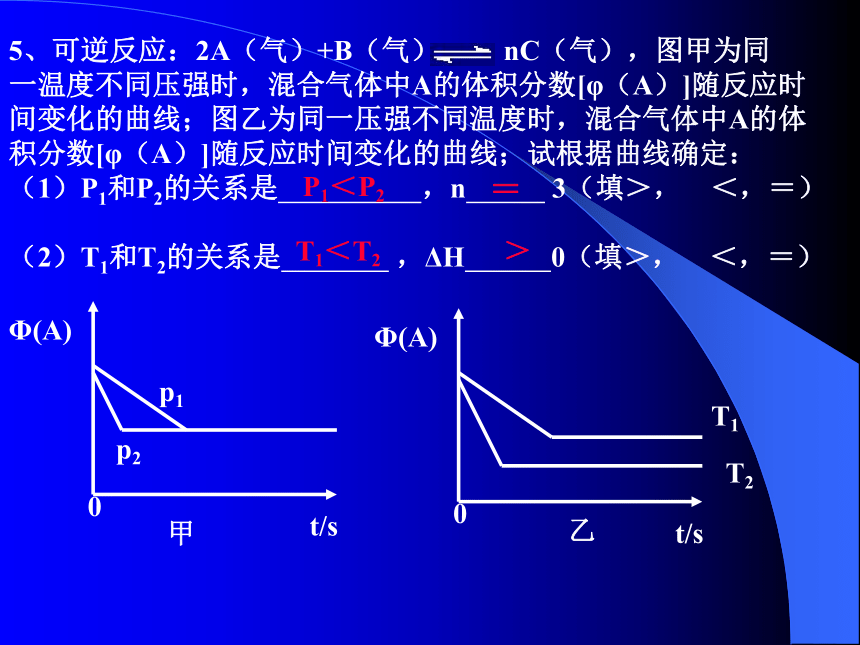
AB5、可逆反应:2A(气)+B(气) nC(气),图甲为同
一温度不同压强时,混合气体中A的体积分数[φ(A)]随反应时
间变化的曲线;图乙为同一压强不同温度时,混合气体中A的体
积分数[φ(A)]随反应时间变化的曲线;试根据曲线确定:
(1)P1和P2的关系是 ,n 3(填>, <,=)
(2)T1和T2的关系是 ,ΔH 0(填>, <,=)
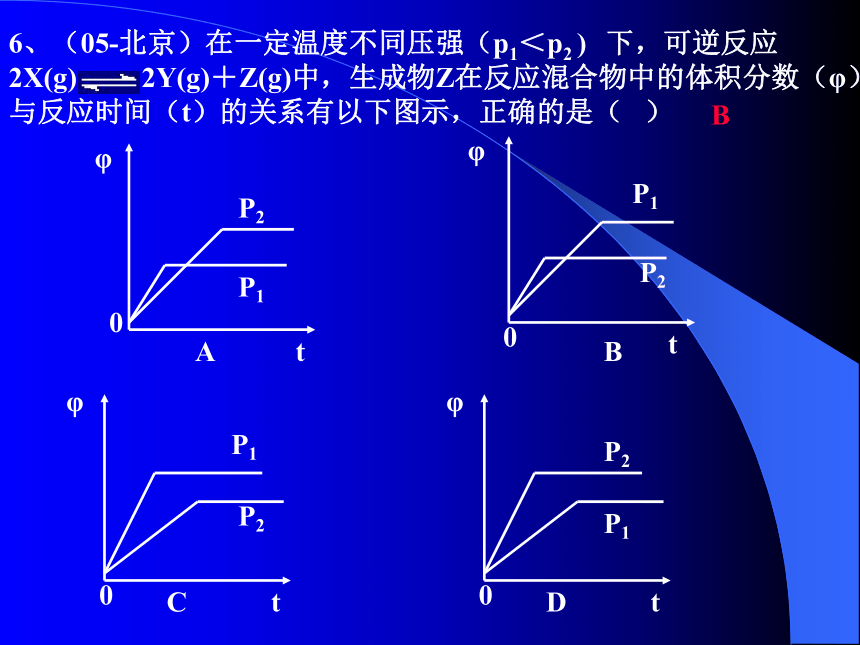
P1<P2=T1<T2>6、(05-北京)在一定温度不同压强(p1<p2 ) 下,可逆反应 2X(g) 2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(φ)与反应时间(t)的关系有以下图示,正确的是( )
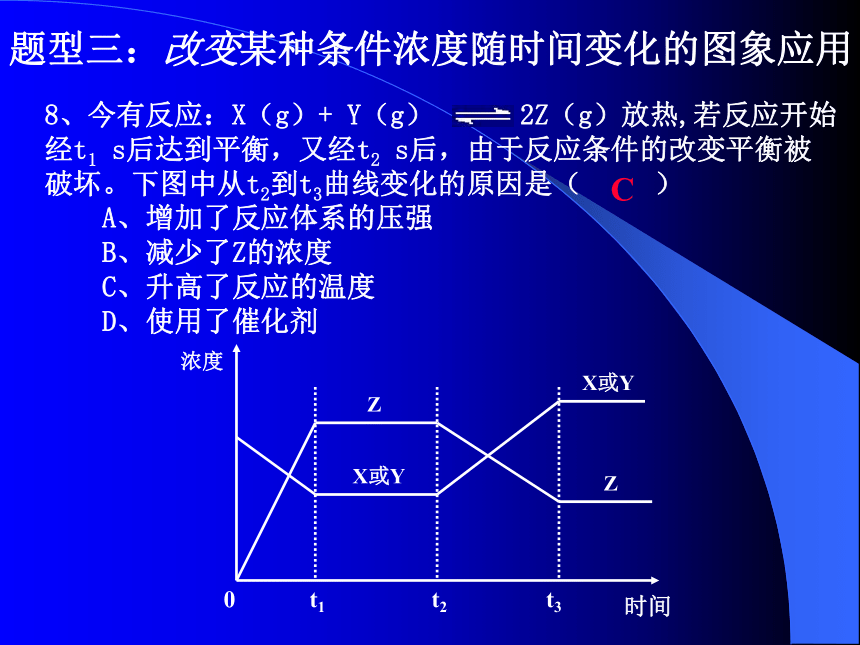
B题型三:改变某种条件浓度随时间变化的图象应用8、今有反应:X(g)+ Y(g) 2Z(g)放热,若反应开始
经t1 s后达到平衡,又经t2 s后,由于反应条件的改变平衡被
破坏。下图中从t2到t3曲线变化的原因是( )
A、增加了反应体系的压强
B、减少了Z的浓度
C、升高了反应的温度
D、使用了催化剂
C9、(2004上海 24)在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+ O2 (g) 2SO3(g) (△H< 0)
(3)600℃时,在一密闭容器中,将二氧
化硫和氧气混合,反应过程中SO2、O2、
SO3物质的量变化如图,反应处于平衡状
态的时间是_________________ 。
(4)据图判断,反应进行至20min时,曲线
发生变化的原因
是___________________________________
(用文字表达)
10min到15min的曲线变化的原因可能是 __________________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
15—20min和25—30min 增加了O2的浓度 a b
10、反应2A(g) B(g)放热,从开始到达平衡后,若改变某个外界条件,使平衡移动后重新到达新的平衡,该过程反应物和生成物的浓度随时间变化的情况可用下列三图表示,请分别填出每图相应的平衡移动因素:
; 。 ;
平衡移动向: ; ; 。
减小B的浓度增大体系的压强升高体系的温度正反应方向移动正反应方向移动逆反应方向移动题型4:速度—时间图象的应用11、对于mA(g)+ nB(g) qC(g)达到平衡后,
在t1时刻,改变某一外界条件X,其速率变化曲线如图所示。
下列结论正确的是( )
A、X为升高温度且ΔH>0 B、X为增大压强,且m+n>q
C、X为加入催化剂 D、X为增大C的浓度
?
D12、一密封体系中发生下列反应N2 + 3H2 2NH3(正反应为放热反应)下图是某一段时间中反应速率与反应进程的曲线关系图:
回答下列问题:
(1)处于平衡状态的时间段是——————————。
(2)t1、t3、t4时刻体系中发生了变化的条件是————
——————————————————————。
(3)下列时间段时,氨的体积分数最高的是————。
A、t0~ t1 B、 t2 ~ t3 C、 t3 ~ t4 D、 t5 ~ t6t0~ t1、 t2 ~ t4 、 t5 ~ t6升高温度、加了催化剂、降低压强A13、下图是可逆反应A+2B 2C + 3D的化学反应速率与化学
平衡随外界条件改变,(先降温后加压)而变化的情况,由此
判断( )
A、正反应是放热反应 B、若A、B是气体则D是固体或液体
C、逆反应是放热反应 D、A、B、C、D均为气体BC题型五:利用图像进行计算及综合应用14、(2000上海26)二氧化氮
在加热条件下能够分解成一氧
化氮和氧气。该反应进行到45
秒时,达到平衡(NO2浓度约
为0.0125mol/L)。右图中的曲
线表示二氧化氮分解反应在前
25秒内的反应进程。
?(1)请计算前20秒内氧气的
平均生成速度:
(2)若反应延续至70秒,请在
图中用实线画出25秒至70秒
的反应进程曲线。
(3)若在反应开始时加入催化
剂(其他条件都不变),请
在图上用虚线画出加化剂后的反应进程曲线。
(4)计算NO2的转化率5.5×10-4mol/L·S·(见红实线)(见红虚线)68.8%15、(05-上海25)在某一容积为2L的
密闭容器内,加入0.8mol的H2和0.6mol
的I2,在一定的条件下发生如下反应:
H2(g) + I2(g) ? 2HI(g) ; ΔH<0
反应中各物质的浓度随时间变化情况
如图1:
(2)根据图1数据,反应开始至达到平衡时,平均速率 v(HI)为 。
(3)反应达到平衡后,第8分钟时:
①若升高温度,HI浓度的变化正确的是 用图2
中a-c的编号回答)
②若加入I2,H2浓度的变化正确的是 ,(用图2中d-f的编号回答)
(4)反应达到平衡后,第8分钟时,若反 应容器的容积扩大一倍,请在图3中画出
8分钟后HI浓度的变化情况
0.167mol/L·min
c
f 题型六:图象中有未平衡点的题型应用16、mA(g)+ nB(g) pC(g)放热 的可逆反应在定温下,
B%与压强的关系如图,有关叙述正确的是( )
A、m + n <p
B、n>p
C、x点时混合物 v(正)>v(逆)
D、x点比y点混合物反应速率快
AC17、、可逆反应mA(气) nB(气)+p C(气),
温度和压强的变化对正逆反应速率的影响分别符合
下图中的两个图象,以下叙述正确的是
A、m> n,ΔH>0
B、m<n+p,ΔH>0
C、m> n,ΔH<0
D、m>n+p,ΔH<0
( D )9、已知某可逆反应mA(g)+ nB(g) pC(g)在密闭容器
中进行,右图表示不同反应时间t时,温度T和压强P与反应物B
的混合气体中分数B%的关系曲线。由曲线分析,下列判断正确
的是( )
A、T1<T2,P1>P2,m+n>P, Δ H>0
B、T1>T2,P1<P2,m+n>P, Δ H<0
C、T1<T2,P1>P2,m+n<P, Δ H>0
D、T1>T2,P1<P2,m+n<P, Δ H>0
D3、在mA + n B pC+qD 的 气体反应中,在下面
4个图中,横坐标为温度,纵坐标为C的体积分数,判断正反应是吸热反应?还是放热反应?系数关系是①m+n>p+q ② m+n<p+q ③ m+n=p+q 填写下表。放热 ①放热 ②吸热 ①吸热 ③C7.(2004广东18)右图曲线a表示放热反应:
X(g)+Y(g) Z(g)+M(g)+N(g)进行过程中X的转化率随时间
变化的关系。若要改变起始条件,使反应的过程按b曲线进行,
可采取的措施是( )
A.升高温度
B.加大X的投入量
C.加催化剂
D.增大体积
题型二:“先拐先平”图象的应用
题型三:改变某种条件“ C—t”变化的
图象应用
题型4:“v—t”图象的应用
题型五:利用图象进行计算及综合应用
题型六:图象中有未平衡点的题型应用化学反应速率、化学平衡的综合应用--图象题题型一、“定一议二”图象的判断1、如右图表示外界条件(温度、压强)的变化对下列反应
的影响: L(固)+ G(气) 2R(气)吸热
在图中,y轴是指
A、平衡混合气中R的体积分数
B、平衡混合气中G的体积分数
C、G的转化率
D、L的转化率
(B)2.(2001广东13)反应:L(固)+aG(气) bR(气)
达到平衡时,温度和压强对该反应的影响如图所示:图中:
压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。
据此可判断
A.上述反应是放热反应
B.上述反应是吸热反应
C.a>b
D.a<b
(BD)3、(05-全国卷Ⅰ、12).右图是温度和压强对X+Y 2Z反
应影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气
体中Z的体积分数。下列叙述正确的是( )
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种为气态,Z为气态
D.上述反应的逆反应的△H>0
C题型二:“先拐先平”图像的应用4.(2004江苏18)在容积固定的密闭容器中存在如下反应:
A(g)+3B(g) 2C(g); △H<0
某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
下列判断一定错误的是下列判断一定错误的是
A.图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
AB5、可逆反应:2A(气)+B(气) nC(气),图甲为同
一温度不同压强时,混合气体中A的体积分数[φ(A)]随反应时
间变化的曲线;图乙为同一压强不同温度时,混合气体中A的体
积分数[φ(A)]随反应时间变化的曲线;试根据曲线确定:
(1)P1和P2的关系是 ,n 3(填>, <,=)
(2)T1和T2的关系是 ,ΔH 0(填>, <,=)
P1<P2=T1<T2>6、(05-北京)在一定温度不同压强(p1<p2 ) 下,可逆反应 2X(g) 2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(φ)与反应时间(t)的关系有以下图示,正确的是( )
B题型三:改变某种条件浓度随时间变化的图象应用8、今有反应:X(g)+ Y(g) 2Z(g)放热,若反应开始
经t1 s后达到平衡,又经t2 s后,由于反应条件的改变平衡被
破坏。下图中从t2到t3曲线变化的原因是( )
A、增加了反应体系的压强
B、减少了Z的浓度
C、升高了反应的温度
D、使用了催化剂
C9、(2004上海 24)在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+ O2 (g) 2SO3(g) (△H< 0)
(3)600℃时,在一密闭容器中,将二氧
化硫和氧气混合,反应过程中SO2、O2、
SO3物质的量变化如图,反应处于平衡状
态的时间是_________________ 。
(4)据图判断,反应进行至20min时,曲线
发生变化的原因
是___________________________________
(用文字表达)
10min到15min的曲线变化的原因可能是 __________________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
15—20min和25—30min 增加了O2的浓度 a b
10、反应2A(g) B(g)放热,从开始到达平衡后,若改变某个外界条件,使平衡移动后重新到达新的平衡,该过程反应物和生成物的浓度随时间变化的情况可用下列三图表示,请分别填出每图相应的平衡移动因素:
; 。 ;
平衡移动向: ; ; 。
减小B的浓度增大体系的压强升高体系的温度正反应方向移动正反应方向移动逆反应方向移动题型4:速度—时间图象的应用11、对于mA(g)+ nB(g) qC(g)达到平衡后,
在t1时刻,改变某一外界条件X,其速率变化曲线如图所示。
下列结论正确的是( )
A、X为升高温度且ΔH>0 B、X为增大压强,且m+n>q
C、X为加入催化剂 D、X为增大C的浓度
?
D12、一密封体系中发生下列反应N2 + 3H2 2NH3(正反应为放热反应)下图是某一段时间中反应速率与反应进程的曲线关系图:
回答下列问题:
(1)处于平衡状态的时间段是——————————。
(2)t1、t3、t4时刻体系中发生了变化的条件是————
——————————————————————。
(3)下列时间段时,氨的体积分数最高的是————。
A、t0~ t1 B、 t2 ~ t3 C、 t3 ~ t4 D、 t5 ~ t6t0~ t1、 t2 ~ t4 、 t5 ~ t6升高温度、加了催化剂、降低压强A13、下图是可逆反应A+2B 2C + 3D的化学反应速率与化学
平衡随外界条件改变,(先降温后加压)而变化的情况,由此
判断( )
A、正反应是放热反应 B、若A、B是气体则D是固体或液体
C、逆反应是放热反应 D、A、B、C、D均为气体BC题型五:利用图像进行计算及综合应用14、(2000上海26)二氧化氮
在加热条件下能够分解成一氧
化氮和氧气。该反应进行到45
秒时,达到平衡(NO2浓度约
为0.0125mol/L)。右图中的曲
线表示二氧化氮分解反应在前
25秒内的反应进程。
?(1)请计算前20秒内氧气的
平均生成速度:
(2)若反应延续至70秒,请在
图中用实线画出25秒至70秒
的反应进程曲线。
(3)若在反应开始时加入催化
剂(其他条件都不变),请
在图上用虚线画出加化剂后的反应进程曲线。
(4)计算NO2的转化率5.5×10-4mol/L·S·(见红实线)(见红虚线)68.8%15、(05-上海25)在某一容积为2L的
密闭容器内,加入0.8mol的H2和0.6mol
的I2,在一定的条件下发生如下反应:
H2(g) + I2(g) ? 2HI(g) ; ΔH<0
反应中各物质的浓度随时间变化情况
如图1:
(2)根据图1数据,反应开始至达到平衡时,平均速率 v(HI)为 。
(3)反应达到平衡后,第8分钟时:
①若升高温度,HI浓度的变化正确的是 用图2
中a-c的编号回答)
②若加入I2,H2浓度的变化正确的是 ,(用图2中d-f的编号回答)
(4)反应达到平衡后,第8分钟时,若反 应容器的容积扩大一倍,请在图3中画出
8分钟后HI浓度的变化情况
0.167mol/L·min
c
f 题型六:图象中有未平衡点的题型应用16、mA(g)+ nB(g) pC(g)放热 的可逆反应在定温下,
B%与压强的关系如图,有关叙述正确的是( )
A、m + n <p
B、n>p
C、x点时混合物 v(正)>v(逆)
D、x点比y点混合物反应速率快
AC17、、可逆反应mA(气) nB(气)+p C(气),
温度和压强的变化对正逆反应速率的影响分别符合
下图中的两个图象,以下叙述正确的是
A、m> n,ΔH>0
B、m<n+p,ΔH>0
C、m> n,ΔH<0
D、m>n+p,ΔH<0
( D )9、已知某可逆反应mA(g)+ nB(g) pC(g)在密闭容器
中进行,右图表示不同反应时间t时,温度T和压强P与反应物B
的混合气体中分数B%的关系曲线。由曲线分析,下列判断正确
的是( )
A、T1<T2,P1>P2,m+n>P, Δ H>0
B、T1>T2,P1<P2,m+n>P, Δ H<0
C、T1<T2,P1>P2,m+n<P, Δ H>0
D、T1>T2,P1<P2,m+n<P, Δ H>0
D3、在mA + n B pC+qD 的 气体反应中,在下面
4个图中,横坐标为温度,纵坐标为C的体积分数,判断正反应是吸热反应?还是放热反应?系数关系是①m+n>p+q ② m+n<p+q ③ m+n=p+q 填写下表。放热 ①放热 ②吸热 ①吸热 ③C7.(2004广东18)右图曲线a表示放热反应:
X(g)+Y(g) Z(g)+M(g)+N(g)进行过程中X的转化率随时间
变化的关系。若要改变起始条件,使反应的过程按b曲线进行,
可采取的措施是( )
A.升高温度
B.加大X的投入量
C.加催化剂
D.增大体积
