化学平衡状态[上学期]
图片预览








文档简介
课件27张PPT。第二单元
化学反应的方向和限度专题2 化学反应速率与化学平衡 化学平衡状态宿迁中学高二化学组可逆反应:1、如果V正>V逆,则反应向正反应方向进行。
2、如果V正<V逆,则反应向逆反应方向进行。
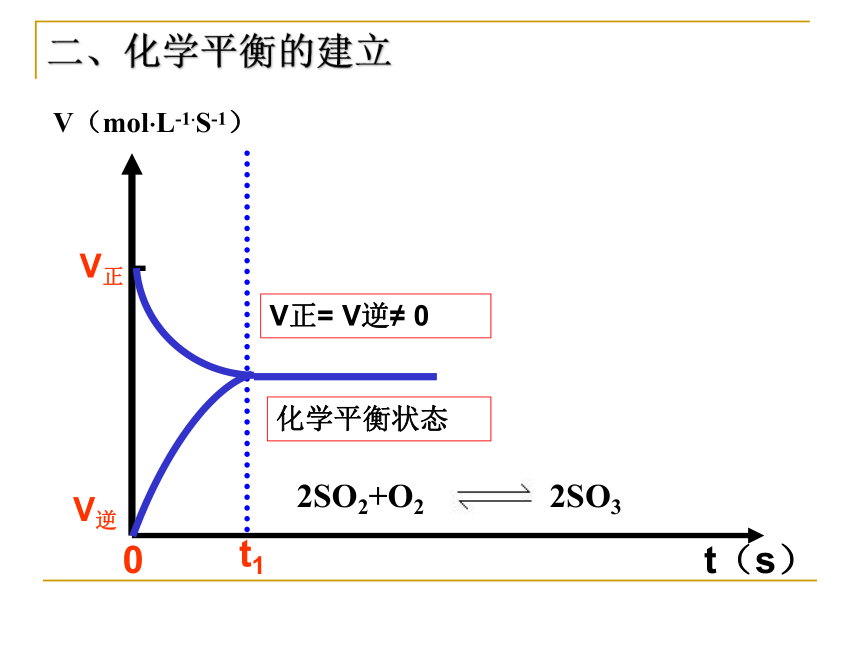
3、如果V正=V逆,则反应达到平衡状态。4、任何一个可逆反应都不会进行到底的,即任一反应物不可能完全转化为生成物,生成物不可能转化为反应物。最终达到平衡状态时,一定是每一反应物和生成物都存在。化学平衡状态一、化学平衡的研究对象 在同等条件下,同时进行着两个方向的反应,即正反应和逆反应。例N2+3H2 2NH3思考:(1)开始阶段有什么特征?(2)瞬间过后有什么特征?(3)一定时间段后有什么特征?c(SO2) 、c(O2)大,c(SO3) =0, v(正) >0 ,v(逆)=0c(SO2) 、c(O2)逐渐变小,c(SO3) 逐渐增大, v(正)减小, v(逆)增大, v(正)> v(逆) c(SO2) 、c(O2)、c(SO3) 浓度均不再变化,v(正)= v(逆) ≠0二、化学平衡的建立 在一固定容积的密闭容器里,加1molSO2和
1molO2,发生反应2SO2+O2 2SO3V正V逆t1 t(s) V(mol?L-1?S-1)0化学平衡状态V正= V逆≠ 0二、化学平衡的建立2SO2+O2 2SO3 化学平衡状态,就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。注意三点前提(适用范围):可逆反应内在本质:v(正)= v(逆) ≠0外在标志:反应混合物中各组分
的浓度保持不变三、化学平衡状态的涵义四、化学平衡状态的特征(4)动:动态平衡(v(正)= v(逆) ≠ 0)(2)等:v(正)= v(逆) (3)定:反应混合物中各组分的含量保持不变,各
组分的浓度保持一定。(5)变:条件改变,原平衡可能被破坏,在新的条
件下建立新的平衡。(1)逆:研究对象为可逆反应(等、定)五、化学平衡状态的标志直接判断法① 正反应速率等于逆反应速率v(正)= v(逆)
② 各成分的浓度保持不变间接判断法① 化学键的断裂与形成
各成分的质量、物质的量、质量分数、物质的量分数、转化率等不随时间变化而变化
③ 各气体的分压、各气体的体积不随时间变化而变化特殊标志判断法 反应体系的总压强、总物质的量、总质量、颜色、混合
气体的平均分子量、密度等都是有条件的特殊规律,视具体
反应、具体条件决定是否可作为平衡的标志。 在一定温度下,可逆反应
A(g)+3B(g) 2C(g) 达到平衡的标志是( )
A. C的生成速率与C分解的速率相等
B. 单位时间生成nmolA,同时生成3nmolB
C. 单位时间生成B的速率,与生成C的速率相等
D. 单位时间生成nmolA,同时生成2nmolCA D练习 下列说法中可以充分说明反应:
P(气) + Q(气) R(气)+S(气) , 在恒温下已达平衡状态的是( )
(A) P、Q、R、S的浓度不再变化
(B) P、Q、R、S的分子数比为1:1:1:1
(C)反应容器内P、Q、R、S共存
(D)反应容器内总物质的量不随时间而变化练习A 在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应:
A(固)+3B(气) 2C(气)+D(气)已达平衡状态的是(其中只有B气体有颜色) ( )
A.混合气体的压强 B.混合气体的密度
C.气体的平均分子量 D.气体的颜色BCD练习ACD 在一定温度下,可逆反应A2(气)+B2(气)≒2AB(气)达到平衡的标志是
A、A2、B2、AB的浓度不再变化
B、容器中的压强不再随时间变化
C、单位时间内生成n mol的A2同时生成2n mol的AB
D、 A2、B2、AB的浓度之比为1:1:2
E、单位时间内消耗nmolA2同时消耗nmolB2
F、单位时间内消耗nmol A2同时生成了nmolB2
G、单位时间打断nmol A—A共价键同时打断2nmol
A—B共价键。 ACFG练习 对于可逆反应:N2+3H2 2NH3,在一定温度下,定容的容器中,达到平衡的标志是
A、容器内的压强不再发生变化
B、单位时间内,消耗多少H2,同时生成多少H2
C、氢气、氮气、氨气的量不再发生变化
D、反应停止,H2、N2、NH3的量不再发生变化
E、混合气体的平均分子量不再发生变化
F、容器内混合气体的密度不再发生变化(ABCE)练习练习可逆反应2NO2 ≒2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是 ( )
①单位时间内生成nmol O2 的同时生成2 nmol NO2
②单位时间内生成nmol O2 的同时生成2 nmol NO
③用NO2 、NO 、O2 的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A ① ④ ⑥ B ② ③ ⑤
C ① ③ ④ D ① ② ③ ④ ⑤ ⑥ A六、化学平衡的相关计算⑴基本模式——“三段式”转化: mx nx px qx 平衡:a - mx b - nx px qx ⑵基本关系生成物:平衡浓度=起始浓度+转化浓度 ①反应物:平衡浓度=起始浓度-转化浓度 ②转化率α化学平衡的相关计算③气体的平均分子量化学平衡的相关计算④ 几点定律a、如果保持P、T不变:
则气体的体积比等于物质的量之比,即
则气体的密度比等于摩尔质量之比,即
b、如果保持V、T不变:
则气体的压强比等于气体物质的量之比,即 在一定温度下,容积为20L的容器中充入2molSO2和1molO2发生反应: 2SO2 +O2 2SO3 ,达到平衡时,容器内气体压强为开始时的70%。试求:
①SO2的转化率
②平衡时的O2浓度
③SO3的体积分数
④混合气体的平均相对分子量
⑤平衡时混合气体的密度
例题——常规计算90%0.005mol/L85.7%76.28g/L 1 mol X气体跟a molY气体在体积可变的密闭容器中发生如下反应:X(g) + a Y(g) b Z(g),反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度3/4 ,试求a、b的关系。例题2b-a=1 在一定温度和压强下,将平均分子相对质量为8.5的N2和H2的混合气体,充入密闭容器中反应,达到平衡后,混合气体的平均分子量为10.0,则N2的转化率为____。 练习30%在一定条件下发生反应:
3A(g)+ 2B(g) xC(g)+2D(g),在 2L 的密闭容器中,把 4molA 和 2molB 混合,2min后达到平衡时生成 1.6molC,又测得反应速率 v(D)= 0.2mol·(L·min)-1,
下列说法正确的是( )
A. B 的转化率是20%
B. x= 4
C. A 的平衡浓度是 1.4mol·L-1
D. 平衡时气体压强是原来的 0.94倍练习B C 1体积SO2和3体积空气混合后在450℃以上通过V2O5催化剂发生反应。若同温同压下测得反应前后混合气体的密度比为0.9:1,则SO2的转化率为 例 题A. 90% B. 80%
C. 45% D. 10%B差量法例题——极端假设法 在一定条件下,可逆反应
A2(g) + B2(g) 2C(g) 达平衡时,各物质的平衡浓度分别为c(A2) =0.5mol/L,c(B2) = 0.1mol/L,c(C) = 1.6mol/L 。若用a、b、c分别表示A2、B2、C的起始浓度,则:
(1)a、b应满足的关系
(2)a、b的取值范围
a=b+0.40.4mol/L≤a≤1.3mol/L
0mol/L≤b≤0.9mol/L练习一定条件下,在2SO2+O2≒2SO3的化学平衡体系中,各
物质的浓度分别是2.0mol/L、0.8mol/L、2.4mol/L,则
氧气在反应起始时的浓度可能是
(A)0.8~2mol/L (B) 0~2mol/L
(C) 0~0.8mol/L (D) 无法确定B 在密闭容器中进行如下反应:
X2(气)+Y2(气) 2Z2(气),已知X2、Y2、Z2的起始浓度0.1mol/L、0.3mol/L、0.2mol/L在一定条件下达到达平衡后,各物质的浓度可能为
A、Z2为0.3 mol/L B、Y2为0.35mol/L
C、X2为0.2mol/L D、Z2为0.4mol/LA B练习练习2H3F3(g) 3H2F2(g) , H2F2(g) 2HF(g)
平衡时,平均分子量为 42 ,则H3F3在平衡体系中的体积分数为 ( ) 大于10% B. 等于10%
C. 小于10% D. 无法确定A 将固体NH4I置于密闭容器中,在某温度下发生下列反应 NH4I(s) NH3(g)+HI(g)
2HI(g) H2(g)+I2(g)
当反应达到平衡时,c(H2)=0.5mol/L,c(HI)=4mol/L,则NH3的浓度为( )
A. 3.5mol/L B. 4mol/L
C. 4.5mol/L D. 5mol/L D例题——连续平衡一定条件下,在容积为2L的密闭容器里加入一定物质的量A,发生如下反应并建立平衡: A(g) 2B(g) , 2B(g) C(g) + 2D(g) 测得平衡时各物质的量浓度是: [A]=0.3mol/L, [B]=0.2mol/L, [C]= 0.05mol/L.最初向容器里加入A的物质的量是 ( ) A.0.5mol B.0.8mol C.0.9mol D.1.2mol 练习C
化学反应的方向和限度专题2 化学反应速率与化学平衡 化学平衡状态宿迁中学高二化学组可逆反应:1、如果V正>V逆,则反应向正反应方向进行。
2、如果V正<V逆,则反应向逆反应方向进行。
3、如果V正=V逆,则反应达到平衡状态。4、任何一个可逆反应都不会进行到底的,即任一反应物不可能完全转化为生成物,生成物不可能转化为反应物。最终达到平衡状态时,一定是每一反应物和生成物都存在。化学平衡状态一、化学平衡的研究对象 在同等条件下,同时进行着两个方向的反应,即正反应和逆反应。例N2+3H2 2NH3思考:(1)开始阶段有什么特征?(2)瞬间过后有什么特征?(3)一定时间段后有什么特征?c(SO2) 、c(O2)大,c(SO3) =0, v(正) >0 ,v(逆)=0c(SO2) 、c(O2)逐渐变小,c(SO3) 逐渐增大, v(正)减小, v(逆)增大, v(正)> v(逆) c(SO2) 、c(O2)、c(SO3) 浓度均不再变化,v(正)= v(逆) ≠0二、化学平衡的建立 在一固定容积的密闭容器里,加1molSO2和
1molO2,发生反应2SO2+O2 2SO3V正V逆t1 t(s) V(mol?L-1?S-1)0化学平衡状态V正= V逆≠ 0二、化学平衡的建立2SO2+O2 2SO3 化学平衡状态,就是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。注意三点前提(适用范围):可逆反应内在本质:v(正)= v(逆) ≠0外在标志:反应混合物中各组分
的浓度保持不变三、化学平衡状态的涵义四、化学平衡状态的特征(4)动:动态平衡(v(正)= v(逆) ≠ 0)(2)等:v(正)= v(逆) (3)定:反应混合物中各组分的含量保持不变,各
组分的浓度保持一定。(5)变:条件改变,原平衡可能被破坏,在新的条
件下建立新的平衡。(1)逆:研究对象为可逆反应(等、定)五、化学平衡状态的标志直接判断法① 正反应速率等于逆反应速率v(正)= v(逆)
② 各成分的浓度保持不变间接判断法① 化学键的断裂与形成
各成分的质量、物质的量、质量分数、物质的量分数、转化率等不随时间变化而变化
③ 各气体的分压、各气体的体积不随时间变化而变化特殊标志判断法 反应体系的总压强、总物质的量、总质量、颜色、混合
气体的平均分子量、密度等都是有条件的特殊规律,视具体
反应、具体条件决定是否可作为平衡的标志。 在一定温度下,可逆反应
A(g)+3B(g) 2C(g) 达到平衡的标志是( )
A. C的生成速率与C分解的速率相等
B. 单位时间生成nmolA,同时生成3nmolB
C. 单位时间生成B的速率,与生成C的速率相等
D. 单位时间生成nmolA,同时生成2nmolCA D练习 下列说法中可以充分说明反应:
P(气) + Q(气) R(气)+S(气) , 在恒温下已达平衡状态的是( )
(A) P、Q、R、S的浓度不再变化
(B) P、Q、R、S的分子数比为1:1:1:1
(C)反应容器内P、Q、R、S共存
(D)反应容器内总物质的量不随时间而变化练习A 在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应:
A(固)+3B(气) 2C(气)+D(气)已达平衡状态的是(其中只有B气体有颜色) ( )
A.混合气体的压强 B.混合气体的密度
C.气体的平均分子量 D.气体的颜色BCD练习ACD 在一定温度下,可逆反应A2(气)+B2(气)≒2AB(气)达到平衡的标志是
A、A2、B2、AB的浓度不再变化
B、容器中的压强不再随时间变化
C、单位时间内生成n mol的A2同时生成2n mol的AB
D、 A2、B2、AB的浓度之比为1:1:2
E、单位时间内消耗nmolA2同时消耗nmolB2
F、单位时间内消耗nmol A2同时生成了nmolB2
G、单位时间打断nmol A—A共价键同时打断2nmol
A—B共价键。 ACFG练习 对于可逆反应:N2+3H2 2NH3,在一定温度下,定容的容器中,达到平衡的标志是
A、容器内的压强不再发生变化
B、单位时间内,消耗多少H2,同时生成多少H2
C、氢气、氮气、氨气的量不再发生变化
D、反应停止,H2、N2、NH3的量不再发生变化
E、混合气体的平均分子量不再发生变化
F、容器内混合气体的密度不再发生变化(ABCE)练习练习可逆反应2NO2 ≒2NO+O2在恒容密闭容器中反应,达到平衡状态的标志是 ( )
①单位时间内生成nmol O2 的同时生成2 nmol NO2
②单位时间内生成nmol O2 的同时生成2 nmol NO
③用NO2 、NO 、O2 的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A ① ④ ⑥ B ② ③ ⑤
C ① ③ ④ D ① ② ③ ④ ⑤ ⑥ A六、化学平衡的相关计算⑴基本模式——“三段式”转化: mx nx px qx 平衡:a - mx b - nx px qx ⑵基本关系生成物:平衡浓度=起始浓度+转化浓度 ①反应物:平衡浓度=起始浓度-转化浓度 ②转化率α化学平衡的相关计算③气体的平均分子量化学平衡的相关计算④ 几点定律a、如果保持P、T不变:
则气体的体积比等于物质的量之比,即
则气体的密度比等于摩尔质量之比,即
b、如果保持V、T不变:
则气体的压强比等于气体物质的量之比,即 在一定温度下,容积为20L的容器中充入2molSO2和1molO2发生反应: 2SO2 +O2 2SO3 ,达到平衡时,容器内气体压强为开始时的70%。试求:
①SO2的转化率
②平衡时的O2浓度
③SO3的体积分数
④混合气体的平均相对分子量
⑤平衡时混合气体的密度
例题——常规计算90%0.005mol/L85.7%76.28g/L 1 mol X气体跟a molY气体在体积可变的密闭容器中发生如下反应:X(g) + a Y(g) b Z(g),反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度3/4 ,试求a、b的关系。例题2b-a=1 在一定温度和压强下,将平均分子相对质量为8.5的N2和H2的混合气体,充入密闭容器中反应,达到平衡后,混合气体的平均分子量为10.0,则N2的转化率为____。 练习30%在一定条件下发生反应:
3A(g)+ 2B(g) xC(g)+2D(g),在 2L 的密闭容器中,把 4molA 和 2molB 混合,2min后达到平衡时生成 1.6molC,又测得反应速率 v(D)= 0.2mol·(L·min)-1,
下列说法正确的是( )
A. B 的转化率是20%
B. x= 4
C. A 的平衡浓度是 1.4mol·L-1
D. 平衡时气体压强是原来的 0.94倍练习B C 1体积SO2和3体积空气混合后在450℃以上通过V2O5催化剂发生反应。若同温同压下测得反应前后混合气体的密度比为0.9:1,则SO2的转化率为 例 题A. 90% B. 80%
C. 45% D. 10%B差量法例题——极端假设法 在一定条件下,可逆反应
A2(g) + B2(g) 2C(g) 达平衡时,各物质的平衡浓度分别为c(A2) =0.5mol/L,c(B2) = 0.1mol/L,c(C) = 1.6mol/L 。若用a、b、c分别表示A2、B2、C的起始浓度,则:
(1)a、b应满足的关系
(2)a、b的取值范围
a=b+0.40.4mol/L≤a≤1.3mol/L
0mol/L≤b≤0.9mol/L练习一定条件下,在2SO2+O2≒2SO3的化学平衡体系中,各
物质的浓度分别是2.0mol/L、0.8mol/L、2.4mol/L,则
氧气在反应起始时的浓度可能是
(A)0.8~2mol/L (B) 0~2mol/L
(C) 0~0.8mol/L (D) 无法确定B 在密闭容器中进行如下反应:
X2(气)+Y2(气) 2Z2(气),已知X2、Y2、Z2的起始浓度0.1mol/L、0.3mol/L、0.2mol/L在一定条件下达到达平衡后,各物质的浓度可能为
A、Z2为0.3 mol/L B、Y2为0.35mol/L
C、X2为0.2mol/L D、Z2为0.4mol/LA B练习练习2H3F3(g) 3H2F2(g) , H2F2(g) 2HF(g)
平衡时,平均分子量为 42 ,则H3F3在平衡体系中的体积分数为 ( ) 大于10% B. 等于10%
C. 小于10% D. 无法确定A 将固体NH4I置于密闭容器中,在某温度下发生下列反应 NH4I(s) NH3(g)+HI(g)
2HI(g) H2(g)+I2(g)
当反应达到平衡时,c(H2)=0.5mol/L,c(HI)=4mol/L,则NH3的浓度为( )
A. 3.5mol/L B. 4mol/L
C. 4.5mol/L D. 5mol/L D例题——连续平衡一定条件下,在容积为2L的密闭容器里加入一定物质的量A,发生如下反应并建立平衡: A(g) 2B(g) , 2B(g) C(g) + 2D(g) 测得平衡时各物质的量浓度是: [A]=0.3mol/L, [B]=0.2mol/L, [C]= 0.05mol/L.最初向容器里加入A的物质的量是 ( ) A.0.5mol B.0.8mol C.0.9mol D.1.2mol 练习C
