影响化学平衡的因素[上学期]
文档属性
| 名称 | 影响化学平衡的因素[上学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 600.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-11-03 00:00:00 | ||
图片预览









文档简介
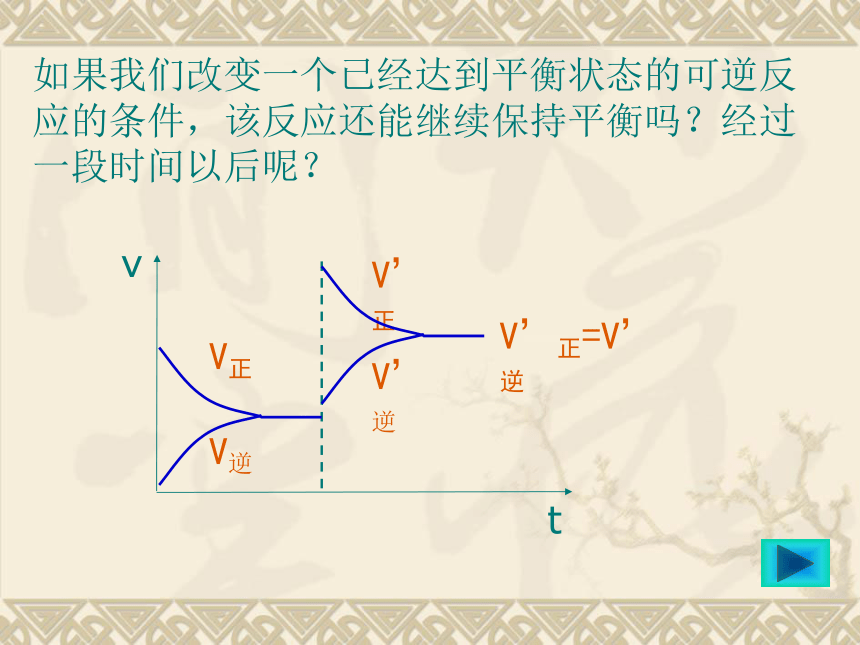
课件47张PPT。复习:化学平衡所研究的对象是什么?化学平衡是一种静止的平衡状态吗?决定可逆反应形成化学平衡状态的因素是什么?注意:V正 = V逆是指同一种物质的生成速率和分解速率。如果我们改变一个已经达到平衡状态的可逆反应的条件,该反应还能继续保持平衡吗?经过一段时间以后呢?在19世纪后期,人们发现炼铁高炉所排出的高炉气中含有相当量的CO。经检测,用这个高炉炼铁,高炉气中CO含量不变。工程师认为这是由于CO和铁矿石的接触时间不够长所造成的,于是在英国建造了一个高大的炼铁高炉,以增加CO和铁矿石的接触时间。
思考?对于一个可逆反应而言,CO的含量保持不变,这是达到了什么状态,具备什么样的特点?如果你作为一名工程师,会尝试改变哪些条件来减少CO的含量?第三节
影响化学平衡的条件化 学 平 衡 的 移 动化学平衡移动本质:V正=V逆①研究对象:是已经建立平衡状态的可逆反应。②移动原因:③移动方向:V正’ >V逆’
V正’=V逆’
V正’ <V逆’ 向正反应移动
不移动
向逆反应移动概念:可逆反应中,由于条件的改变,引起反应速率变化,从而导致旧的化学平衡的破坏、新的化学平衡的建立的过程叫化学平衡的移动。改变浓度是否会影响平衡实验1:将10mL0.01mol/L的KSCN溶液与10mL0.01mol/L的FeCl3溶液混合同时生成Fe(SCN)2+,Fe(SCN)2+,
Fe(SCN)4-,Fe(SCN)52-,Fe(SCN)63-
等显红色的离子继续往混合溶液中滴加1mol/L的KSCN溶液,预测溶液颜色会发生怎样的变化?红色加深浓度增大有人认为溶液颜色加深,是因为原混合液中过量的FeCl3,和加入的KSCN继续反应,使生成物浓度增加,溶液颜色加深,你赞同该看法吗?实验2试设计一个实验验证该看法是否成立?混合液中滴加FeCl3浓溶液红色
加深浓度增大结论溶液颜色加深是因为增大反应物的浓度,平衡向右移动,生成物浓度增加,混合溶液颜色加深。实验3化 学 平 衡 结论:
在其他条件不变时,
增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;
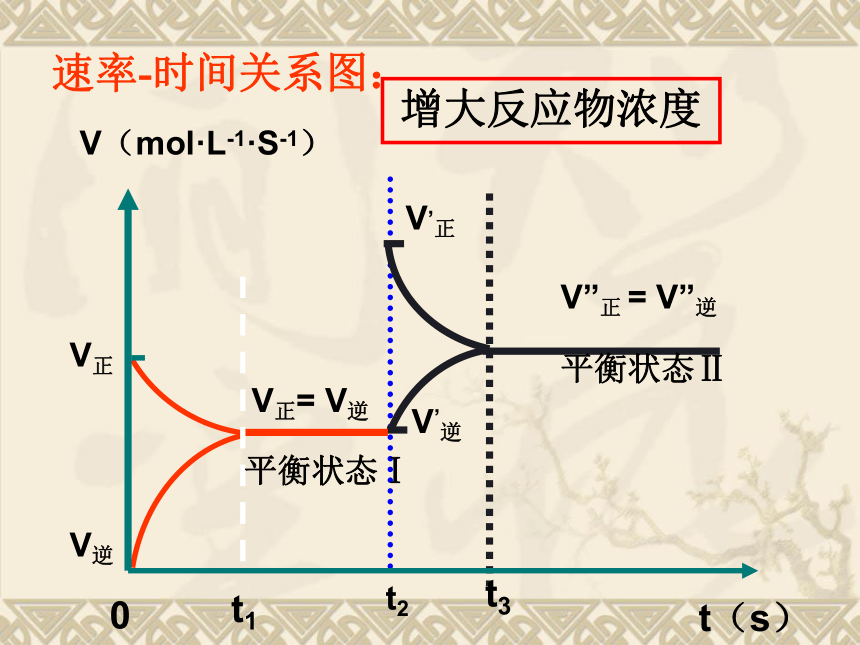
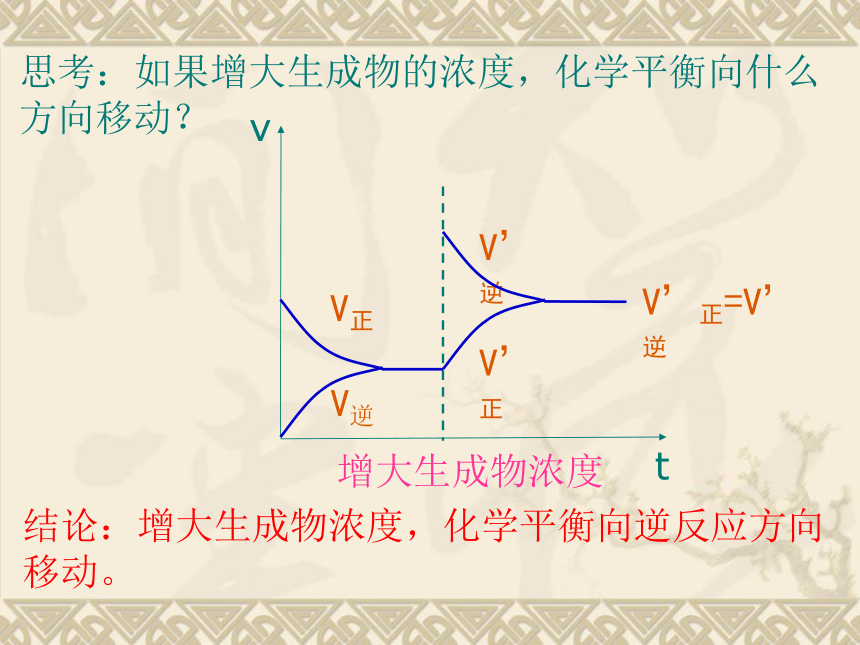
增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动。一、浓度对化学平衡的影响:化 学 平 衡 的 移 动t2V”正 = V”逆V’逆V,正t3平衡状态Ⅱ增大反应物浓度速率-时间关系图:增大生成物浓度结论:增大生成物浓度,化学平衡向逆反应方向移动。思考:如果增大生成物的浓度,化学平衡向什么方向移动?减小生成物浓度结论:减小生成物浓度,化学平衡向正反应方向移动。思考:如果减小生成物的浓度,化学平衡向什么方向移动?减小反应物浓度结论:减小生成物浓度,化学平衡向逆反应方向移动。思考:如果减小反应物的浓度,化学平衡向什么方向移动?总结:增大反应物浓度减小生成物浓度增大生成物浓度减小生成物浓度化学平衡向逆反应方向移动化学平衡向正反应方向移动减小反应物浓度增大生成物浓度减小生成物浓度减小生成物浓度趋势趋势思考:化学平衡的移动能完全抵消浓度改变给可逆反应所带来的影响吗?思考:既然改变浓度会使平衡移动,那么在
反应中,能否通过改变浓度来减小CO含量呢?注意:
⑴改变固体或纯液体的量不会引起平衡移动。
⑵改变浓度一般通过改变物质的量来实现,但是改变物质的量不一定改变浓度。
⑶对于离子反应,只能改变实际参加反应的离子的浓度才能改变平衡。
⑷对于一般的可逆反应(有两种反应物),增大一种反应物的浓度,会提高另一种反应物的转化率,而本身的转化率降低。
⑸在生产上,往往采用增大容易取得或成本较低的反应物浓度的方法,使成本较高的原料得到充分的利用。压强对化学平衡的影响演示[实验1-5]
2NO2(气) N2O4(气)
现象:(2体积,红棕色)(1体积,无色)压强对化学平衡的影响2NO2(气) N2O4(气)
(红棕色)(无色)[讨论]A:当加压气体体积缩小时,混和气体颜色先变深
是由于① 后又逐渐变浅是由于 ②
;
B:当减压气体体积增大时,混和气体颜色先变浅
是由于① ,后又逐渐变深是由
于②_____________________。
NO2浓度增大 NO2浓度减小 平衡向正反应方向移动平衡向逆反应方向移动 判断压强引起平衡移动的思路:
压强如何改变?压强变化是否引起体积变化?
若体积变化则浓度发生改变
浓度改变则引起速率的变化
速率变化后,若导致V正 ≠V逆时平衡移动
若V正 = V逆时,则平衡不移动 压强的影响原因:P2 > P3 > P1P1 > P3 > P2t2V”正 = V”逆V’逆V’正其他条件不变,增大压强速率-时间关系图:若a+b>c+d压强引起平衡移动的相关图象⑴当 a + b> c + d时:⑵当 a + b< c + d 时:压强对化学平衡的影响[注意] ①对于反应前后气体总体积相等的反应,改变压强对
平衡无影响;总结:增大压强减小压强化学平衡向体积增大的方向移动化学平衡向体积减小的方向移动减小压强增大压强趋势趋势总的来说:化学平衡的移动能削弱压强改变给可逆反应所带来的影响,但并不能完全抵消。化 学 平 衡二、压强的影响:结论:
在其他条件不变时,
增大压强,平衡向气体体积缩小的方向移动;
减小压强,平衡向气体体积增大的方向移动。化 学 平 衡 的 移 动改变压强的方式:
1.改变体积;
2.体积不变,加入气体压强对化学平衡的影响[注意] ①对于反应前后气体总体积相等的反应,改变压强对平衡无影响;
②平衡混合物都是固体或液体的,改变压强不能使平衡移动;
③压强的变化必须改变混合物浓度(即容器体积有变化或按原比例加入物质)才能使平衡移动。1. 恒温下, 反应aX(g) bY(g) +cZ(g)达到平衡后, 把容器体积压缩到原来的一半且达到新平衡时, X的物质的量浓度由0.1mol/L增大到0.19mol/L, 下列判断正确 的是( ) A. a>b+c B. a<b+c C. a=b+c D. a=b=c 练习:2.反应2HI(g) H2(g)+I2(g) ,在一密闭容器中,当达到平衡时,欲使混合气体颜色加深,可采取的措施有 _______________
A减小容器体积 B恒容下充入H2
C恒容下充入 I2 D恒容下充入HI气体 A C DA(2)若只改变压强,反应速率发生变化,
但平衡不发生移动,则A——态,B 态,
D——态。 气 液(固)
气三、温度对于化学平衡的影响思考:实验现象说明了什么?思考:升高温度对可逆反应的化学反应速率有怎样的影响?对吸热反应和放热反应的速率影响有何不同?画出升温时上述反应的v-t图结论:混和气体受热颜色变深;遇冷颜色变浅。温度对化学平衡的影响 2NO2(气) N2O4(气) +57千焦(红棕色)(无色)[讨论]A:混和气体受热颜色变深,说明① ;
② 。
B:混和气体遇冷颜色变浅,说明① ;
② 。
NO2浓度增大 平衡向逆反应方向移动NO2浓度减小 平衡向正反应方向移动三、温度对化学平衡的影响: 在其它条件不变的情况下,
升高温度,平衡向吸热反应方向移动。
降低温度,平衡向放热反应方向移动。1.结论:2.原因分析: 在其它条件不变的情况下, 升高温度, 不管是吸热反应还是放热反应,反应速率都增大,但吸热反应增大的倍数大于放热反应增大的倍数,故平衡向吸热反应的方向移动.化 学 平 衡 的 移 动t2V”正 = V”逆V’逆V‘正升高温度3.速率 |时间关系图:三、温度对化学平衡的影响:温度对化学平衡的影响[结论]在其它条件不变的情况下:
A:温度升高,会使化学平衡向着吸热反应的方向移动;
B:温度降低,会使化学平衡向着放热反应的方向移动。T2 >T3 >T1T1 >T3 > T2总结:升高温度降低温度化学平衡向放热的方向移动化学平衡向吸热的方向移动降低温度升高温度趋势趋势总的来说:化学平衡的移动能削弱温度改变给可逆反应所带来的影响,但并不能完全抵消。化 学 平 衡4、催化剂:说明:使用催化剂可同等程度地改变正、逆反应的速率,因而不能影响平衡状态,但能改变达平衡所需要的时间。Vt图解:化 学 平 衡 的 移 动正催化剂化 学 平 衡小结:正反应方向移逆反应方向移体积缩小方移体积扩大方移向吸热方向移向放热方向移向减弱这个改
变的方向移动反应物浓度减小反应物浓度增大体系压强减小体系压强增大体系温度减小体系温度增大减弱这种改变规
律改变一个条件化 学 平 衡 的 移 动五、勒夏特列原理根据浓度、压强、温度对化学平衡的影响,能不能概括出一个外界条件与平衡移动方向关系的普遍原理?定义:化学平衡总是朝着能减弱外界条件影响的方向移动,但结果却不能完全抵消外界条件的影响。化 学 平 衡平衡移动原理(即:勒夏特列原理) 如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。
由于外界条件的变化,引起正反应速率和逆反应速率的相应改变而造成的。
1、定义:2、原因:化 学 平 衡 的 移 动注意:
①是“减弱”这种改变,不是“消除”这种改变
②只有单个条件改变,才能应用(多个条件改变就要具体问题具体分析)
③勒沙特列原理适用于任何动态平衡体系(如:溶解平衡、电离平衡等),未平衡状态不能用此来分析1.下列能用勒沙特列原理解释的是_________
①.棕红色NO2加压后颜色先变深后变浅
②. Fe(SCN)3溶液中加入固体KSCN后颜色变深
③. 氯水宜保存在低温、避光条件下
④. SO2催化氧化成SO3的反应,往往加入过量的空气
⑤.向AgCl悬浊液中加入KI溶液有黄色沉淀生成
⑥. 打开易拉罐有大量气泡冒出
⑦.加催化剂,使氮气和氢气在一定条件下转化为氨气 巩固练习2.(‘02天津)对已达化学平衡的下列反应2X(g)+Y(g) 2Z(g)减小压强时,对反应产生影响的是 ( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率增大,平衡向正反应方向移动3.(‘00上海)对于反应2SO2+O2 2SO3 ( g) ,下列判断中正确的是 ( )
A.2体积SO2和足量O2反应,必定生成2体积SO3
B.其他条件不变,增大压强,平衡必定向右移动
C.平衡时,SO2消耗速度必定等于O2生成速率的两倍
D.平衡时,SO2浓度必定等于O2浓度的两倍CBC4.在一密闭容器中,反应mA(s)+nB(g) pC(g),达到平时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.2mol·L-1。则下列判断正确的是 ( )
A.化学计量数:m+n
思考?对于一个可逆反应而言,CO的含量保持不变,这是达到了什么状态,具备什么样的特点?如果你作为一名工程师,会尝试改变哪些条件来减少CO的含量?第三节
影响化学平衡的条件化 学 平 衡 的 移 动化学平衡移动本质:V正=V逆①研究对象:是已经建立平衡状态的可逆反应。②移动原因:③移动方向:V正’ >V逆’
V正’=V逆’
V正’ <V逆’ 向正反应移动
不移动
向逆反应移动概念:可逆反应中,由于条件的改变,引起反应速率变化,从而导致旧的化学平衡的破坏、新的化学平衡的建立的过程叫化学平衡的移动。改变浓度是否会影响平衡实验1:将10mL0.01mol/L的KSCN溶液与10mL0.01mol/L的FeCl3溶液混合同时生成Fe(SCN)2+,Fe(SCN)2+,
Fe(SCN)4-,Fe(SCN)52-,Fe(SCN)63-
等显红色的离子继续往混合溶液中滴加1mol/L的KSCN溶液,预测溶液颜色会发生怎样的变化?红色加深浓度增大有人认为溶液颜色加深,是因为原混合液中过量的FeCl3,和加入的KSCN继续反应,使生成物浓度增加,溶液颜色加深,你赞同该看法吗?实验2试设计一个实验验证该看法是否成立?混合液中滴加FeCl3浓溶液红色
加深浓度增大结论溶液颜色加深是因为增大反应物的浓度,平衡向右移动,生成物浓度增加,混合溶液颜色加深。实验3化 学 平 衡 结论:
在其他条件不变时,
增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;
增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动。一、浓度对化学平衡的影响:化 学 平 衡 的 移 动t2V”正 = V”逆V’逆V,正t3平衡状态Ⅱ增大反应物浓度速率-时间关系图:增大生成物浓度结论:增大生成物浓度,化学平衡向逆反应方向移动。思考:如果增大生成物的浓度,化学平衡向什么方向移动?减小生成物浓度结论:减小生成物浓度,化学平衡向正反应方向移动。思考:如果减小生成物的浓度,化学平衡向什么方向移动?减小反应物浓度结论:减小生成物浓度,化学平衡向逆反应方向移动。思考:如果减小反应物的浓度,化学平衡向什么方向移动?总结:增大反应物浓度减小生成物浓度增大生成物浓度减小生成物浓度化学平衡向逆反应方向移动化学平衡向正反应方向移动减小反应物浓度增大生成物浓度减小生成物浓度减小生成物浓度趋势趋势思考:化学平衡的移动能完全抵消浓度改变给可逆反应所带来的影响吗?思考:既然改变浓度会使平衡移动,那么在
反应中,能否通过改变浓度来减小CO含量呢?注意:
⑴改变固体或纯液体的量不会引起平衡移动。
⑵改变浓度一般通过改变物质的量来实现,但是改变物质的量不一定改变浓度。
⑶对于离子反应,只能改变实际参加反应的离子的浓度才能改变平衡。
⑷对于一般的可逆反应(有两种反应物),增大一种反应物的浓度,会提高另一种反应物的转化率,而本身的转化率降低。
⑸在生产上,往往采用增大容易取得或成本较低的反应物浓度的方法,使成本较高的原料得到充分的利用。压强对化学平衡的影响演示[实验1-5]
2NO2(气) N2O4(气)
现象:(2体积,红棕色)(1体积,无色)压强对化学平衡的影响2NO2(气) N2O4(气)
(红棕色)(无色)[讨论]A:当加压气体体积缩小时,混和气体颜色先变深
是由于① 后又逐渐变浅是由于 ②
;
B:当减压气体体积增大时,混和气体颜色先变浅
是由于① ,后又逐渐变深是由
于②_____________________。
NO2浓度增大 NO2浓度减小 平衡向正反应方向移动平衡向逆反应方向移动 判断压强引起平衡移动的思路:
压强如何改变?压强变化是否引起体积变化?
若体积变化则浓度发生改变
浓度改变则引起速率的变化
速率变化后,若导致V正 ≠V逆时平衡移动
若V正 = V逆时,则平衡不移动 压强的影响原因:P2 > P3 > P1P1 > P3 > P2t2V”正 = V”逆V’逆V’正其他条件不变,增大压强速率-时间关系图:若a+b>c+d压强引起平衡移动的相关图象⑴当 a + b> c + d时:⑵当 a + b< c + d 时:压强对化学平衡的影响[注意] ①对于反应前后气体总体积相等的反应,改变压强对
平衡无影响;总结:增大压强减小压强化学平衡向体积增大的方向移动化学平衡向体积减小的方向移动减小压强增大压强趋势趋势总的来说:化学平衡的移动能削弱压强改变给可逆反应所带来的影响,但并不能完全抵消。化 学 平 衡二、压强的影响:结论:
在其他条件不变时,
增大压强,平衡向气体体积缩小的方向移动;
减小压强,平衡向气体体积增大的方向移动。化 学 平 衡 的 移 动改变压强的方式:
1.改变体积;
2.体积不变,加入气体压强对化学平衡的影响[注意] ①对于反应前后气体总体积相等的反应,改变压强对平衡无影响;
②平衡混合物都是固体或液体的,改变压强不能使平衡移动;
③压强的变化必须改变混合物浓度(即容器体积有变化或按原比例加入物质)才能使平衡移动。1. 恒温下, 反应aX(g) bY(g) +cZ(g)达到平衡后, 把容器体积压缩到原来的一半且达到新平衡时, X的物质的量浓度由0.1mol/L增大到0.19mol/L, 下列判断正确 的是( ) A. a>b+c B. a<b+c C. a=b+c D. a=b=c 练习:2.反应2HI(g) H2(g)+I2(g) ,在一密闭容器中,当达到平衡时,欲使混合气体颜色加深,可采取的措施有 _______________
A减小容器体积 B恒容下充入H2
C恒容下充入 I2 D恒容下充入HI气体 A C DA(2)若只改变压强,反应速率发生变化,
但平衡不发生移动,则A——态,B 态,
D——态。 气 液(固)
气三、温度对于化学平衡的影响思考:实验现象说明了什么?思考:升高温度对可逆反应的化学反应速率有怎样的影响?对吸热反应和放热反应的速率影响有何不同?画出升温时上述反应的v-t图结论:混和气体受热颜色变深;遇冷颜色变浅。温度对化学平衡的影响 2NO2(气) N2O4(气) +57千焦(红棕色)(无色)[讨论]A:混和气体受热颜色变深,说明① ;
② 。
B:混和气体遇冷颜色变浅,说明① ;
② 。
NO2浓度增大 平衡向逆反应方向移动NO2浓度减小 平衡向正反应方向移动三、温度对化学平衡的影响: 在其它条件不变的情况下,
升高温度,平衡向吸热反应方向移动。
降低温度,平衡向放热反应方向移动。1.结论:2.原因分析: 在其它条件不变的情况下, 升高温度, 不管是吸热反应还是放热反应,反应速率都增大,但吸热反应增大的倍数大于放热反应增大的倍数,故平衡向吸热反应的方向移动.化 学 平 衡 的 移 动t2V”正 = V”逆V’逆V‘正升高温度3.速率 |时间关系图:三、温度对化学平衡的影响:温度对化学平衡的影响[结论]在其它条件不变的情况下:
A:温度升高,会使化学平衡向着吸热反应的方向移动;
B:温度降低,会使化学平衡向着放热反应的方向移动。T2 >T3 >T1T1 >T3 > T2总结:升高温度降低温度化学平衡向放热的方向移动化学平衡向吸热的方向移动降低温度升高温度趋势趋势总的来说:化学平衡的移动能削弱温度改变给可逆反应所带来的影响,但并不能完全抵消。化 学 平 衡4、催化剂:说明:使用催化剂可同等程度地改变正、逆反应的速率,因而不能影响平衡状态,但能改变达平衡所需要的时间。Vt图解:化 学 平 衡 的 移 动正催化剂化 学 平 衡小结:正反应方向移逆反应方向移体积缩小方移体积扩大方移向吸热方向移向放热方向移向减弱这个改
变的方向移动反应物浓度减小反应物浓度增大体系压强减小体系压强增大体系温度减小体系温度增大减弱这种改变规
律改变一个条件化 学 平 衡 的 移 动五、勒夏特列原理根据浓度、压强、温度对化学平衡的影响,能不能概括出一个外界条件与平衡移动方向关系的普遍原理?定义:化学平衡总是朝着能减弱外界条件影响的方向移动,但结果却不能完全抵消外界条件的影响。化 学 平 衡平衡移动原理(即:勒夏特列原理) 如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。
由于外界条件的变化,引起正反应速率和逆反应速率的相应改变而造成的。
1、定义:2、原因:化 学 平 衡 的 移 动注意:
①是“减弱”这种改变,不是“消除”这种改变
②只有单个条件改变,才能应用(多个条件改变就要具体问题具体分析)
③勒沙特列原理适用于任何动态平衡体系(如:溶解平衡、电离平衡等),未平衡状态不能用此来分析1.下列能用勒沙特列原理解释的是_________
①.棕红色NO2加压后颜色先变深后变浅
②. Fe(SCN)3溶液中加入固体KSCN后颜色变深
③. 氯水宜保存在低温、避光条件下
④. SO2催化氧化成SO3的反应,往往加入过量的空气
⑤.向AgCl悬浊液中加入KI溶液有黄色沉淀生成
⑥. 打开易拉罐有大量气泡冒出
⑦.加催化剂,使氮气和氢气在一定条件下转化为氨气 巩固练习2.(‘02天津)对已达化学平衡的下列反应2X(g)+Y(g) 2Z(g)减小压强时,对反应产生影响的是 ( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率增大,平衡向正反应方向移动3.(‘00上海)对于反应2SO2+O2 2SO3 ( g) ,下列判断中正确的是 ( )
A.2体积SO2和足量O2反应,必定生成2体积SO3
B.其他条件不变,增大压强,平衡必定向右移动
C.平衡时,SO2消耗速度必定等于O2生成速率的两倍
D.平衡时,SO2浓度必定等于O2浓度的两倍CBC4.在一密闭容器中,反应mA(s)+nB(g) pC(g),达到平时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.2mol·L-1。则下列判断正确的是 ( )
A.化学计量数:m+n
C.物质B的转化率减小了 D.物质C的质量分数增加了
5.(05全国卷Ⅱ)已知反应A2(g)+2B2(g) 2AB2(g)的△H<0(放热),下列说法正确的( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动DB6.(05天津)在密闭容器中,在一定条件下,进行下列反应:NO(g) + CO(g) 1/2N2(g) + CO2(g);△H = -373.2 KJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强7.可逆反应2X+Y2 Z(g)(正反应为放热反应)达到平衡。升高温度后混合气体的平均相对分子质量将下降,则下列情况正确的是( )
A.X和Y可能都是固体 B.X和Y一定都是气体 C.X和Y可能都是气体 D.X和Y中只有一种为气体BCD
