化学平衡2[上学期]
图片预览





文档简介
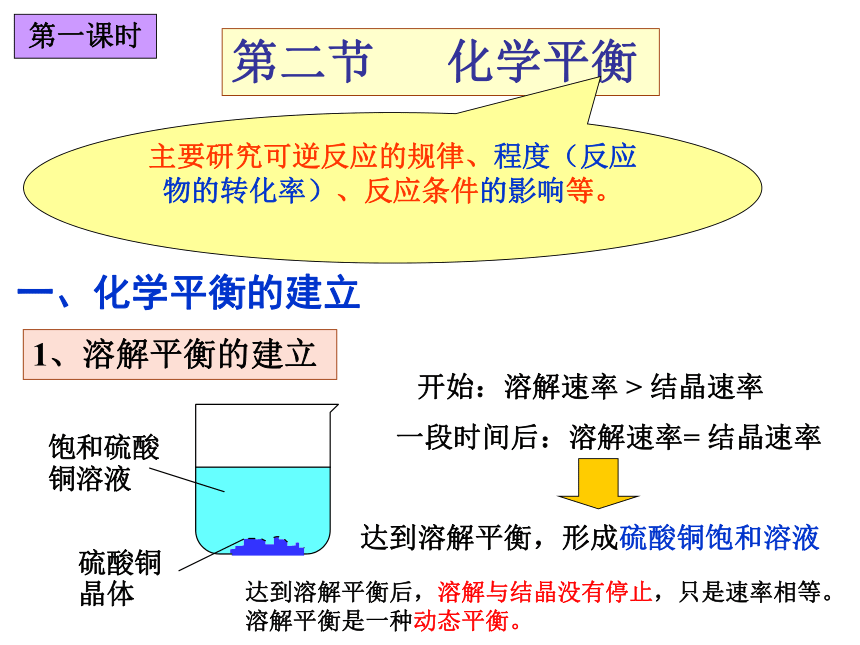
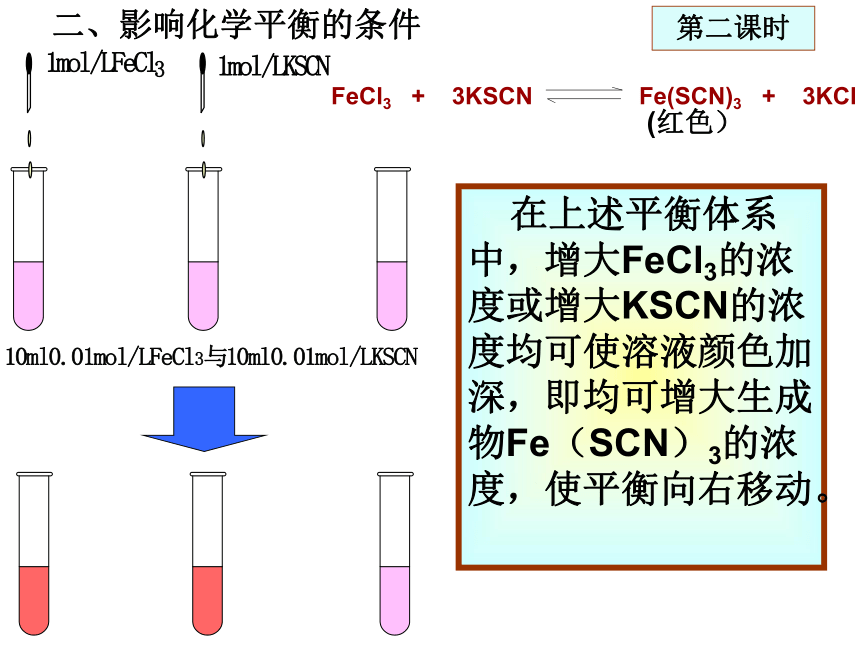
课件16张PPT。第二节 化学平衡主要研究可逆反应的规律、程度(反应物的转化率)、反应条件的影响等。1、溶解平衡的建立一、化学平衡的建立开始:溶解速率 > 结晶速率一段时间后:溶解速率= 结晶速率达到溶解平衡,形成硫酸铜饱和溶液第一课时达到溶解平衡后,溶解与结晶没有停止,只是速率相等。溶解平衡是一种动态平衡。2、可逆反应化学平衡的建立CO + H2O(g) CO2 + H2 起始浓度mol/L0.010.0100 随着反应的进行,反应物浓度逐渐减少,正反应速率逐渐减小;生成物浓度逐渐增大,逆反应速率逐渐增大。一段时间后,反应物、生成物浓度保持一定,V正=V逆 ,达到化学平衡状态。改变浓度mol/L平衡浓度mol/L0.0050.0050.0050.005+0.005+0.005-0.005-0.005t10t10:时间V正最大,V逆=0V正逐渐减小V逆逐渐增大t1以后V正V逆=平衡状态3、化学平衡的概念在一定条件下的可逆反应里,正反应和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。它的建立与反应途径无关,从正反应或逆反应开始都可以建立平衡状态。 4、化学平衡特征动: V正= V逆≠0,动态平衡定: 各组分浓度一定或物质的量一定(不是相等)变: 外界条件改变,平衡被破坏,平衡将发生移 动而建立新的平衡。逆:指可逆反应。等:V正=V逆(数值不一定相等) 5、化学平衡的特点:化学平衡的建立与途径无关,只要条件相同,同一个化学平衡的建立既可从正方向建立,也可从逆方向建立。CD(CD)课堂练习D 化学平衡移动原因:反应条件改变,引起V正≠ V逆结果:速率、各组分浓度与原平衡比较均发生变化方向V正 > V逆 平衡向正反应方向移动V正 = V逆 平衡不移动V正 < V逆 平衡向逆反应方向移动二、影响化学平衡的条件第二课时二、影响化学平衡的条件第二课时 在上述平衡体系中,增大FeCl3的浓度或增大KSCN的浓度均可使溶液颜色加深,即均可增大生成物Fe(SCN)3的浓度,使平衡向右移动。 1、浓度对化学平衡的影响分析t1t2t3应用 增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动;结论 在生产上,往往采用增大容易取得的或成本较低的反应物浓度的方法,使成本较高的原料得到充分利用。2SO2 + O2 2SO3增大反应物的浓度对化学平衡的影响2、压强对化学平衡的影响材料分析N2 + 3H2 2NH3450℃时N2与H2反应生成NH3的实验数据压强/MPaNH3/%12.059.21016.43035.56053.610069.4结论 在其它条件不变的情况下,增大压强,会使化学平衡向着气体体积缩小的方向移动;减小压强,会使平衡向着气体体积增大的方向移动.注意1、反应前后气态物质的总体积没有变化的可逆反应,增大或减小压强不能使化学平衡移动。例:2HI(g) H2(g) + I2(g)2、没有气体参与的反应,压强改变,浓度不变,平衡不移动。 增大压强,体积减小,浓度同等程度增大,颜色变深,但平衡不移动。增大压强对下列两个化学平衡的影响图象分析t1t2t3t23、温度对化学平衡的影响 化学反应的本质是旧化学键的断裂和新化学键的形成,所以化学反应总是伴随着能量的变化,吸热反应或放热反应。结论:其它条件不变的情况下,温度升高,平衡向吸热反应方向移动;温度降低,平衡向放热反应方向移动。第三课时平衡移动原理 勒夏特列原理如果改变影响平衡的一个条件(如浓度、压强、温度等),平衡就向能够减弱这种改变的方向移动。催化剂:能够同等程度地增加正反应速率和逆反应速率,因此它对化学平衡和移动没有影响。但能缩短到达平衡所需的时间。t1t2反应速率时间讨论 下列反应达到化学平衡时:
2SO2(g) + O2(g) 2SO3(g)+ Q(正反应为放热反应)如果其它条件不变时,分别改变下列条件,将对化学平衡有何影响?②增大O2的浓度①增大压强③减少SO3的浓度④升高温度⑤使用催化剂右移右移右移左移不移动三、化学平衡的有关计算—程序法第四课时1、建立解题程序模式mA(g)+nB(g) pC(g)+qD(g)起始浓度或物质的量转化浓度或物质的量平衡浓度或物质的量2、确定关系(1)确定转化浓度或物质的量是解题的关键(2)反应物:平衡浓度=起始浓度- 转化浓度
生成物:平衡浓度=起始浓度+ 转化浓度(3)反应物的转化率数值之比等于方程式中相应物质系数之比。
3、依照题意,列式求解解题的突破点[由方程式系数求出]n平(生成物)=n转(生成物)n转(反应物)n平(反应物)4、有关计算关系(1)如果保持P、T不变:则气体的体积比等于物质的量之比,即
(2)如果保持V、T不变:则气体的压强比等于气体物质的量之比,即将等物质的量的A,B混合于2L的密闭容器中,发生反应
3A(气)+B(气)= aC(气)+2D(气) 经5min后达到平衡时,测知D的浓度为0.5mol/L,[A]:[B]=3∶5,C的平均反应速率为0.1mol/L·min。试求(1)A的平衡浓度是多少?(2)B的平均反应速率?(3)a=?例题根据化学反应速率与反应方程式系数成比例的规律,不难得到
(2)vB=vD/2=0.05mol/(L·min);
(3)vC=vD,∴a=2设:A的起始浓度为Xmol/L;B的平均反应速度为VB3A(气)+B(气) aC(气)+2D(气)起始浓度(mol/L)变化浓度(mol/L)平衡浓度(mol/L)XX000.5+0.5+0.25a-0.75-0.25X-0.75X-0.250.25a(1)由(x-0.75):(x-0.25)=3:5,得x= 1.5(mol/L) ∴A的平衡浓度为1.5-0.75=0.75mol/L
2SO2(g) + O2(g) 2SO3(g)+ Q(正反应为放热反应)如果其它条件不变时,分别改变下列条件,将对化学平衡有何影响?②增大O2的浓度①增大压强③减少SO3的浓度④升高温度⑤使用催化剂右移右移右移左移不移动三、化学平衡的有关计算—程序法第四课时1、建立解题程序模式mA(g)+nB(g) pC(g)+qD(g)起始浓度或物质的量转化浓度或物质的量平衡浓度或物质的量2、确定关系(1)确定转化浓度或物质的量是解题的关键(2)反应物:平衡浓度=起始浓度- 转化浓度
生成物:平衡浓度=起始浓度+ 转化浓度(3)反应物的转化率数值之比等于方程式中相应物质系数之比。
3、依照题意,列式求解解题的突破点[由方程式系数求出]n平(生成物)=n转(生成物)n转(反应物)n平(反应物)4、有关计算关系(1)如果保持P、T不变:则气体的体积比等于物质的量之比,即
(2)如果保持V、T不变:则气体的压强比等于气体物质的量之比,即将等物质的量的A,B混合于2L的密闭容器中,发生反应
3A(气)+B(气)= aC(气)+2D(气) 经5min后达到平衡时,测知D的浓度为0.5mol/L,[A]:[B]=3∶5,C的平均反应速率为0.1mol/L·min。试求(1)A的平衡浓度是多少?(2)B的平均反应速率?(3)a=?例题根据化学反应速率与反应方程式系数成比例的规律,不难得到
(2)vB=vD/2=0.05mol/(L·min);
(3)vC=vD,∴a=2设:A的起始浓度为Xmol/L;B的平均反应速度为VB3A(气)+B(气) aC(气)+2D(气)起始浓度(mol/L)变化浓度(mol/L)平衡浓度(mol/L)XX000.5+0.5+0.25a-0.75-0.25X-0.75X-0.250.25a(1)由(x-0.75):(x-0.25)=3:5,得x= 1.5(mol/L) ∴A的平衡浓度为1.5-0.75=0.75mol/L
