化学平衡3[上学期]
图片预览








文档简介
课件25张PPT。化学平衡状态的特征及其应用2回顾并思考以下问题:1、化学平衡状态的涵义是什么?
2、化学平衡状态的特征是什么?你能用简练的语言概括出来吗?
3、如何根据化学平衡状态的特征来判断一个可逆反应是否达到了平衡呢? 3①“逆”:可逆反应。
②“等”:υ正 = υ逆 。
③“动”:υ正 = υ逆≠ 0 。
④“定”:外界条件一定,各组成成分的百分含量保持不变。
⑤“变”:外界条件改变时,若υ正 ≠υ逆 且υ正 > υ逆 平衡向正反应方向移动;若υ正 < υ逆平衡向逆反应方向移动。 4[例1] 在一定的温度下,可逆反应:A(g)+ 3B(g)=== 2C(g)达到平衡的标志是( )
A.C的生成速率与C的分解速率相等。
B.单位时间生成n molA,同时生成3n molB。
C.A、B、C的物质的量浓度保持不变。
D.A、B、C的分子数之比为1 :3 :2 。
E.容器中气体的密度保持不变。
F.混合气体的平均摩尔质量保持不变。
G.容器中气体的总压强保持不变。A、C、F5[小结]化学平衡状态的标志: (1)υ正 = υ逆 (本质特征)
① 同一种物质:该物质的生成速率等于它的消耗速率。
② 不同的物质:速率之比等于方程式中各物质的计量数之比,但必须是不同方向的速率。6(2)反应混合物中各组成成分的含 量保持不变(外部表现): ① 各组成成分的质量、物质的量、分子数、体积(气体)、物质的量浓度均保持不变。
② 各组成成分的质量分数、物质的量分数、气体的体积分数均保持不变。
③ 若反应前后的物质都是气体,且总体积不等,则气体的总物质的量、总压强(恒温、恒容)、平均摩尔质量、混合气体的密度(恒温、恒压)均保持不变。
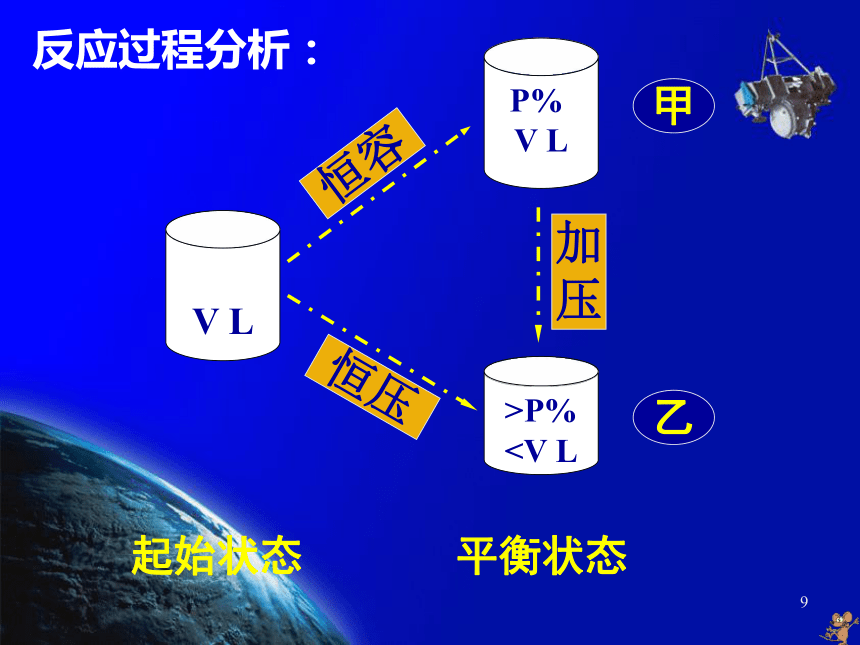
④ 反应物的转化率、产物的产率保持不变。 7 从上述分析可知,当条件发生变化时,如果使得υ正 ≠ υ逆,平衡就有可能会发生移动。当平衡移动时,上述那些物理量又将如何变化呢? 8[例2] 体积相同的甲、乙两个容器中, 分别都充有等物质的量的SO2和O2,在相 同温度下发生反应:2SO2(g)+ O2(g)==== 2SO3(g)并达到平衡,反应过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为P%,则乙容器中SO2的转化率为( )。
A.等于P% B.大于P%
C.小于P% D.无法判断催化剂▲B9
V L P%
V L>P%
压甲乙起始状态 平衡状态 反应过程分析:[拓展] 对于aA(g)+bB(g) == dD(g),分别 取等物质的量的A和B,充入体积相同的甲、乙两个容器中,甲容器保持体积不变,乙容器保持压强不变。试分别讨论:在相同温度下,当 ① n前>n后,② n前=n后, ③ n前 乙甲 = 乙甲 > 乙甲 < 乙甲 = 乙甲 < 乙甲 > 乙甲 = 乙甲 < 乙甲 > 乙甲 > 乙甲 < 乙甲 < 乙甲 = 乙甲 < 乙12>VLVL VL定容定压减
压甲乙a+b A.4molA+1molB B.2molA+2molB
C.4molA+2molB D.3molC+1molD
E.2molA+1molB+3molC+1molD F.3molC+1molD+1molB G.1molA+0.5molB+1.5molC+0.5molD H. 3molC+2molD I.4molC+1molD A、B、C、F、ID、GE、H152 L2 L1 L 4molA+2molB 平衡状态1 平衡状态2加压16等效平衡是指在一定条件下(恒温、恒容或恒温、恒压),对同一可逆反应,只要起始时加入物质的物质的量不同,而达到化学平衡时,同种物质的含量相同的平衡状态。17讨论并归纳: 在同温、同容下,对于上述反应来说(注意反应方程式的特点),加入物质的物质的量不同时,什么时候可以达到同一平衡状态呢? 18 在恒温恒容下,若反应前后全为气体且总体积不等,只改变起始时加入物质的物质的量,如果根据反应方程式中的计量数换算成等号同一边的物质的物质的量,只要对应物质的物质的量相等就可达到同一平衡状态。此时,混合物中各物质的质量(物质的量)百分含量与已知的平衡状态相同,物质的量、浓度、甚至总压强、总物质的量也相同。 [小结] 19 上面例3的化学方程式中,n前≠n后。若n前 = n后,什么时候才能达到同一平衡状态呢? [例4]在一个固定体积的密闭容器中,保持一定温度,进行以下反应:H2 (g) +Br2 (g) == 2HBr (g), 已知加入1mol H2和2mol Br2时,达到平衡 后生成a mol HBr(见下表“已知”项)。在同温同压下,且保持平衡时各组成成分的百分含量不变,对下列编号⑴和⑵的状态,填写表中的空白:2a00.5212 L 2 L1 L 1 L1 L已知甲乙丙(1)起始状态 平衡状态 加
压22 在恒温恒容下,若反应前后气体物质的总体积相等,只改变起始时加入物质的物质的量,如根据可逆反应方程式的计量数换算成等号同一边的物质的物质的量,对应物质的物质的量之比相等,各组分的 百分含量与已知的平衡状态相同,但各组分的物质的量及浓度不一定相同。 [小结]23课后思考题: 例3和例4都是在同温、同体积的情况下的等效平衡,如果是同温、同压的条件,上述两例又如何才能达到等效平衡呢?请大家回去思考。 资料收集:焦世军
教学设计:焦世军
课件制作:焦世军
2003---12---25谢谢大家欢迎各位领导和老师光临指导
2、化学平衡状态的特征是什么?你能用简练的语言概括出来吗?
3、如何根据化学平衡状态的特征来判断一个可逆反应是否达到了平衡呢? 3①“逆”:可逆反应。
②“等”:υ正 = υ逆 。
③“动”:υ正 = υ逆≠ 0 。
④“定”:外界条件一定,各组成成分的百分含量保持不变。
⑤“变”:外界条件改变时,若υ正 ≠υ逆 且υ正 > υ逆 平衡向正反应方向移动;若υ正 < υ逆平衡向逆反应方向移动。 4[例1] 在一定的温度下,可逆反应:A(g)+ 3B(g)=== 2C(g)达到平衡的标志是( )
A.C的生成速率与C的分解速率相等。
B.单位时间生成n molA,同时生成3n molB。
C.A、B、C的物质的量浓度保持不变。
D.A、B、C的分子数之比为1 :3 :2 。
E.容器中气体的密度保持不变。
F.混合气体的平均摩尔质量保持不变。
G.容器中气体的总压强保持不变。A、C、F5[小结]化学平衡状态的标志: (1)υ正 = υ逆 (本质特征)
① 同一种物质:该物质的生成速率等于它的消耗速率。
② 不同的物质:速率之比等于方程式中各物质的计量数之比,但必须是不同方向的速率。6(2)反应混合物中各组成成分的含 量保持不变(外部表现): ① 各组成成分的质量、物质的量、分子数、体积(气体)、物质的量浓度均保持不变。
② 各组成成分的质量分数、物质的量分数、气体的体积分数均保持不变。
③ 若反应前后的物质都是气体,且总体积不等,则气体的总物质的量、总压强(恒温、恒容)、平均摩尔质量、混合气体的密度(恒温、恒压)均保持不变。
④ 反应物的转化率、产物的产率保持不变。 7 从上述分析可知,当条件发生变化时,如果使得υ正 ≠ υ逆,平衡就有可能会发生移动。当平衡移动时,上述那些物理量又将如何变化呢? 8[例2] 体积相同的甲、乙两个容器中, 分别都充有等物质的量的SO2和O2,在相 同温度下发生反应:2SO2(g)+ O2(g)==== 2SO3(g)并达到平衡,反应过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为P%,则乙容器中SO2的转化率为( )。
A.等于P% B.大于P%
C.小于P% D.无法判断催化剂▲B9
V L P%
V L>P%
压甲乙a+b
C.4molA+2molB D.3molC+1molD
E.2molA+1molB+3molC+1molD F.3molC+1molD+1molB G.1molA+0.5molB+1.5molC+0.5molD H. 3molC+2molD I.4molC+1molD A、B、C、F、ID、GE、H152 L2 L1 L 4molA+2molB 平衡状态1 平衡状态2加压16等效平衡是指在一定条件下(恒温、恒容或恒温、恒压),对同一可逆反应,只要起始时加入物质的物质的量不同,而达到化学平衡时,同种物质的含量相同的平衡状态。17讨论并归纳: 在同温、同容下,对于上述反应来说(注意反应方程式的特点),加入物质的物质的量不同时,什么时候可以达到同一平衡状态呢? 18 在恒温恒容下,若反应前后全为气体且总体积不等,只改变起始时加入物质的物质的量,如果根据反应方程式中的计量数换算成等号同一边的物质的物质的量,只要对应物质的物质的量相等就可达到同一平衡状态。此时,混合物中各物质的质量(物质的量)百分含量与已知的平衡状态相同,物质的量、浓度、甚至总压强、总物质的量也相同。 [小结] 19 上面例3的化学方程式中,n前≠n后。若n前 = n后,什么时候才能达到同一平衡状态呢? [例4]在一个固定体积的密闭容器中,保持一定温度,进行以下反应:H2 (g) +Br2 (g) == 2HBr (g), 已知加入1mol H2和2mol Br2时,达到平衡 后生成a mol HBr(见下表“已知”项)。在同温同压下,且保持平衡时各组成成分的百分含量不变,对下列编号⑴和⑵的状态,填写表中的空白:2a00.5212 L 2 L1 L 1 L1 L已知甲乙丙(1)起始状态 平衡状态 加
压22 在恒温恒容下,若反应前后气体物质的总体积相等,只改变起始时加入物质的物质的量,如根据可逆反应方程式的计量数换算成等号同一边的物质的物质的量,对应物质的物质的量之比相等,各组分的 百分含量与已知的平衡状态相同,但各组分的物质的量及浓度不一定相同。 [小结]23课后思考题: 例3和例4都是在同温、同体积的情况下的等效平衡,如果是同温、同压的条件,上述两例又如何才能达到等效平衡呢?请大家回去思考。 资料收集:焦世军
教学设计:焦世军
课件制作:焦世军
2003---12---25谢谢大家欢迎各位领导和老师光临指导
