新人教版必修2第一章物质结构 元素周期律第一节元素周期表[下学期]
文档属性
| 名称 | 新人教版必修2第一章物质结构 元素周期律第一节元素周期表[下学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 669.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-02-27 00:00:00 | ||
图片预览










文档简介
课件53张PPT。第一章
物质结构 元素周期律
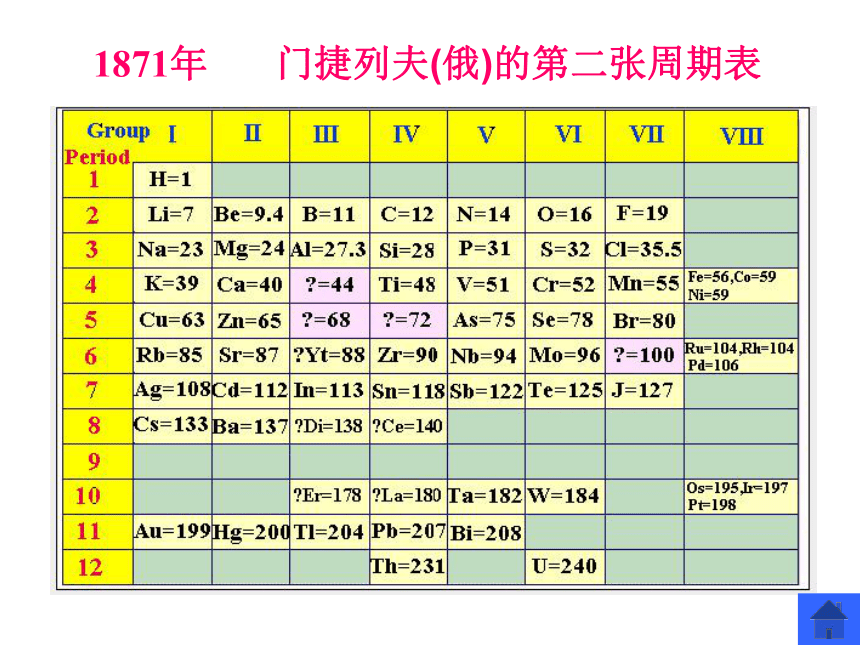
必修2第一节 元素周期表1869年2月 门捷列夫(俄)的第一张周期表?1871年 ?门捷列夫(俄)的第二张周期表?【提出问题】 请阅读P4~5,回答:
1.门捷列夫开始是按照什么原则来排列元素的?
2.现在的周期表排列的依据是什么?
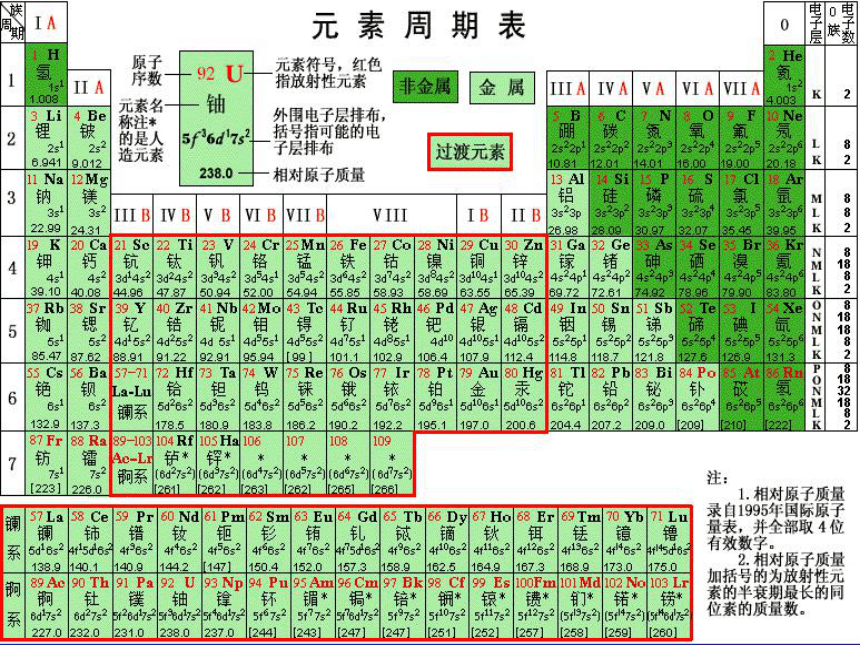
3.哪个依据更科学呢?相对原子质量核电荷数后者一、元素周期表1.元素周期表的概述原子序数=核电荷数=质子数=核外电子数 人们按核电荷数由小到大的顺序给元素编号,这种序号叫做原子序数【讨论与交流】请同学们认真研究、分析元素周期表
1.元素的排列有什么规律?
2.有多少横行?多少纵行?
3. 每横行、纵行所含的元素种类是否相同?2.元素周期表的编排原则把具有相同电子层数的元素按照原子序数递增的顺序排列成一个横行;
把最外层电子数相同的元素按照核电荷数递增的顺序排成一个纵行.3.元素周期表的结构 3个短周期 (第1、2、3周期) 3个长周期 (第4、5、6周期) 周期(7个) 族(16个) 元素周期表 主族(7个) IA~VIIA
1个不完全周期(第7周期) 副族(7个) IB~VIIB VIII族(1个) 8、9、10三个纵行 零族(1个)最右边一个纵行(惰性气体元素) 归纳:三长、三短、一不完全;
七主、七副、零与八(3)周期 同周期元素的原子结构的特点:相同,且等于周期序数;从左到右由1个递增到8个;不同,从左到右依次增多;不同,从左到右依次减小。每周期元素的种数分别是:2;8;8;18;18;32;……周期序数=电子层数(1)、定义:(2)、表示方法:它们是由短周期和长周期元素共同构成的族所构成的。在族序数数字后加A表示。族序数的表示:用罗马数字(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ)表示族序数;表示符号:主族(A)3、同主族原子结构特点:不同,从上到下依次增大。不同,且从上到下依次增多;不同,从上到下依次增大;相同,且主族序数等于
最外层电子数;主族(A)主族序数等于最外层电子数(1)、定义:(2)、表示方法:它们是由 长周期元素共同构成的族所构成的。在族序数数字后加B表示。族序数的表示:用罗马数字(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ)表示族序数;表示符号:副族(B)总结回顾原子序数
周期:
族:
族的别称:
三长三短, 一不完全七主七副, 零与八(3)碱金属,碱土金属,硼族,氮族,氧族,卤族,
稀有气体元素=核电荷数=质子数=核外电子数【知识总结】 各周期元素的种类及稀有气体的原子序数 18183232?1018365486118?练习 推算原子序数为6,13,34,53,88,82的
元素在周期表中的位置。 第6号元素: 6-2=4 第二周期第ⅣA 族。 第13号元素: 13-10=3 第三周期第ⅢA 族。 第34号元素: 34-18=16 第四周期第ⅥA 族。 第53号元素: 53-36=17 第五周期第ⅦA 族。 第88号元素: 88-86 =2 第七周期第ⅡA 族。 第82号元素: 82-54 =28 第六周期第ⅣA 族。28-14=14例题分析:例题1:
X、Y两元素处于同一主族相邻周期,则X、Y两元素的原子序数相差不可能为下列哪一数值( )
A.2 B.8 C.10 D.18例题2:
第114号元素是化学家和物理学家很感兴趣的尚未发现的元素,试推测此元素在周期表中的位置( )
A.第八周期ⅢA族 B.第六周期ⅤA族
C.第七周期ⅣB族 D.第七周期ⅣA族CD 例题3.
在下列元素中,不属于主族元素的是( )
A磷 B铁 C钙 D 碘 例题4 下列各图若为元素周期表中的一部分(表中数字为原子序数),其中X为35的是( )BAD例题5
国家无机化学命名委员会在1989年做出决定,把长式周期表原先的主、副族及族号取消,从左至右改为第1~18列。碱金属族为第一列,稀有气体为第18列。按这个规定,下列说法不正确的是 ( )
A. 第15列元素的最高价氧化物为R2O5
B. 第2列元素中肯定没有非金属元素
C. 第17列元素中肯定没有金属元素
D. 第16、17列都是非金属元素D二、元素的性质与原子结构1、碱金属元素
(1)碱金属的原子结构【自主学习】教材第5页“科学探究”,填写第5页表格碱金属的原子结构示意图 碱金属原子结构有何异同?①相同点:碱金属元素原子结构的 相同,都为 。
②递变性:从Li到Cs,随着核电荷数的 ,电子层数逐渐 ,原子半径逐渐 ,失电子能力逐渐 。最外层电子数1个思考与交流增多增多增大增强 物质的性质主要取决于原子的最外层电子数,从碱金属原子的结构可推知其化学性质如何? 是否完全相同? 析:最外层上都只有一个电子,化学反应中易失去一个电子,形成+1价的阳离子。 思考 取一小块钾,擦干表面的煤油后放在石棉网上加热,观察现象。同钠与氧气的反应比较。 探究实验一钠、钾化学性质比较黄淡黄色紫浮熔游红 在小烧杯中放入一些水,然后取绿豆大的钾,吸干表面的煤油,投入到小烧杯中,观察现象。 探究实验二钠、钾化学性质比较黄淡黄色紫浮浮熔熔游游红红 碱金属元素原子的最外层都有1个电子,它们的化学性质相似 结论更为复杂K2O、K2O2、KO2Li2O更为复杂Na2O、Na2O2碱金属与O2反应比较①与O2的反应 ΔΔ4Li + O2 = 2Li2O 2Na + O2 = Na2O2②与水的反应2Na + 2H2O = 2NaOH + H2↑2K + 2H2O = 2KOH + H2↑通式:2R +2H2O = 2ROH + H2↑(2)碱金属的化学性质相似性 Li Na K Rb Cs1.相似性:总结: 碱金属的原子结构2.递变性:(电子层数的影响大于核电荷数的影响)失电子能力还原性金属性原子半径最外层上都只有一个电子核对最外层电子的引力 碱金属元素从上到下(Li 、Na、K、Rb、Cs),随着核电荷数的增加,碱金属元素原子的电子层数逐渐 ,原子核对 的引力逐渐减弱,原子失电子的能力逐渐 。 增多最外层电子增强 元素的金属性逐渐 ,与水和氧气的反应越来越 ,生成的氧化物越来越 。最高价氧化物对应水化物的碱性越来越 。增强剧烈复杂强递变性元素金属性强弱判断依据:1、根据金属单质与水或者与酸反应置换出氢的难易程度。 2、根据金属元素最高价氧化物对应水化物碱性强弱。 3、可以根据对应阳离子的氧化性强弱判断。 置换出氢越容易,则金属性越强。
碱性越强,则原金属元素的金属性越强。
金属阳离子氧化性越弱,则元素金属性越强。 例:1、已知金属A可与冷水反应,金属B和热水才能反应,金属C和水不能反应,判断金属A、B、C金属性强弱如何?金属性 A 〉 B 〉 C2、已知NaOH为强碱、Mg(OH)2为中强碱、 Al(OH)3为两性氢氧化物,则Na、Mg、Al的金属性强弱顺序如何?金属性 Na〉Mg〉Al碱金属的物理性质有何相似性和递变性?碱金属的物理性质的比较相
似
点递变性颜色硬度密度熔沸点导电导热性密度变化熔沸点变化Li Na K Rb Cs均为银白色(Cs略带金色)柔软较小较低强逐渐增大(K特殊)单质的熔沸点逐渐降低 1.锂电池是一种高能电池。
锂有机化学中重要的催化剂。
锂制造氢弹不可缺少的材料。
锂是优质的高能燃料(已经
用于宇宙飞船、人造卫星和
超声速飞机)。 3.铷铯主要用于制备光电管、真空管。铯原子钟是目前最准确的计时仪器。
2.钾的化合物最大用途是做钾肥。硝酸钾还用于做火药。碱金属元素的用途:金 属 性 逐 渐 增 强【课堂小结】原子结构示意图 氟 氯 溴 碘 F Cl Br I 9 17 35 532.卤族元素:1.331.140.990.71原子半径
(10-10米)5432电子层数7777最外层电子数原子结构示意图卤素原子的半径比较:
卤素的结构特点 阅读教材第7页卤素的原子结构示意图,归纳卤素的结构特点: 相同点:不同点:最外层电子数均为__随着核电荷数的递增,电子层数逐渐____ 思考:试推测氟、氯、溴、碘在性质上所表现的相似性和递变性。7增多卤素单质的物理性质有颜色,密度小,熔沸点都较低。相似性递变性颜色:逐渐加深
状态:气 液 固
密度:逐渐增大
熔沸点:依次增高(1)卤素单质与氢气的反应: 卤素单质的化学性质卤素单质的化学性质(1)卤素单质与氢气反应据课本第8页表格所示回答问题:相似性卤素单质都能跟氢气发生反应,生成卤化氢。递变性A、反应条件越来越____高B、剧烈程度越来越____低C、产物的稳定性越来越
____弱卤素单质的化学性质(2)卤素单质间的置换反应回顾课本9页的实验,填表:由上述反应可比较卤素________的强弱氧化性氧化性例题分析:1. 随着卤素原子半径的增大,下列递变规律正确的是( )
A、单质的熔沸点逐渐降低
B、卤素离子的还原性逐渐增强
C、气态氢化物稳定性逐渐增强
D、单质氧化性逐渐增强B 2.下列关于铯(Cs)及其化合物的叙述不正确的是( )
A、无水硫酸铯的化学式为Cs2SO4,它易溶于水
B、硫酸铯加热分解为二氧化碳和氧化铯
C、铯的氧化物不止一种
D、氢氧化铯是一种强碱,其碱性比氢氧化钠B总结 通过比较碱金属单质与氧气、与水的反应,以及卤素单质与氢气的反应、卤素单质间的置换反应,得出结论: 元素的性质与________有密切的关系,主要与_______________________,特别是_______________有关。原子结构原子核外电子的排布最外层电子数思考 同主族元素随着电子层数的增加,即在元素周期表中,同一主族从上到下,递变规律都有哪些?得电子能力:
失电子能力:
金属性:
非金属性:核素质量数定义:质量数( )=________( )
+________( )表示什么?AZN质子数中子数元素、核素、同位素元素:具有相同________的____原子的总称。
核素:具有一定数目的____和一定数目的____的____原子。
同位素:______相同而______不同的同一元素的____原子,互称同位素。质子数一类质子中子一种质子数中子数不同概念(2) 同位素的性质:同位素的各核素的质子数相同,在元素周期表中占相同的位置天然同位素相互间保持一定的比率(3)同位素的应用:同位素在日常生活、工农业生产和科学研究中有着重要的用途,如考古时利用 测定一些文物的年代,用于制造氢弹,利用育种,治疗癌症和肿瘤思考 同位素的各核素的质子数相同,则核外电子数相同,他们的化学性质如何?放射性元素例题分析:1.下列说法中错误的是( )
A 质量数相同的原子,其化学性质一定相同
B 质子数相同的粒子,其核外电子排布也相同
C 金属越活泼,其原子在反应中越易失去电子
D 非金属越活泼,其阴离子越难失去电子2.下列说法正确的是( )
A 原子核都是由质子和中子构成的
B 不同元素原子的质量数一定不等
C 质子数决定元素的种类,质子数和中子数决定原子的种类
D 质子数相同的粒子,核外电子数一定相同,但化学性质不一定相同。 ABC3.已知元素X、Y的核电荷数分别是a和 b,他们的离子Xm+和Yn-的核外电子排布相同,则下列关系式中正确的是( )
A a=b+m+n B a=b-m+n
C a=b+m-n D a=b-m-n A
1.门捷列夫开始是按照什么原则来排列元素的?
2.现在的周期表排列的依据是什么?
3.哪个依据更科学呢?相对原子质量核电荷数后者一、元素周期表1.元素周期表的概述原子序数=核电荷数=质子数=核外电子数 人们按核电荷数由小到大的顺序给元素编号,这种序号叫做原子序数【讨论与交流】请同学们认真研究、分析元素周期表
1.元素的排列有什么规律?
2.有多少横行?多少纵行?
3. 每横行、纵行所含的元素种类是否相同?2.元素周期表的编排原则把具有相同电子层数的元素按照原子序数递增的顺序排列成一个横行;
把最外层电子数相同的元素按照核电荷数递增的顺序排成一个纵行.3.元素周期表的结构 3个短周期 (第1、2、3周期) 3个长周期 (第4、5、6周期) 周期(7个) 族(16个) 元素周期表 主族(7个) IA~VIIA
1个不完全周期(第7周期) 副族(7个) IB~VIIB VIII族(1个) 8、9、10三个纵行 零族(1个)最右边一个纵行(惰性气体元素) 归纳:三长、三短、一不完全;
七主、七副、零与八(3)周期 同周期元素的原子结构的特点:相同,且等于周期序数;从左到右由1个递增到8个;不同,从左到右依次增多;不同,从左到右依次减小。每周期元素的种数分别是:2;8;8;18;18;32;……周期序数=电子层数(1)、定义:(2)、表示方法:它们是由短周期和长周期元素共同构成的族所构成的。在族序数数字后加A表示。族序数的表示:用罗马数字(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ)表示族序数;表示符号:主族(A)3、同主族原子结构特点:不同,从上到下依次增大。不同,且从上到下依次增多;不同,从上到下依次增大;相同,且主族序数等于
最外层电子数;主族(A)主族序数等于最外层电子数(1)、定义:(2)、表示方法:它们是由 长周期元素共同构成的族所构成的。在族序数数字后加B表示。族序数的表示:用罗马数字(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ)表示族序数;表示符号:副族(B)总结回顾原子序数
周期:
族:
族的别称:
三长三短, 一不完全七主七副, 零与八(3)碱金属,碱土金属,硼族,氮族,氧族,卤族,
稀有气体元素=核电荷数=质子数=核外电子数【知识总结】 各周期元素的种类及稀有气体的原子序数 18183232?1018365486118?练习 推算原子序数为6,13,34,53,88,82的
元素在周期表中的位置。 第6号元素: 6-2=4 第二周期第ⅣA 族。 第13号元素: 13-10=3 第三周期第ⅢA 族。 第34号元素: 34-18=16 第四周期第ⅥA 族。 第53号元素: 53-36=17 第五周期第ⅦA 族。 第88号元素: 88-86 =2 第七周期第ⅡA 族。 第82号元素: 82-54 =28 第六周期第ⅣA 族。28-14=14例题分析:例题1:
X、Y两元素处于同一主族相邻周期,则X、Y两元素的原子序数相差不可能为下列哪一数值( )
A.2 B.8 C.10 D.18例题2:
第114号元素是化学家和物理学家很感兴趣的尚未发现的元素,试推测此元素在周期表中的位置( )
A.第八周期ⅢA族 B.第六周期ⅤA族
C.第七周期ⅣB族 D.第七周期ⅣA族CD 例题3.
在下列元素中,不属于主族元素的是( )
A磷 B铁 C钙 D 碘 例题4 下列各图若为元素周期表中的一部分(表中数字为原子序数),其中X为35的是( )BAD例题5
国家无机化学命名委员会在1989年做出决定,把长式周期表原先的主、副族及族号取消,从左至右改为第1~18列。碱金属族为第一列,稀有气体为第18列。按这个规定,下列说法不正确的是 ( )
A. 第15列元素的最高价氧化物为R2O5
B. 第2列元素中肯定没有非金属元素
C. 第17列元素中肯定没有金属元素
D. 第16、17列都是非金属元素D二、元素的性质与原子结构1、碱金属元素
(1)碱金属的原子结构【自主学习】教材第5页“科学探究”,填写第5页表格碱金属的原子结构示意图 碱金属原子结构有何异同?①相同点:碱金属元素原子结构的 相同,都为 。
②递变性:从Li到Cs,随着核电荷数的 ,电子层数逐渐 ,原子半径逐渐 ,失电子能力逐渐 。最外层电子数1个思考与交流增多增多增大增强 物质的性质主要取决于原子的最外层电子数,从碱金属原子的结构可推知其化学性质如何? 是否完全相同? 析:最外层上都只有一个电子,化学反应中易失去一个电子,形成+1价的阳离子。 思考 取一小块钾,擦干表面的煤油后放在石棉网上加热,观察现象。同钠与氧气的反应比较。 探究实验一钠、钾化学性质比较黄淡黄色紫浮熔游红 在小烧杯中放入一些水,然后取绿豆大的钾,吸干表面的煤油,投入到小烧杯中,观察现象。 探究实验二钠、钾化学性质比较黄淡黄色紫浮浮熔熔游游红红 碱金属元素原子的最外层都有1个电子,它们的化学性质相似 结论更为复杂K2O、K2O2、KO2Li2O更为复杂Na2O、Na2O2碱金属与O2反应比较①与O2的反应 ΔΔ4Li + O2 = 2Li2O 2Na + O2 = Na2O2②与水的反应2Na + 2H2O = 2NaOH + H2↑2K + 2H2O = 2KOH + H2↑通式:2R +2H2O = 2ROH + H2↑(2)碱金属的化学性质相似性 Li Na K Rb Cs1.相似性:总结: 碱金属的原子结构2.递变性:(电子层数的影响大于核电荷数的影响)失电子能力还原性金属性原子半径最外层上都只有一个电子核对最外层电子的引力 碱金属元素从上到下(Li 、Na、K、Rb、Cs),随着核电荷数的增加,碱金属元素原子的电子层数逐渐 ,原子核对 的引力逐渐减弱,原子失电子的能力逐渐 。 增多最外层电子增强 元素的金属性逐渐 ,与水和氧气的反应越来越 ,生成的氧化物越来越 。最高价氧化物对应水化物的碱性越来越 。增强剧烈复杂强递变性元素金属性强弱判断依据:1、根据金属单质与水或者与酸反应置换出氢的难易程度。 2、根据金属元素最高价氧化物对应水化物碱性强弱。 3、可以根据对应阳离子的氧化性强弱判断。 置换出氢越容易,则金属性越强。
碱性越强,则原金属元素的金属性越强。
金属阳离子氧化性越弱,则元素金属性越强。 例:1、已知金属A可与冷水反应,金属B和热水才能反应,金属C和水不能反应,判断金属A、B、C金属性强弱如何?金属性 A 〉 B 〉 C2、已知NaOH为强碱、Mg(OH)2为中强碱、 Al(OH)3为两性氢氧化物,则Na、Mg、Al的金属性强弱顺序如何?金属性 Na〉Mg〉Al碱金属的物理性质有何相似性和递变性?碱金属的物理性质的比较相
似
点递变性颜色硬度密度熔沸点导电导热性密度变化熔沸点变化Li Na K Rb Cs均为银白色(Cs略带金色)柔软较小较低强逐渐增大(K特殊)单质的熔沸点逐渐降低 1.锂电池是一种高能电池。
锂有机化学中重要的催化剂。
锂制造氢弹不可缺少的材料。
锂是优质的高能燃料(已经
用于宇宙飞船、人造卫星和
超声速飞机)。 3.铷铯主要用于制备光电管、真空管。铯原子钟是目前最准确的计时仪器。
2.钾的化合物最大用途是做钾肥。硝酸钾还用于做火药。碱金属元素的用途:金 属 性 逐 渐 增 强【课堂小结】原子结构示意图 氟 氯 溴 碘 F Cl Br I 9 17 35 532.卤族元素:1.331.140.990.71原子半径
(10-10米)5432电子层数7777最外层电子数原子结构示意图卤素原子的半径比较:
卤素的结构特点 阅读教材第7页卤素的原子结构示意图,归纳卤素的结构特点: 相同点:不同点:最外层电子数均为__随着核电荷数的递增,电子层数逐渐____ 思考:试推测氟、氯、溴、碘在性质上所表现的相似性和递变性。7增多卤素单质的物理性质有颜色,密度小,熔沸点都较低。相似性递变性颜色:逐渐加深
状态:气 液 固
密度:逐渐增大
熔沸点:依次增高(1)卤素单质与氢气的反应: 卤素单质的化学性质卤素单质的化学性质(1)卤素单质与氢气反应据课本第8页表格所示回答问题:相似性卤素单质都能跟氢气发生反应,生成卤化氢。递变性A、反应条件越来越____高B、剧烈程度越来越____低C、产物的稳定性越来越
____弱卤素单质的化学性质(2)卤素单质间的置换反应回顾课本9页的实验,填表:由上述反应可比较卤素________的强弱氧化性氧化性例题分析:1. 随着卤素原子半径的增大,下列递变规律正确的是( )
A、单质的熔沸点逐渐降低
B、卤素离子的还原性逐渐增强
C、气态氢化物稳定性逐渐增强
D、单质氧化性逐渐增强B 2.下列关于铯(Cs)及其化合物的叙述不正确的是( )
A、无水硫酸铯的化学式为Cs2SO4,它易溶于水
B、硫酸铯加热分解为二氧化碳和氧化铯
C、铯的氧化物不止一种
D、氢氧化铯是一种强碱,其碱性比氢氧化钠B总结 通过比较碱金属单质与氧气、与水的反应,以及卤素单质与氢气的反应、卤素单质间的置换反应,得出结论: 元素的性质与________有密切的关系,主要与_______________________,特别是_______________有关。原子结构原子核外电子的排布最外层电子数思考 同主族元素随着电子层数的增加,即在元素周期表中,同一主族从上到下,递变规律都有哪些?得电子能力:
失电子能力:
金属性:
非金属性:核素质量数定义:质量数( )=________( )
+________( )表示什么?AZN质子数中子数元素、核素、同位素元素:具有相同________的____原子的总称。
核素:具有一定数目的____和一定数目的____的____原子。
同位素:______相同而______不同的同一元素的____原子,互称同位素。质子数一类质子中子一种质子数中子数不同概念(2) 同位素的性质:同位素的各核素的质子数相同,在元素周期表中占相同的位置天然同位素相互间保持一定的比率(3)同位素的应用:同位素在日常生活、工农业生产和科学研究中有着重要的用途,如考古时利用 测定一些文物的年代,用于制造氢弹,利用育种,治疗癌症和肿瘤思考 同位素的各核素的质子数相同,则核外电子数相同,他们的化学性质如何?放射性元素例题分析:1.下列说法中错误的是( )
A 质量数相同的原子,其化学性质一定相同
B 质子数相同的粒子,其核外电子排布也相同
C 金属越活泼,其原子在反应中越易失去电子
D 非金属越活泼,其阴离子越难失去电子2.下列说法正确的是( )
A 原子核都是由质子和中子构成的
B 不同元素原子的质量数一定不等
C 质子数决定元素的种类,质子数和中子数决定原子的种类
D 质子数相同的粒子,核外电子数一定相同,但化学性质不一定相同。 ABC3.已知元素X、Y的核电荷数分别是a和 b,他们的离子Xm+和Yn-的核外电子排布相同,则下列关系式中正确的是( )
A a=b+m+n B a=b-m+n
C a=b+m-n D a=b-m-n A
