物质结构及元素周期律复习[下学期]
文档属性
| 名称 | 物质结构及元素周期律复习[下学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 228.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-05-21 00:00:00 | ||
图片预览










文档简介
课件39张PPT。基 础 知 识 导 学 回目录页 天才来自于勤奋原 子 结 构1、三种关系质子数(Z)=核外电子数=核电荷数=原子序数质量数(A)=质子数(Z) +中子数(N) -表示核电荷数这Z,质量数为A的一个 原子对于阴离子:Z=核外电子数-电荷数
对于阳离子:Z=核外电子数+电荷数结构相同的微粒,从电子总数相等找对应关系下一页基 础 知 识 导 学 回目录页 天才来自于勤奋原 子 结 构2、原子结构原子原子核核外电子电子层-决定所在周期中子-决定元素的同位素决定质量数
(近似原子量)决定元素的性质质子-决定元素种类最外层电子-决定主族序数下一页基 础 知 识 导 学回目录页 天才来自于勤奋原 子 结 构3、元素和同位素(1)元素具有相同核电荷数的一类原子的总称(2)同位素质子数相同,中子数不同的同一种
元素的不同种原子互称同位素(1)各电子层最多容纳2n2个电子;4、核外电子排布规律(2)最外电子数不超过8个电子(K层为不超过2个);(3)次外(倒数第三)层电子数不超过18(32)个电子;下一页基 础 知 识 导 学 回目录页 天才来自于勤奋元 素 周 期 律 1、元素周期律(1)同周期元素随原子序数递增,核外电子排列 呈周期性变化;(2)同周期元素随原子序数递增,原子半径减小;因:同周期元素电子层数相同,原子半径决定于核电荷数,核电荷数(原子序数)越大,核对电子吸引力越强,则原子半径越小。(3)同周期元素随原子序数递增,主要化合价呈周期性变化;最高正价:+1~+7 最低负价:由-4~-1下一页基 础 知 识 导 学 回目录页 天才来自于勤奋元 素 周 期 律 2、元素性质的递变规律由左至右:金属性减弱,非金属性增强;最高价氧化物对应水化物酸性增强,碱性减弱;气态氢化物稳定性增强。由上至下:
最高价氧化物的水化物酸性减弱、碱性增强;气态氢化物稳定性减弱还原性增强;金属性增强非金属性减弱。下一页基 础 知 识 导 学 回目录页 天才来自于勤奋元 素 周 期 律 3、元素周期表的结构 (1)周期:由电子层数决定:7个横行为7个周期各周期稀有气体电子排布:1 2种元素 He 2
2 8 种元素 Ne 2 8
3 8种元素 Ar 2 8 8
4 18种元素 Kr 2 8 18 8
18种元素 Xe 2 8 18 18 8
6 32种元素 Rn 2 8 18 32 18 8
7 23种元素下一页短周期长周期不完全周期基 础 知 识 导 学 回目录页 天才来自于勤奋元 素 周 期 律 3、元素周期表的结构 (2)族:18个纵行,共16族:7个主族,7个副族
1个0族,1 个第Ⅷ族下一页主族:既包含长周期元素又包含短周期元素。1~2纵行 13 ~17纵行:依次为ⅠA ⅡA ⅢA
ⅣA ⅤA ⅥA ⅦA
18纵行:0族 稀有气体8、9、10三纵行为:第Ⅷ族基 础 知 识 导 学 回目录页 天才来自于勤奋元 素 周 期 律 11 ~12纵行为:ⅠB ⅡB下一页由原子序数推断元素在周期表中的位置:
就给定原子序数与就近的稀有气体元素的原
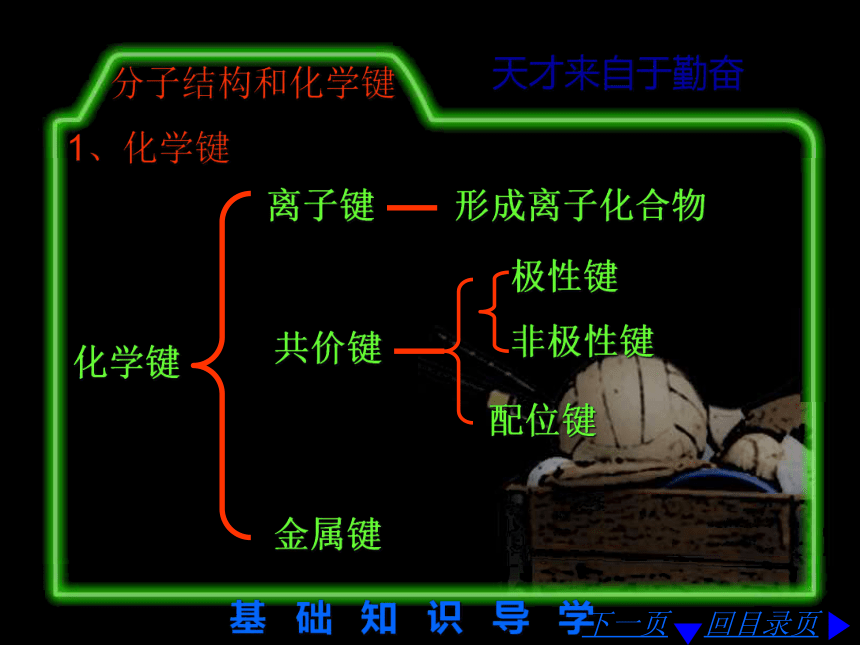
子序数的差值推出元素所在纵行即可3 ~7纵行为:ⅢB ⅣB ⅤB ⅥB ⅦB基 础 知 识 导 学 回目录页 天才来自于勤奋元 素 周 期 律 4、“位、构、性”的关系 下一页结构位置性质周期 族判断元素推出位置通过位置运用递变规律(1)核电荷数、原子序数(2)核外电子电子层最外层电子物理性质元素性质单质性质化合物的性质离子性质转下页基 础 知 识 导 学 回目录页 天才来自于勤奋元 素 周 期 律 金属性下一页接上页非金属性酸性碱性氧化性还原性稳定性可燃性……基 础 知 识 导 学 回目录页 天才来自于勤奋分子结构和化学键1、化学键化学键下一页离子键 形成离子化合物共价键 极性键 非极性键 配位键 金属键 基 础 知 识 导 学 回目录页 天才来自于勤奋分子结构和化学键 且下一页离子化合物一定含离子键共价化合物一定不含离子键 离子化合物可能含共价键 离子化合物可能含配位键 离子化合物可能含极性共价键 离子化合物可能含非极性共价键 基 础 知 识 导 学 回目录页 天才来自于勤奋分子结构和化学键2、用电子式表示离子键、共价键的形成过程下一页+2H×+HH××基 础 知 识 导 学 回目录页 天才来自于勤奋分子结构和化学键3、一些重要物质的分子式下一页H︰HH︰N︰H
H‥H︰O︰
H‥‥H︰C︰H
H‥‥H〔 H︰N︰H 〕+〔︰Cl︰〕—
H‥‥H‥‥〔 H︰O︰H 〕+
H‥‥〔 H︰N︰H 〕+
HH‥‥H︰O︰Cl︰‥‥‥‥基 础 知 识 导 学 回目录页 天才来自于勤奋分子结构和化学键4、共价键的键参数下一页键长:成键原子核与核间的距离。键越长,
共价键越弱。键能:拆开1mol共价键所消耗的能量。键能
越大,键越牢固。键长:多原子分子中键与键之间的夹角。
基 础 知 识 导 学 回目录页 天才来自于勤奋分子结构和化学键5、分子间作用力下一页即范德华力,比化学键弱得多。分子间作用力越大,分子晶体熔沸点越高。分子结构相似的物质,相对分子质量越大,
分子间作用力越大。即F2理
性
质金属键共价键范德华力
离子键
作用金属阳离子电子 原子 分子阴阳离子微粒Na、FeSiO2、CCO2、HeNaCl、CsCl例定义 金属晶体原子晶体分子晶体 离子晶体回目录页 天才来自于勤奋同 位 素(1)元素:相同核电荷数的一类原子的总称。
同位素:核电荷数相同,中子数不同的原子,
互为同位素。下一页重 点 难 点 突 破 (2)同一种元素可能有若干种同位素,即有若干
种不同的原子,但不同的原子不一定属同种元
素。至今发现了109种元素,但不是只发现了
109种原子。回目录页 天才来自于勤奋同 位 素(3)同位素实际指的是同一元素的不同原子,不同
点在于中子数不同,但核电荷数相同,核外电子
排布相同,其原子、单质、元素及其化合物的化
学性质几乎完全相同,只是某些物理性质略有差
异。下一页重 点 难 点 突 破 (4)天然同位素在地壳中的分布,不论单质、化合
物等几乎完全一致,即元素各同位素的原子个数比这定值(丰度一定)。回目录页 天才来自于勤奋同 位 素(5)重要的同位素。下一页重 点 难 点 突 破 ①氕(H)氘(D)氚(T);关于D2、D2O……
小计算。②126C——相对原子质量标准;
23592U——原子弹材料。回目录页 天才来自于勤奋原子量(相对原子质量)1.国际定义下一页重 点 难 点 突 破 以1个碳—12原子的质量的1/12为标准,其它原
子的质量与它比较所得的数值即是该原子的相
对原子质量。
该值为“某原子的相对原子质量”,即“同位素
的相对原子质量”。回目录页 天才来自于勤奋原子量(相对原子质量)下一页重 点 难 点 突 破 是按元素各种天然同位素原子所占的原子个
数百分比算出来的平均值。2.元素的相对原子质量Ar(x)=Ar(x1) ·a%+Ar(x2) ·b%+……回目录页 天才来自于勤奋原子量(相对原子质量)下一页重 点 难 点 突 破 用元素同位素的质量数代替同位素原子量与
其丰度的乘积之和求得的近似值。3.近似原子量①同位素原子量不是元素的原子量。②某些时候,同位素原子量可代替元素原子
量进行必要的计算。③必要时,元素的原子量可用质量数代替。回目录页 天才来自于勤奋金属性非金属性强弱金属性
强弱下一页重 点 难 点 突 破 ①与水反应置换氢的难易②与酸反应置换氢的难易③最高价氧化物的水化物的碱性强弱另外,①相互置换能力②与非金属化合难易③单质制备难易回目录页 天才来自于勤奋金属性非金属性强弱非金属
性强弱下一页重 点 难 点 突 破 ①与H2化合难易②气态氢化物的稳定性③最高价含氧酸的酸性强弱另外,①与金属化合难易②气态氢化物的还原性③相互置换情况回目录页 天才来自于勤奋金属性非金属性强弱下一页重 点 难 点 突 破 金属性、非金属性是元素的性质;注意:金属性活泼性、非金属活泼性是单质的性质;如N2与白磷:N的非金属性比P强;但N2不如
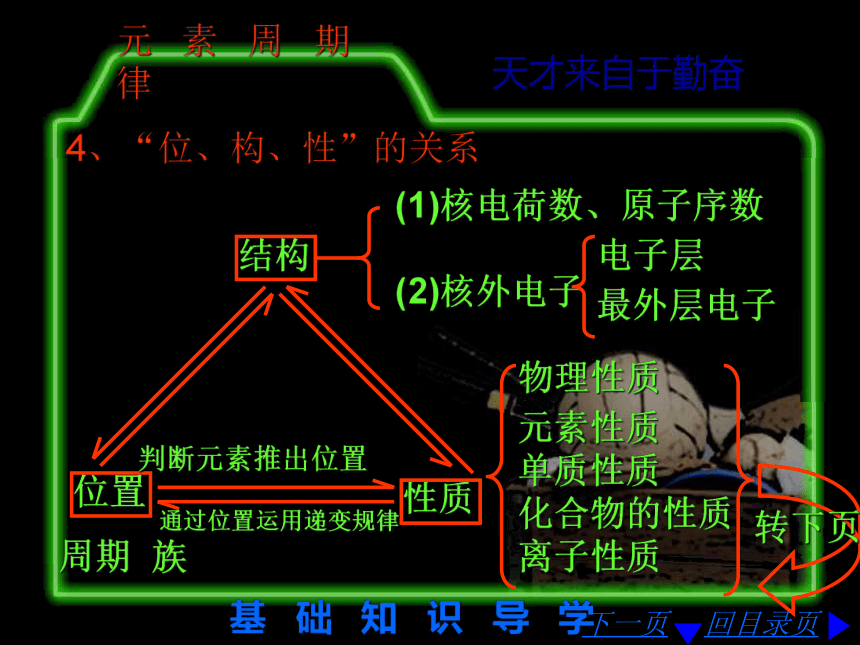
白磷活泼。回目录页 天才来自于勤奋推断序数的常见题型下一页重 点 难 点 突 破 NaCl、HCl、MgO、CO、NO、NaH……AB型:A2B型:Na2S、H2O、N2O……AB2型:CaCl2、CO2、NO2、OF2(CaC2、FeS2)……H2O2、Na2O2、C2H2……A2B2型:A2B3型:Al2O3、Al2S3、N2O3……A3B2型:Mg3N2……AB3型:AlCl3、NH3、PCl3、BF3……重 点 难 点 突 破 回目录页 天才来自于勤奋微粒半径的比较原子半径:下一页同周期由左至右逐渐变小;同主族由上而下逐渐增大。离子半径:⑴金属阳离子半径小于其原子半径;⑵非金属阴离子半径大于其原子半径;⑶高价离子半径小于其低价离子半径;⑷电子层结构相同的微粒核电荷越多半径越小;(N3—)>(O2 — )>F — >Na+>Mg2 + >Al3+S2—>Cl — >K+>Ca2 + 重 点 难 点 突 破 回目录页 天才来自于勤奋化 合 物 的 判 别下一页⑴只要有阴阳离子,即可判断为离子化合物;⑵非金属元素间形成的化合物为共价化合物。强碱:NaOH等;大多数盐:NaCl、BaSO4等;注意:NH4+的盐除外。氧化物:Na2O等;类盐:Mg3N2、NaH、Na2O2等;回目录页 天才来自于勤奋知 识 关 联“位、构、性”的推断应记忆1~18号元素的结构
性质特点:下一页1H:原子半径最小;外层电子数=周期数;电子 总数=电子层数;第IA族中能形成共价化合物的元素;在化合物中其数目改变质量分数变化不大;原子序数最小;没有中子;成酸、碱的必须元素;单质密度最小;单质可由金属与水或酸反应得到;单质是电解水产物之一;与O可生成两种液体H2O、H2O2。知 识 关 联 知 识 关 联 回目录页 天才来自于勤奋知 识 关 联下一页2He:最外层属饱和结构,但不是8个电子;电子总数是电子层数的两倍。3Li:最外层电子数是次外层的一半;碱金属中不能形成过氧化物;有机催化剂;热核反应原料之一;密度最小最轻的金属;保存于石蜡中。4Be:最外层电子数=次外层电子数;最外层电子数=电子层数;氧化物为BeO;价态为+2价。5B:最外层电子数比次外层多一个;BF3属非极性分子;氢化物B2H6;硼酸(H3BO3)为一元酸;硼砂(Na2B4O7·10H2O)是硼酸盐玻璃材料。知 识 关 联回目录页 天才来自于勤奋知 识 关 联下一页6C:最外层电子数是次外层的二倍;是形成化合物最多的元素;有金刚石、石墨与同素异形体(C60);氧化物CO、CO2;简单氢化物CH4;正四面体结构键角109°28′;最高价含氧酸H2CO3;氧炔焰;C2H2(乙炔);CaC2俗名电石;尿素CO(NH2)2含氮46%;除稀有气体外,既难得电子,又难失电子,难以形成离子;CH4中C占3/4(75%),H占1/4(25%);CaCO3式量为100;CO2通入石灰水生成沉淀再消失;CO2灭火;CO2充汽水。知 识 关 联 回目录页 天才来自于勤奋知 识 关 联下一页7N:最外层电子比次外层多3个;单质空气中含量最多,除稀有气体外难以与其他物质反应;化肥三元素之一;氢化物NH3;氧化物形式最多(六种);含氧酸有HNO3、HNO2;气态氢化物水溶液唯一呈碱性;常见离子化合物NH4Cl中含配位健;NH4+属正四面体结构;NH3喷泉;液氨冷冻剂。8O:最外层电子是次外层的三倍;地壳含量最多;占空气体积21%;与金属生成金属氧化物;有H2O2 H2O,Na2O,Na2O2等特殊化合物形式;O2能助燃。知 识 关 联 回目录页 天才来自于勤奋知 识 关 联下一页9F:最外层电子数比次外层多5个,除H外前18号元素原子半径最小;无正价;不能被任何物质氧化;能与水反应置换出水为的氧;CaF2难溶,AgF能溶于水;没有含氧酸;HF为弱酸。10Ne:略。11Na:最外层电子数是次外层的1/8,最内层的1/2;前18号元素原子半径最大;碱为NaOH;有Na2O、Na2O2等; Na2O2漂白及与H2O、CO2反应放O2;与K的合金是原子能反应堆的导热剂。知 识 关 联 回目录页 天才来自于勤奋知 识 关 联下一页12Mg:最外层电子数=最内层电子数,次外层电子数是最外层电子的4倍,Mg(OH)2难溶性中强碱;Mg遇冷水难反应,遇热水能放H2;MgCl2苦卤。13Al:最外层比次外层少5个电子;最外层电子数=电子层数;Al是两性金属;Al2O3是两性氧化物;Al(OH)3是两性氢氧化物;地壳中含量最多的金属;KAl(SO4)2·12H2O明矾净水;Al2(SO4)3与NaHCO3灭火。知 识 关 联回目录页 天才来自于勤奋知 识 关 联下一页14Si:最外层电子数是次外层的一半,最内层的两倍;地壳中含量排第二位;SiO2唯一原子晶体氧化物(中学);气态氢化物SiH4;含氧酸H4SiO4、H2SiO3(比碳酸弱);SiO2是硅酸盐水泥、玻璃的主要成分。15P:最外层比次外层少3个电子;PH3鬼火燃烧;P4白磷分子晶体键角60°;含氧酸有二:H3PO4、HPO3等,磷酸盐有三种形式;磷酸通常为固体;式量为98。知 识 关 联 回目录页 天才来自于勤奋知 识 关 联下一页16S:最外层电子比次外层少2个电子;1~18号中离子半径最大;最外层与最内层电子数之和=次外层电子数;氢化物H2S有臭鸡蛋气味;硫铁矿(黄)FeS2中S呈—1价;SO2、SO3中S各占50%和40%;H2SO4与NaCl制HCl;NaHSO4与NaCl反应,常见钠盐:Na2S、NaHS、Na2SO3、NaHSO3、Na2SO4、NaHSO4;对应酸: H2SO4 、H2SO3,还有H2S2O3特殊形式;硫黄通常为黄色晶体或粉末,易溶于CS2;S用于除去液态金属Hg。
知 识 关 联 回目录页 天才来自于勤奋知 识 关 联下一页17Cl:最外层比次外层少1个电子,比最内层多5个电子;单质黄绿色;含氧酸形式有HClO、HClO2、HClO3、HClO4;HClO4是最强酸,有漂白、杀菌、消毒作用;电解食盐水制Cl2。18Ar:略。重点是:H、C、N、O、F、Na、Mg、Al、Si、P、S、Cl此外还应记主族的一些常见元素如:Br、I及其化合物的特性,还有过渡元素Ag、Fe、Cu等的性质。
对于阳离子:Z=核外电子数+电荷数结构相同的微粒,从电子总数相等找对应关系下一页基 础 知 识 导 学 回目录页 天才来自于勤奋原 子 结 构2、原子结构原子原子核核外电子电子层-决定所在周期中子-决定元素的同位素决定质量数
(近似原子量)决定元素的性质质子-决定元素种类最外层电子-决定主族序数下一页基 础 知 识 导 学回目录页 天才来自于勤奋原 子 结 构3、元素和同位素(1)元素具有相同核电荷数的一类原子的总称(2)同位素质子数相同,中子数不同的同一种
元素的不同种原子互称同位素(1)各电子层最多容纳2n2个电子;4、核外电子排布规律(2)最外电子数不超过8个电子(K层为不超过2个);(3)次外(倒数第三)层电子数不超过18(32)个电子;下一页基 础 知 识 导 学 回目录页 天才来自于勤奋元 素 周 期 律 1、元素周期律(1)同周期元素随原子序数递增,核外电子排列 呈周期性变化;(2)同周期元素随原子序数递增,原子半径减小;因:同周期元素电子层数相同,原子半径决定于核电荷数,核电荷数(原子序数)越大,核对电子吸引力越强,则原子半径越小。(3)同周期元素随原子序数递增,主要化合价呈周期性变化;最高正价:+1~+7 最低负价:由-4~-1下一页基 础 知 识 导 学 回目录页 天才来自于勤奋元 素 周 期 律 2、元素性质的递变规律由左至右:金属性减弱,非金属性增强;最高价氧化物对应水化物酸性增强,碱性减弱;气态氢化物稳定性增强。由上至下:
最高价氧化物的水化物酸性减弱、碱性增强;气态氢化物稳定性减弱还原性增强;金属性增强非金属性减弱。下一页基 础 知 识 导 学 回目录页 天才来自于勤奋元 素 周 期 律 3、元素周期表的结构 (1)周期:由电子层数决定:7个横行为7个周期各周期稀有气体电子排布:1 2种元素 He 2
2 8 种元素 Ne 2 8
3 8种元素 Ar 2 8 8
4 18种元素 Kr 2 8 18 8
18种元素 Xe 2 8 18 18 8
6 32种元素 Rn 2 8 18 32 18 8
7 23种元素下一页短周期长周期不完全周期基 础 知 识 导 学 回目录页 天才来自于勤奋元 素 周 期 律 3、元素周期表的结构 (2)族:18个纵行,共16族:7个主族,7个副族
1个0族,1 个第Ⅷ族下一页主族:既包含长周期元素又包含短周期元素。1~2纵行 13 ~17纵行:依次为ⅠA ⅡA ⅢA
ⅣA ⅤA ⅥA ⅦA
18纵行:0族 稀有气体8、9、10三纵行为:第Ⅷ族基 础 知 识 导 学 回目录页 天才来自于勤奋元 素 周 期 律 11 ~12纵行为:ⅠB ⅡB下一页由原子序数推断元素在周期表中的位置:
就给定原子序数与就近的稀有气体元素的原
子序数的差值推出元素所在纵行即可3 ~7纵行为:ⅢB ⅣB ⅤB ⅥB ⅦB基 础 知 识 导 学 回目录页 天才来自于勤奋元 素 周 期 律 4、“位、构、性”的关系 下一页结构位置性质周期 族判断元素推出位置通过位置运用递变规律(1)核电荷数、原子序数(2)核外电子电子层最外层电子物理性质元素性质单质性质化合物的性质离子性质转下页基 础 知 识 导 学 回目录页 天才来自于勤奋元 素 周 期 律 金属性下一页接上页非金属性酸性碱性氧化性还原性稳定性可燃性……基 础 知 识 导 学 回目录页 天才来自于勤奋分子结构和化学键1、化学键化学键下一页离子键 形成离子化合物共价键 极性键 非极性键 配位键 金属键 基 础 知 识 导 学 回目录页 天才来自于勤奋分子结构和化学键 且下一页离子化合物一定含离子键共价化合物一定不含离子键 离子化合物可能含共价键 离子化合物可能含配位键 离子化合物可能含极性共价键 离子化合物可能含非极性共价键 基 础 知 识 导 学 回目录页 天才来自于勤奋分子结构和化学键2、用电子式表示离子键、共价键的形成过程下一页+2H×+HH××基 础 知 识 导 学 回目录页 天才来自于勤奋分子结构和化学键3、一些重要物质的分子式下一页H︰HH︰N︰H
H‥H︰O︰
H‥‥H︰C︰H
H‥‥H〔 H︰N︰H 〕+〔︰Cl︰〕—
H‥‥H‥‥〔 H︰O︰H 〕+
H‥‥〔 H︰N︰H 〕+
HH‥‥H︰O︰Cl︰‥‥‥‥基 础 知 识 导 学 回目录页 天才来自于勤奋分子结构和化学键4、共价键的键参数下一页键长:成键原子核与核间的距离。键越长,
共价键越弱。键能:拆开1mol共价键所消耗的能量。键能
越大,键越牢固。键长:多原子分子中键与键之间的夹角。
基 础 知 识 导 学 回目录页 天才来自于勤奋分子结构和化学键5、分子间作用力下一页即范德华力,比化学键弱得多。分子间作用力越大,分子晶体熔沸点越高。分子结构相似的物质,相对分子质量越大,
分子间作用力越大。即F2
性
质金属键共价键范德华力
离子键
作用金属阳离子电子 原子 分子阴阳离子微粒Na、FeSiO2、CCO2、HeNaCl、CsCl例定义 金属晶体原子晶体分子晶体 离子晶体回目录页 天才来自于勤奋同 位 素(1)元素:相同核电荷数的一类原子的总称。
同位素:核电荷数相同,中子数不同的原子,
互为同位素。下一页重 点 难 点 突 破 (2)同一种元素可能有若干种同位素,即有若干
种不同的原子,但不同的原子不一定属同种元
素。至今发现了109种元素,但不是只发现了
109种原子。回目录页 天才来自于勤奋同 位 素(3)同位素实际指的是同一元素的不同原子,不同
点在于中子数不同,但核电荷数相同,核外电子
排布相同,其原子、单质、元素及其化合物的化
学性质几乎完全相同,只是某些物理性质略有差
异。下一页重 点 难 点 突 破 (4)天然同位素在地壳中的分布,不论单质、化合
物等几乎完全一致,即元素各同位素的原子个数比这定值(丰度一定)。回目录页 天才来自于勤奋同 位 素(5)重要的同位素。下一页重 点 难 点 突 破 ①氕(H)氘(D)氚(T);关于D2、D2O……
小计算。②126C——相对原子质量标准;
23592U——原子弹材料。回目录页 天才来自于勤奋原子量(相对原子质量)1.国际定义下一页重 点 难 点 突 破 以1个碳—12原子的质量的1/12为标准,其它原
子的质量与它比较所得的数值即是该原子的相
对原子质量。
该值为“某原子的相对原子质量”,即“同位素
的相对原子质量”。回目录页 天才来自于勤奋原子量(相对原子质量)下一页重 点 难 点 突 破 是按元素各种天然同位素原子所占的原子个
数百分比算出来的平均值。2.元素的相对原子质量Ar(x)=Ar(x1) ·a%+Ar(x2) ·b%+……回目录页 天才来自于勤奋原子量(相对原子质量)下一页重 点 难 点 突 破 用元素同位素的质量数代替同位素原子量与
其丰度的乘积之和求得的近似值。3.近似原子量①同位素原子量不是元素的原子量。②某些时候,同位素原子量可代替元素原子
量进行必要的计算。③必要时,元素的原子量可用质量数代替。回目录页 天才来自于勤奋金属性非金属性强弱金属性
强弱下一页重 点 难 点 突 破 ①与水反应置换氢的难易②与酸反应置换氢的难易③最高价氧化物的水化物的碱性强弱另外,①相互置换能力②与非金属化合难易③单质制备难易回目录页 天才来自于勤奋金属性非金属性强弱非金属
性强弱下一页重 点 难 点 突 破 ①与H2化合难易②气态氢化物的稳定性③最高价含氧酸的酸性强弱另外,①与金属化合难易②气态氢化物的还原性③相互置换情况回目录页 天才来自于勤奋金属性非金属性强弱下一页重 点 难 点 突 破 金属性、非金属性是元素的性质;注意:金属性活泼性、非金属活泼性是单质的性质;如N2与白磷:N的非金属性比P强;但N2不如
白磷活泼。回目录页 天才来自于勤奋推断序数的常见题型下一页重 点 难 点 突 破 NaCl、HCl、MgO、CO、NO、NaH……AB型:A2B型:Na2S、H2O、N2O……AB2型:CaCl2、CO2、NO2、OF2(CaC2、FeS2)……H2O2、Na2O2、C2H2……A2B2型:A2B3型:Al2O3、Al2S3、N2O3……A3B2型:Mg3N2……AB3型:AlCl3、NH3、PCl3、BF3……重 点 难 点 突 破 回目录页 天才来自于勤奋微粒半径的比较原子半径:下一页同周期由左至右逐渐变小;同主族由上而下逐渐增大。离子半径:⑴金属阳离子半径小于其原子半径;⑵非金属阴离子半径大于其原子半径;⑶高价离子半径小于其低价离子半径;⑷电子层结构相同的微粒核电荷越多半径越小;(N3—)>(O2 — )>F — >Na+>Mg2 + >Al3+S2—>Cl — >K+>Ca2 + 重 点 难 点 突 破 回目录页 天才来自于勤奋化 合 物 的 判 别下一页⑴只要有阴阳离子,即可判断为离子化合物;⑵非金属元素间形成的化合物为共价化合物。强碱:NaOH等;大多数盐:NaCl、BaSO4等;注意:NH4+的盐除外。氧化物:Na2O等;类盐:Mg3N2、NaH、Na2O2等;回目录页 天才来自于勤奋知 识 关 联“位、构、性”的推断应记忆1~18号元素的结构
性质特点:下一页1H:原子半径最小;外层电子数=周期数;电子 总数=电子层数;第IA族中能形成共价化合物的元素;在化合物中其数目改变质量分数变化不大;原子序数最小;没有中子;成酸、碱的必须元素;单质密度最小;单质可由金属与水或酸反应得到;单质是电解水产物之一;与O可生成两种液体H2O、H2O2。知 识 关 联 知 识 关 联 回目录页 天才来自于勤奋知 识 关 联下一页2He:最外层属饱和结构,但不是8个电子;电子总数是电子层数的两倍。3Li:最外层电子数是次外层的一半;碱金属中不能形成过氧化物;有机催化剂;热核反应原料之一;密度最小最轻的金属;保存于石蜡中。4Be:最外层电子数=次外层电子数;最外层电子数=电子层数;氧化物为BeO;价态为+2价。5B:最外层电子数比次外层多一个;BF3属非极性分子;氢化物B2H6;硼酸(H3BO3)为一元酸;硼砂(Na2B4O7·10H2O)是硼酸盐玻璃材料。知 识 关 联回目录页 天才来自于勤奋知 识 关 联下一页6C:最外层电子数是次外层的二倍;是形成化合物最多的元素;有金刚石、石墨与同素异形体(C60);氧化物CO、CO2;简单氢化物CH4;正四面体结构键角109°28′;最高价含氧酸H2CO3;氧炔焰;C2H2(乙炔);CaC2俗名电石;尿素CO(NH2)2含氮46%;除稀有气体外,既难得电子,又难失电子,难以形成离子;CH4中C占3/4(75%),H占1/4(25%);CaCO3式量为100;CO2通入石灰水生成沉淀再消失;CO2灭火;CO2充汽水。知 识 关 联 回目录页 天才来自于勤奋知 识 关 联下一页7N:最外层电子比次外层多3个;单质空气中含量最多,除稀有气体外难以与其他物质反应;化肥三元素之一;氢化物NH3;氧化物形式最多(六种);含氧酸有HNO3、HNO2;气态氢化物水溶液唯一呈碱性;常见离子化合物NH4Cl中含配位健;NH4+属正四面体结构;NH3喷泉;液氨冷冻剂。8O:最外层电子是次外层的三倍;地壳含量最多;占空气体积21%;与金属生成金属氧化物;有H2O2 H2O,Na2O,Na2O2等特殊化合物形式;O2能助燃。知 识 关 联 回目录页 天才来自于勤奋知 识 关 联下一页9F:最外层电子数比次外层多5个,除H外前18号元素原子半径最小;无正价;不能被任何物质氧化;能与水反应置换出水为的氧;CaF2难溶,AgF能溶于水;没有含氧酸;HF为弱酸。10Ne:略。11Na:最外层电子数是次外层的1/8,最内层的1/2;前18号元素原子半径最大;碱为NaOH;有Na2O、Na2O2等; Na2O2漂白及与H2O、CO2反应放O2;与K的合金是原子能反应堆的导热剂。知 识 关 联 回目录页 天才来自于勤奋知 识 关 联下一页12Mg:最外层电子数=最内层电子数,次外层电子数是最外层电子的4倍,Mg(OH)2难溶性中强碱;Mg遇冷水难反应,遇热水能放H2;MgCl2苦卤。13Al:最外层比次外层少5个电子;最外层电子数=电子层数;Al是两性金属;Al2O3是两性氧化物;Al(OH)3是两性氢氧化物;地壳中含量最多的金属;KAl(SO4)2·12H2O明矾净水;Al2(SO4)3与NaHCO3灭火。知 识 关 联回目录页 天才来自于勤奋知 识 关 联下一页14Si:最外层电子数是次外层的一半,最内层的两倍;地壳中含量排第二位;SiO2唯一原子晶体氧化物(中学);气态氢化物SiH4;含氧酸H4SiO4、H2SiO3(比碳酸弱);SiO2是硅酸盐水泥、玻璃的主要成分。15P:最外层比次外层少3个电子;PH3鬼火燃烧;P4白磷分子晶体键角60°;含氧酸有二:H3PO4、HPO3等,磷酸盐有三种形式;磷酸通常为固体;式量为98。知 识 关 联 回目录页 天才来自于勤奋知 识 关 联下一页16S:最外层电子比次外层少2个电子;1~18号中离子半径最大;最外层与最内层电子数之和=次外层电子数;氢化物H2S有臭鸡蛋气味;硫铁矿(黄)FeS2中S呈—1价;SO2、SO3中S各占50%和40%;H2SO4与NaCl制HCl;NaHSO4与NaCl反应,常见钠盐:Na2S、NaHS、Na2SO3、NaHSO3、Na2SO4、NaHSO4;对应酸: H2SO4 、H2SO3,还有H2S2O3特殊形式;硫黄通常为黄色晶体或粉末,易溶于CS2;S用于除去液态金属Hg。
知 识 关 联 回目录页 天才来自于勤奋知 识 关 联下一页17Cl:最外层比次外层少1个电子,比最内层多5个电子;单质黄绿色;含氧酸形式有HClO、HClO2、HClO3、HClO4;HClO4是最强酸,有漂白、杀菌、消毒作用;电解食盐水制Cl2。18Ar:略。重点是:H、C、N、O、F、Na、Mg、Al、Si、P、S、Cl此外还应记主族的一些常见元素如:Br、I及其化合物的特性,还有过渡元素Ag、Fe、Cu等的性质。
