物质结构-元素周期律-复习[下学期]
文档属性
| 名称 | 物质结构-元素周期律-复习[下学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-06-06 00:00:00 | ||
图片预览





文档简介
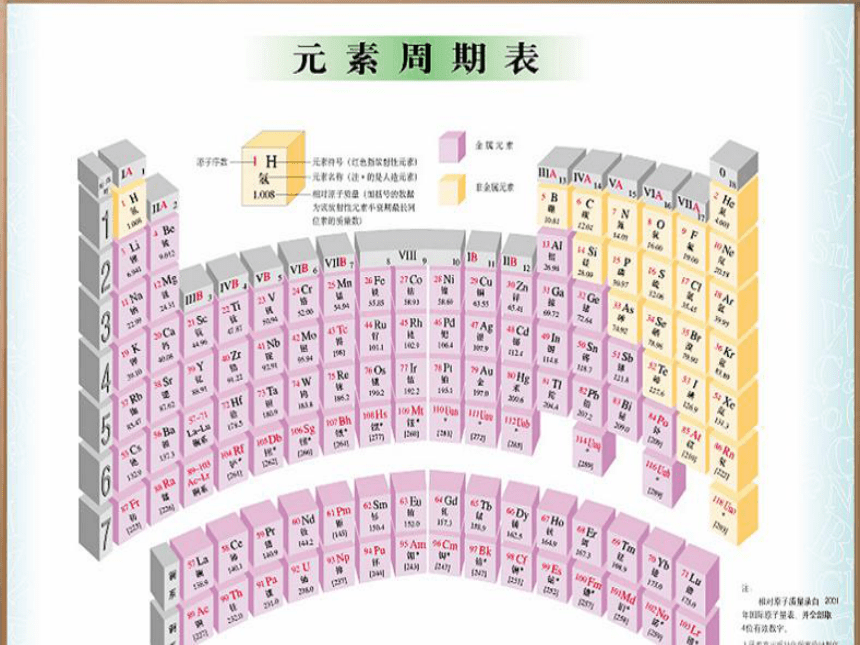
课件18张PPT。高一化学第五章复习课物质结构 元素周期律第二课时二、元素周期表(一)元素周期律1、元素周期律的实质及内容
内容:元素的性质随着元素原子序数的递增而呈周期性的变化,这个规律叫元素周期律。
实质:元素性质周期性变化的实质是元素原子的核外电子排布的周期性变化。2、几种关系量:
|负价|+|正价|=8
最外层电子=主族的族序数=主族元素的最高正价
元素性质的周期性变化
原子最外层电子数目 1→8
元素的原子半径 大→小
主要化合价 正价+1→+7
负价-4→-1(一)元素周期律3、金属性、非金属性强弱的判断原则:
金属性判断:
①元素的单质与水或酸反应置换出氢的难易或反应的剧烈程度;
②元素单质的还原性(或离子的氧化性);
③元素的氧化物对应的水化物碱性强弱。
④金属与盐溶液发生的金属 间的置换反应
非金属性强弱判断
①与氢气反应生成气态氢化物的难易程度或反应的剧烈程度或生成的气态氢化物的稳定性强弱;
②元素最高价氧化物对应的水化物酸性强弱;
③单质的氧化性(或离子的还原性)强弱。
④非金属单质间的置换反应 课堂练习1、A原子在M层上有3个电子,B原子在L层上有6个电子,它们组成稳定化合物的化学式是:
A、A2B B、AB C、A3B2 D、A2B3
2、下列性质的递变顺序中正确的是:
A、K+、Cl--、Cl微粒半径依次增大
B、H2O、H2S、PH3稳定性依次减弱
C、Li、Na、K单质的熔点依次升高
D、NaOH、KOH、Ca(OH)2碱性依次增强DB元素周期表中元素性质递变规律 大→小小→大电子层数相同、最外层电子增多失减得递增失增得递减金属性减、非金属性增金属性增、非金属性减最高正价+1→+7
负价-4→-1最高正价=主族系数
最高正价、负价相同碱性逐渐减弱
酸性逐渐增强碱性逐渐增强
酸性逐渐减弱形成:难→易
稳定性:弱→强 形成:易→难
稳定性:强→弱电子层增多最外层电子数相同当m/n<1时,为金属元素,其最高价氧化物的水化物显碱性;
当m/n=1时,为两性元素(氢除外),其氧化物的水化物显两性;
当m/n>1时,为非金属元素,其最高价氧化物的水化物显酸性。
m/n值越小,元素的金属性越强,其对应氧化物的水化物的碱性越强;
m/n值越大,元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强。若主族元素族序数为m周期数为n,则周期表中A、B两元素若处在如图所示的位置,则性质相似。对角线规则如Be和Al单质在常温下能被浓硫酸钝化,BeO和Al2O3均显两性,AlCl3和BeCl2均为共价化合物等。元素周期表与原子结构的关系
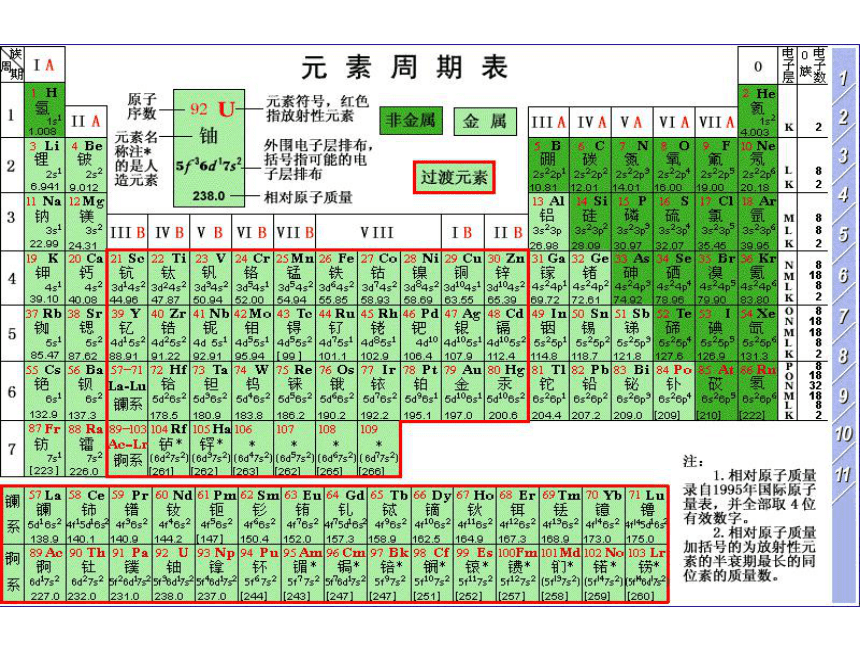
周期序数= 。
主族序数= = =价电子数
主族元素的最低负化合价= =最高正价-8 电子层数 最外层电子数 最高正化合价 主族序数-8如何由原子序数确定位置?由给定的原子序数与就近的稀有气体元素的原子序数的差值推出所在周期与族。如84号元素84=86-2 故84号元素与86号元素同周期,在第六周期。
8-2=6 在第ⅦA族。同周期元素(除稀有气体外)的原子半径随原子序数的递增逐渐减小;
同主族元素的原子半径、阴、阳离子半径随电子层数的递增逐渐增大。
同种元素的各种微粒,核外电子数越多,半径越大。
具有同电子层结构的各种微粒,核电荷数越大,离子半径越小。
注:电子层数多的阴离子半径 一定大于电子层数少的阳离子半径;而电子层数多的阳离子半径则不一定大于电子层数少的阴离子半径。微粒半径大小比较课堂练习1、某主族元素X原子的质量数为79,已知X离子含有45个中子和36个电子,下列有关X元素的叙述错误的是( )
A、X元素属于第IIA族。
B、X位于第4周期
C、X元素最高价氧化物水化物为H2XO4
D、X元素气态氢化物化学式为H2XA2、国际无机化学命名委员会在1989年做出决定,把长式周期表原先的主、副族及族号取消,由左到右改为第1~18列,碱金属族为第1列,稀有气体为第18列,按这个规定,下列说法不正确的是( )
A、第15列元素的最高价氧化物为R2O5
B、第2列元素中肯定没有非金属元素
C、第17列元素的第一种元素无含氧酸
D、第16、17列元素都是非金属元素
3、下列物质中阳离子与阴离子半径比值最大的是( )
A、NaI B、CsF
C、KCl D、NaFDB4、A、B、C三种元素的原子具有相同的电子层数,B的核电荷数比A大2个单位,C的质子数比B多4 个,1mol A的单质和稀盐酸反应能置换出1gH2,这时A转化为具有与氖原子相同电子层结构的离子。试回答下列问题:
(1)写出这三种元素的元素符号A 、B 、C 。
(2)写出A、C最高价氧化物对应水化物相互反应的离子方程式 。
(3)写出A、B的最高价氧化物对应水化物相互反应的化学方程式 。 NaAlClOH—+H+=H2O NaOH+Al(OH)3═ NaAlO2+2H2O 小结 元素周期律 元素周期表作业:
P119 三、2、3
四、1
内容:元素的性质随着元素原子序数的递增而呈周期性的变化,这个规律叫元素周期律。
实质:元素性质周期性变化的实质是元素原子的核外电子排布的周期性变化。2、几种关系量:
|负价|+|正价|=8
最外层电子=主族的族序数=主族元素的最高正价
元素性质的周期性变化
原子最外层电子数目 1→8
元素的原子半径 大→小
主要化合价 正价+1→+7
负价-4→-1(一)元素周期律3、金属性、非金属性强弱的判断原则:
金属性判断:
①元素的单质与水或酸反应置换出氢的难易或反应的剧烈程度;
②元素单质的还原性(或离子的氧化性);
③元素的氧化物对应的水化物碱性强弱。
④金属与盐溶液发生的金属 间的置换反应
非金属性强弱判断
①与氢气反应生成气态氢化物的难易程度或反应的剧烈程度或生成的气态氢化物的稳定性强弱;
②元素最高价氧化物对应的水化物酸性强弱;
③单质的氧化性(或离子的还原性)强弱。
④非金属单质间的置换反应 课堂练习1、A原子在M层上有3个电子,B原子在L层上有6个电子,它们组成稳定化合物的化学式是:
A、A2B B、AB C、A3B2 D、A2B3
2、下列性质的递变顺序中正确的是:
A、K+、Cl--、Cl微粒半径依次增大
B、H2O、H2S、PH3稳定性依次减弱
C、Li、Na、K单质的熔点依次升高
D、NaOH、KOH、Ca(OH)2碱性依次增强DB元素周期表中元素性质递变规律 大→小小→大电子层数相同、最外层电子增多失减得递增失增得递减金属性减、非金属性增金属性增、非金属性减最高正价+1→+7
负价-4→-1最高正价=主族系数
最高正价、负价相同碱性逐渐减弱
酸性逐渐增强碱性逐渐增强
酸性逐渐减弱形成:难→易
稳定性:弱→强 形成:易→难
稳定性:强→弱电子层增多最外层电子数相同当m/n<1时,为金属元素,其最高价氧化物的水化物显碱性;
当m/n=1时,为两性元素(氢除外),其氧化物的水化物显两性;
当m/n>1时,为非金属元素,其最高价氧化物的水化物显酸性。
m/n值越小,元素的金属性越强,其对应氧化物的水化物的碱性越强;
m/n值越大,元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强。若主族元素族序数为m周期数为n,则周期表中A、B两元素若处在如图所示的位置,则性质相似。对角线规则如Be和Al单质在常温下能被浓硫酸钝化,BeO和Al2O3均显两性,AlCl3和BeCl2均为共价化合物等。元素周期表与原子结构的关系
周期序数= 。
主族序数= = =价电子数
主族元素的最低负化合价= =最高正价-8 电子层数 最外层电子数 最高正化合价 主族序数-8如何由原子序数确定位置?由给定的原子序数与就近的稀有气体元素的原子序数的差值推出所在周期与族。如84号元素84=86-2 故84号元素与86号元素同周期,在第六周期。
8-2=6 在第ⅦA族。同周期元素(除稀有气体外)的原子半径随原子序数的递增逐渐减小;
同主族元素的原子半径、阴、阳离子半径随电子层数的递增逐渐增大。
同种元素的各种微粒,核外电子数越多,半径越大。
具有同电子层结构的各种微粒,核电荷数越大,离子半径越小。
注:电子层数多的阴离子半径 一定大于电子层数少的阳离子半径;而电子层数多的阳离子半径则不一定大于电子层数少的阴离子半径。微粒半径大小比较课堂练习1、某主族元素X原子的质量数为79,已知X离子含有45个中子和36个电子,下列有关X元素的叙述错误的是( )
A、X元素属于第IIA族。
B、X位于第4周期
C、X元素最高价氧化物水化物为H2XO4
D、X元素气态氢化物化学式为H2XA2、国际无机化学命名委员会在1989年做出决定,把长式周期表原先的主、副族及族号取消,由左到右改为第1~18列,碱金属族为第1列,稀有气体为第18列,按这个规定,下列说法不正确的是( )
A、第15列元素的最高价氧化物为R2O5
B、第2列元素中肯定没有非金属元素
C、第17列元素的第一种元素无含氧酸
D、第16、17列元素都是非金属元素
3、下列物质中阳离子与阴离子半径比值最大的是( )
A、NaI B、CsF
C、KCl D、NaFDB4、A、B、C三种元素的原子具有相同的电子层数,B的核电荷数比A大2个单位,C的质子数比B多4 个,1mol A的单质和稀盐酸反应能置换出1gH2,这时A转化为具有与氖原子相同电子层结构的离子。试回答下列问题:
(1)写出这三种元素的元素符号A 、B 、C 。
(2)写出A、C最高价氧化物对应水化物相互反应的离子方程式 。
(3)写出A、B的最高价氧化物对应水化物相互反应的化学方程式 。 NaAlClOH—+H+=H2O NaOH+Al(OH)3═ NaAlO2+2H2O 小结 元素周期律 元素周期表作业:
P119 三、2、3
四、1
