专题复习:物质结构(一)[下学期]
文档属性
| 名称 | 专题复习:物质结构(一)[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 25.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-06-20 12:00:00 | ||
图片预览






文档简介
课件15张PPT。专题复习一物质结构(一)知识点:
1. 原子结构及其几个关系式的运用;
2. 原子核外电子排布规律及其应用;
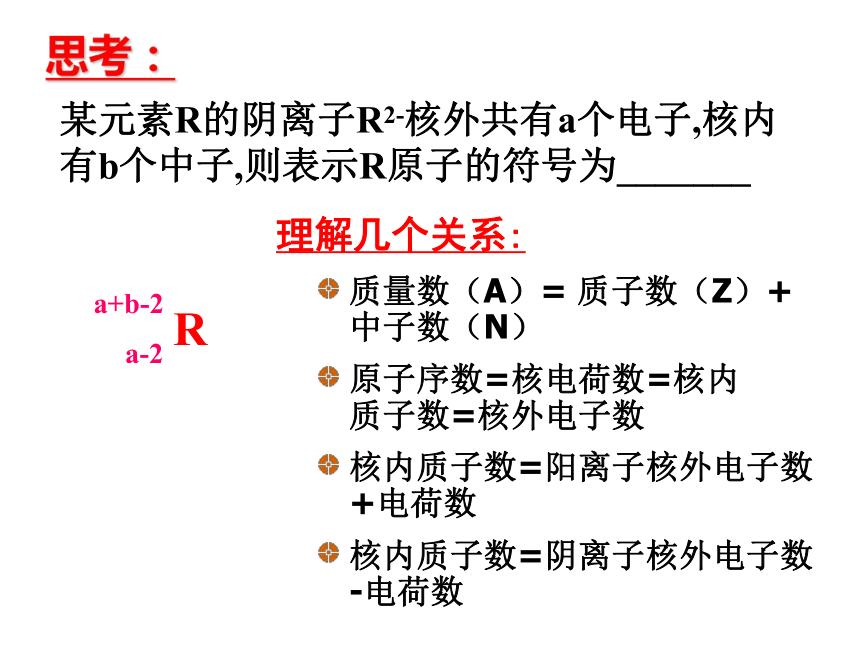
3. 同位素及相对原子质量的计算.某元素R的阴离子R2-核外共有a个电子,核内有b个中子,则表示R原子的符号为_______原子序数=核电荷数=核内质子数=核外电子数 核内质子数=阳离子核外电子数 +电荷数核内质子数=阴离子核外电子数 -电荷数质量数(A)= 质子数(Z)+ 中子数(N) 理解几个关系:思考:1.科学家最近制造出第112号新元素,其原子的质量数为277,这是迄今已知元素中最重的原子.关于该新元素的下列叙述正确的是( ).
(A)其原子核内中子数和质子数都是112
(B)其原子核内中子数为165,核外电子数为112
(C)其原子质量是12C原子质量的277倍
(D)其原子质量与12C原子质量之比为277:12 2. 核外电子总数为10的粒子:
1)阳离子:_______________________
2)阴离子:_______________________
3)分子:__________________________Na+、Mg2+、Al3+、NH4+、H3O+N3-、O2-、F-、OH-、NH2-Ne、HF、H2O、NH3、CH4BD常见题型3.若阴离子XO3-含有42个电子,质量数为83,氧原子的中子数等于质子数,则X元素原子核内中子数为( )
A. 18 B. 13 C. 15 D. 7A二、同位素同位素:具有相同质子数和不同中子数的原子互为同位素同位素的性质:
1.各种同位素的化学性质基本相同;
2. 天然存在的同位素原子所占的百分数是不变的元素相对原子质量:指某元素各种同位素的相对原子质量与该同位素原子所占的原子个数百分比的乘积之和;
(Mr= M1×a% + M2×b%+……)
元素近似相对原子质量:指某元素各种同位素的质量数与该同位素原子所占的原子个数百分比的乘积之和;
(Mr= A1×a% + A2×b%+……)例: 氯元素的同位素: 35Cl 37Cl
同位素的质量数: 35 37
同位素的相对原子质量: 34.969 36.966
原子个数百分比(丰度): 75.77% 24.23%氯元素的相对原子质量
=34.969×75.77% + 36.966×24.23%=35.45氯元素的近似相对原子质量
=35×75.77% + 37×24.23%=35.51. 有5种粒子,它们是4018A、4019B、4020C+、4020D、4120E,这五种微粒中属于的元素种类有( )
A、2种 B、3种
C、4种 D、5种常见题型2.硼有两种天然同位素105B,115B硼元素的原子量为10.80,则对硼元素中105B的质量分数判断正确的是 A.20% B.略大于20%
C.略小于20% D.80% BC3.电解H2O和D2O的”混和物”时,若电路中转移了3.75 mol的电子时,两极共生成气体34.5 g,在所得气体中,H 和D 的原子个数比为( )
A. 1 :4 B. 4 :1 C. 3 :1 D. 1 :3 B三、原子核外电子分层排布规律 核外电子总是尽先排布在能量较____的电子层,然后由里向外,依次排布在能量逐步________的电子层。 原子核外各电子层最多容纳_______个电子。 原子最外层电子数目不能超过____个(K层为最外层时不能超过____个),次外层电子数目不能超过____个,倒数第三层电子数目不能超过____个。 要求:熟练掌握1~20号元素的排布规律,
其中出现几率最大的元素:H、C、O、F、Na、Mg、Al、Si、S、Cl、K,特别是H、O。例:在1~18号元素中,写出符合下列要求的元素符号:
1. 最外层电子数与电子层数相等的元素:____
2. 最外层电子数是次外层电子数2倍的元素:___
3.最外层电子数是次外层电子数1/2的元素:___
4.最外层电子数与次外层电子数相等的元素:___H、Be、AlCLi、SiBe、Ar1. 短周期元素中, A元素原子最外层电子数是次外层电子数的2倍; B元素最外层电子数是其内层上电子总数的3倍; C元素原子次外层电子数等于其原子核外电子总数的一半; D元素原子最外层有1个电子, D的阳离子与B的阴离子电子层结构相同, 则4种元素的原子序数关系是___________常见题型C>D>B>A2.A、B、C、D、E、F为原子序数依次增大的同周期主族元素,已知A、C、F三原子的最外层共有10个电子,且这三种元素最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4,E元素原子次外层电子数比最外层电子数多3,回答: ①写出下列元素的符号:B????? 、D???? 、E??? ? 。 ②用电子式写出A、F形成化合物的电子式??? ??? 。 ③A、C两种元素最高价氧化物的水化物反应的离子方程式?????????????????????????????????????????????????。 ④D单质与A元素最高价氧化物的水化物反应的化学方程式__________________________.MgSiP3.有A、B、C、D、E五种元素。已知(1)A原子最外层电子数是次外层电子数的2倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同。E原子M层上的电子比K层多5个。(2)常温下B2是气体,它对氢气的相对密度是16。(3)C的单质在B2中燃烧,生成淡黄色固体F,F与AB2反应可生成B2。(4) D的单质在B2中燃烧,发出蓝紫色火焰,生成有刺激性气味的气体DB2,D在DB2中含量为50%。根据以上情况,回答下列问题:
a、A是___,B是____,C是____,
b、E的原子结构示意图是____,C的离子结构示意图是____,AB2的电子式是_____。
c、用电子式表示C和D形成离子键的过程_____
d、F和AB2反应的化学方程式________________。提示: C,O,Na,S,Cl本课到此结束每天做点化学方面的练习,别停止,这样可以使你熟能生巧。
1. 原子结构及其几个关系式的运用;
2. 原子核外电子排布规律及其应用;
3. 同位素及相对原子质量的计算.某元素R的阴离子R2-核外共有a个电子,核内有b个中子,则表示R原子的符号为_______原子序数=核电荷数=核内质子数=核外电子数 核内质子数=阳离子核外电子数 +电荷数核内质子数=阴离子核外电子数 -电荷数质量数(A)= 质子数(Z)+ 中子数(N) 理解几个关系:思考:1.科学家最近制造出第112号新元素,其原子的质量数为277,这是迄今已知元素中最重的原子.关于该新元素的下列叙述正确的是( ).
(A)其原子核内中子数和质子数都是112
(B)其原子核内中子数为165,核外电子数为112
(C)其原子质量是12C原子质量的277倍
(D)其原子质量与12C原子质量之比为277:12 2. 核外电子总数为10的粒子:
1)阳离子:_______________________
2)阴离子:_______________________
3)分子:__________________________Na+、Mg2+、Al3+、NH4+、H3O+N3-、O2-、F-、OH-、NH2-Ne、HF、H2O、NH3、CH4BD常见题型3.若阴离子XO3-含有42个电子,质量数为83,氧原子的中子数等于质子数,则X元素原子核内中子数为( )
A. 18 B. 13 C. 15 D. 7A二、同位素同位素:具有相同质子数和不同中子数的原子互为同位素同位素的性质:
1.各种同位素的化学性质基本相同;
2. 天然存在的同位素原子所占的百分数是不变的元素相对原子质量:指某元素各种同位素的相对原子质量与该同位素原子所占的原子个数百分比的乘积之和;
(Mr= M1×a% + M2×b%+……)
元素近似相对原子质量:指某元素各种同位素的质量数与该同位素原子所占的原子个数百分比的乘积之和;
(Mr= A1×a% + A2×b%+……)例: 氯元素的同位素: 35Cl 37Cl
同位素的质量数: 35 37
同位素的相对原子质量: 34.969 36.966
原子个数百分比(丰度): 75.77% 24.23%氯元素的相对原子质量
=34.969×75.77% + 36.966×24.23%=35.45氯元素的近似相对原子质量
=35×75.77% + 37×24.23%=35.51. 有5种粒子,它们是4018A、4019B、4020C+、4020D、4120E,这五种微粒中属于的元素种类有( )
A、2种 B、3种
C、4种 D、5种常见题型2.硼有两种天然同位素105B,115B硼元素的原子量为10.80,则对硼元素中105B的质量分数判断正确的是 A.20% B.略大于20%
C.略小于20% D.80% BC3.电解H2O和D2O的”混和物”时,若电路中转移了3.75 mol的电子时,两极共生成气体34.5 g,在所得气体中,H 和D 的原子个数比为( )
A. 1 :4 B. 4 :1 C. 3 :1 D. 1 :3 B三、原子核外电子分层排布规律 核外电子总是尽先排布在能量较____的电子层,然后由里向外,依次排布在能量逐步________的电子层。 原子核外各电子层最多容纳_______个电子。 原子最外层电子数目不能超过____个(K层为最外层时不能超过____个),次外层电子数目不能超过____个,倒数第三层电子数目不能超过____个。 要求:熟练掌握1~20号元素的排布规律,
其中出现几率最大的元素:H、C、O、F、Na、Mg、Al、Si、S、Cl、K,特别是H、O。例:在1~18号元素中,写出符合下列要求的元素符号:
1. 最外层电子数与电子层数相等的元素:____
2. 最外层电子数是次外层电子数2倍的元素:___
3.最外层电子数是次外层电子数1/2的元素:___
4.最外层电子数与次外层电子数相等的元素:___H、Be、AlCLi、SiBe、Ar1. 短周期元素中, A元素原子最外层电子数是次外层电子数的2倍; B元素最外层电子数是其内层上电子总数的3倍; C元素原子次外层电子数等于其原子核外电子总数的一半; D元素原子最外层有1个电子, D的阳离子与B的阴离子电子层结构相同, 则4种元素的原子序数关系是___________常见题型C>D>B>A2.A、B、C、D、E、F为原子序数依次增大的同周期主族元素,已知A、C、F三原子的最外层共有10个电子,且这三种元素最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4,E元素原子次外层电子数比最外层电子数多3,回答: ①写出下列元素的符号:B????? 、D???? 、E??? ? 。 ②用电子式写出A、F形成化合物的电子式??? ??? 。 ③A、C两种元素最高价氧化物的水化物反应的离子方程式?????????????????????????????????????????????????。 ④D单质与A元素最高价氧化物的水化物反应的化学方程式__________________________.MgSiP3.有A、B、C、D、E五种元素。已知(1)A原子最外层电子数是次外层电子数的2倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同。E原子M层上的电子比K层多5个。(2)常温下B2是气体,它对氢气的相对密度是16。(3)C的单质在B2中燃烧,生成淡黄色固体F,F与AB2反应可生成B2。(4) D的单质在B2中燃烧,发出蓝紫色火焰,生成有刺激性气味的气体DB2,D在DB2中含量为50%。根据以上情况,回答下列问题:
a、A是___,B是____,C是____,
b、E的原子结构示意图是____,C的离子结构示意图是____,AB2的电子式是_____。
c、用电子式表示C和D形成离子键的过程_____
d、F和AB2反应的化学方程式________________。提示: C,O,Na,S,Cl本课到此结束每天做点化学方面的练习,别停止,这样可以使你熟能生巧。
