物质结构周期律复习[下学期]
文档属性
| 名称 | 物质结构周期律复习[下学期] | 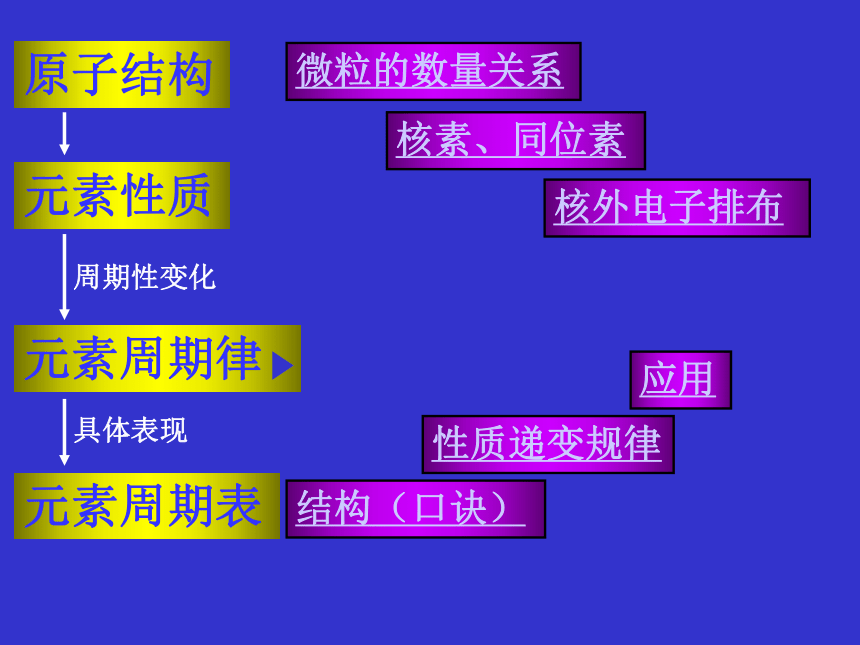 | |
| 格式 | rar | ||
| 文件大小 | 225.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-07-08 19:19:00 | ||
图片预览







文档简介
课件28张PPT。原子结构微粒的数量关系核素、同位素核外电子排布元素周期律元素周期表结构(口诀)性质递变规律应用元素性质周期性变化具体表现构成原子的粒子关系:质子数=核电荷数=核外电子数=原子序数质量数=质子数+中子数阳离子的核外电子数=质子数-所带电荷数阴离子的核外电子数=质子数+所带电荷数1、某三价金属阳离子,具有28个电子,其质量数为70,那么它的核内中子数是
A、28 B、31 C、39 D、42√ 2、元素R的一个原子,质量数为a,其阴
离子Rn- 有b个电子,则mg该原子中子
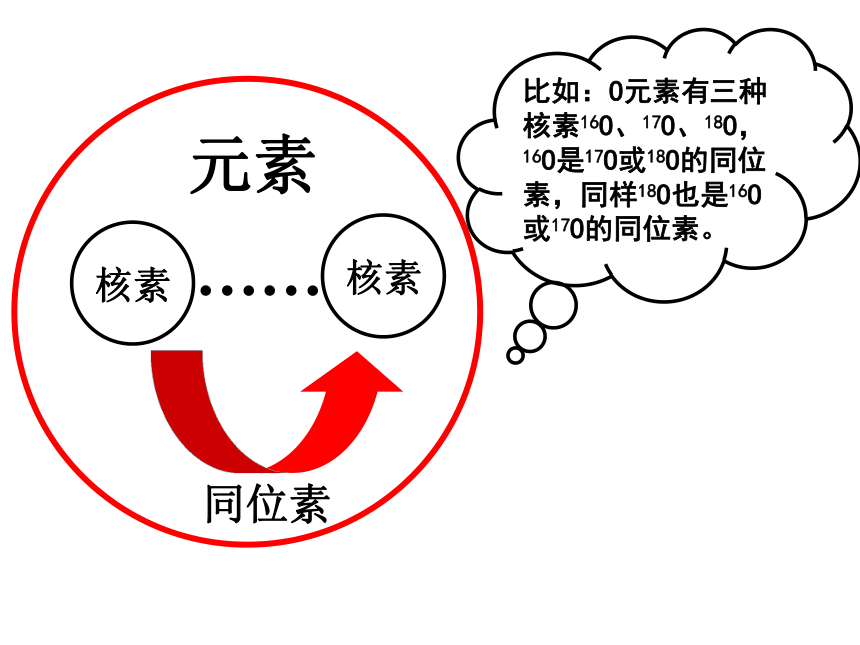
的物质的量为 mol。 (a-b+n )am元素核素核素同位素……比如:O元素有三种核素16O、17O、18O, 16O是17O或18O的同位素,同样18O也是16O或17O的同位素。3、11H、21H、31H、H+、H2是
A、氢的五种核素
B、互为同位素
C、五种氢元素
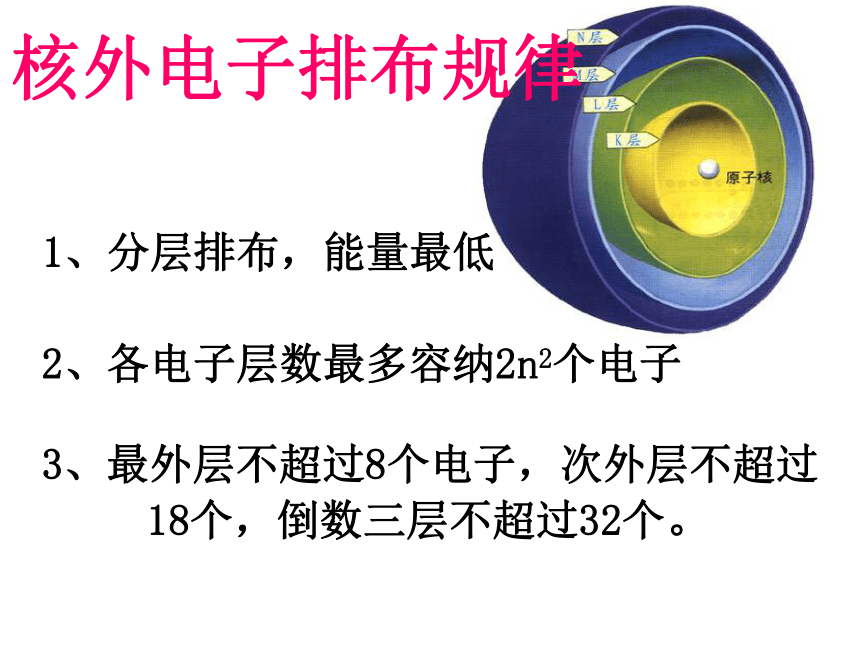
D、氢元素的五种不同微粒√ 质子 中子最外层电子质子、中子核外电子排布规律1、分层排布,能量最低2、各电子层数最多容纳2n2个电子3、最外层不超过8个电子,次外层不超过18个,倒数三层不超过32个。4、某元素原子核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是 元素的性质随着元素原子序数的递增而呈周期性变化⑴核外电子排布(实质)
⑵原子半径(大小比较)
⑶主要化合价原子序数5、已知An+、B(n+1)+ 、Cn- 、D(n+1)- 都具有相同的电子层结构,则 A、B、C、D 的原子半径从大到小的顺序是
A、 A>B>C>D
B、 A>B>D>C
C、 D>C>B>A
D 、 D>B>C>A
√ 周期:三长三短一不全族:主族(ⅠA — ⅦA)副族(ⅠB — ⅦB)第Ⅷ族(8、9、10纵行)0族(稀有气体元素)横7竖18七主七副七周期O族Ⅷ族镧锕系6、判断下列说法是否正确:
①元素周期表中有9个横行,即9个周期
②周期表共有18纵行,每1纵行标作1族
③每一周期所含元素数目都不相等
④每一主族含有的元素一定比每一副族多
⑤同一族元素其最外层电子数一定相同
⑥所有族中ⅢB族含有元素种类最多
⑦ⅠA族全部是金属元素金属性增强非金属性增强金属性增强非金属性增强BAlSiGeAsSbTe8、下表是元素周期表的一部分,回答下列问题:化学性质最不活泼的是 ,只有负价无正价的是 ,原子半径最大的是 ,还原性最强的单质是 ,最高价氧化物对应水化物碱性最强的是 ,酸性最强的是 ,呈两性的是 ,A和C化学性质较活泼的是 ,怎样用化学实验证明?G和H化学性质较活泼的是 ,怎样用化学实验证明?NaKArBrClOCAlMgArOKKOHHClO4KAl(OH)3NaCl2F元素氢化物的化学式是 ,该氢化物在常温下分别与B、G发生反应的化学方程式是 、 。H元素与A元素形成化合物的化学式是 ,高温灼烧此物时,火焰呈 色,此物与G单质反应的化学方程式是 。E元素与G元素形成化合物的化学式是 ,单质H溶于该化合物中所得溶液呈 色。 H2O2H2O+2K=2KOH+H2↑H2O+Cl2=HCl+HClONaBr黄2NaBr+Cl2=2NaCl+Br2CCl4橙金属性强弱比较⒈单质与水或酸反应置换氢的难易⒉最高价氧化物的水化物的碱性强弱⒊单质的还原性强弱非金属性强弱比较⒈与氢化合的难易及气态氢化物的稳定性⒉最高价氧化物的水化物的酸性强弱⒊单质的氧化性强弱10、A、B、C 是相邻的三种短周期元素,其中A、B 同周期,B、C 同主族。此三种元素最外层电子数之和为19,质子数总和为33。则A、B、C 分别是:+ACB+++ABCABCABCx(x-1)+x+x=19
(y-1)+y+y+8=33+FSOy x=20/3
y=26/3∴(x+1)+x+x=19
(y+1)+y+(y+8)=33∴ x=6
y=89、现有含有元素硒(Se)的保健品正开始进入市场,已知它与氧同族,与钾同周期,下列关于硒的叙述不正确的是
A、原子序数为24
B、最高价氧化物化学式为SeO3
C、非金属性比溴强
D、气态氢化物化学式为H2Se√ √ OSeSK…ClBr11、下图为周期表中短周期的一部分,若a原子最外层电子数比次外层电子数少3个,则下列说法不正确的是A、a、b、c最高价氧化物对应水化物的酸性强弱关系是c>b>a。B、a的氢化物比d的氢化物稳定。C、a和d的原子结合能形成带3个负电荷的D、原子半径大小顺序是c<b<d<a。阴离子。√ √ 7、已知同周期的X、Y、Z三元素的最高价氧化物的水化物的酸性由强到弱的顺序:HZO4>H2YO4>H3XO4 ,则下列判断正确的是
A.原子序数按 X、Y、Z 的顺序增大 B.原子半径按 X、Y、Z 的顺序减小 C.单质的氧化性按 X、Y、Z 的顺序减弱 D.气态氢化物的稳定性按 X、Y、Z 的顺序减弱√ √ 原子离子键共价键极性键单质化合物表示方法分子的极性化学式电子式非极性键化学键阴阳离子原子静电作用共用电子对活泼金属与活泼非金属非金属元素离子化合物单质 共价化合物 离子化合物判断下列说法是否正确:4、金属和非金属元素组成的化合物一定3、全部由非金属元素组成的化合物一定1、有离子键的化合物一定是离子化合物。2、有共价键的化合物一定是共价化合物。√ NH4Cl NH4HCO3AlCl3 BeCl2NaOH Na2O2 NH4Cl × × × 是共价化合物。是离子化合物。分子是否具有极性的判断规律⑴A-A型:非极性分子(H2 O2 N2 Cl2)⑵A-B型:极性分子 ( HCl NO CO)⑶ABn型:若中心原子A达到了最高正价,则为非极性分子(PCl5 SO3 CO2 CCl4 BF3)若中心原子A未达到最高正价,则为极性分子(PCl3 SO2 NH3 H2O H2S)⑷由三种或三种以上元素原子构成的分子一般为极性分子(HNO3 CH3Cl)5、对双原子分子而言,键的极性和分子6、极性分子中只有极性键,非极性分子7、有非极性键的物质一定是非极性分子。 9、共价化合物中一定有极性键。CH4 CCl4 CO2 BF3H2O2 Na2O28、只含有非极性键的物质一定是非极性的极性是一致的。中只有非极性键。√ × × √ √ 分子。书写下列电子式:
⑴K2S ⑵N2 ⑶NH3 ⑷CO2 ⑸PCl3 ⑹HCl ⑺NaOH ⑻Na2O2 ⑼CH4其中:
是离子化合物的有:
既有离子键又有共价键的化合物有:
含非极性键的物质有:
含非极性键的非极性分子有:
含极性键的非极性分子有:⑴ ⑺ ⑻ ⑺⑻⑵ ⑻ ⑷ ⑼⑵已知A、B是短周期元素,A元素原子的最外层电子数是次外层电子数的1/2,B元素原子的最外层电子数是次外层电子数的3倍,则A、B可能形成
A、离子化合物A2B B、共价化合物A2B
C、离子化合物AB2 D、共价化合物AB2√ √ ⑴书上复习题
⑵同步练习(二十九) 周日晚第一节课考试作业:(周日前完成)
A、28 B、31 C、39 D、42√ 2、元素R的一个原子,质量数为a,其阴
离子Rn- 有b个电子,则mg该原子中子
的物质的量为 mol。 (a-b+n )am元素核素核素同位素……比如:O元素有三种核素16O、17O、18O, 16O是17O或18O的同位素,同样18O也是16O或17O的同位素。3、11H、21H、31H、H+、H2是
A、氢的五种核素
B、互为同位素
C、五种氢元素
D、氢元素的五种不同微粒√ 质子 中子最外层电子质子、中子核外电子排布规律1、分层排布,能量最低2、各电子层数最多容纳2n2个电子3、最外层不超过8个电子,次外层不超过18个,倒数三层不超过32个。4、某元素原子核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是 元素的性质随着元素原子序数的递增而呈周期性变化⑴核外电子排布(实质)
⑵原子半径(大小比较)
⑶主要化合价原子序数5、已知An+、B(n+1)+ 、Cn- 、D(n+1)- 都具有相同的电子层结构,则 A、B、C、D 的原子半径从大到小的顺序是
A、 A>B>C>D
B、 A>B>D>C
C、 D>C>B>A
D 、 D>B>C>A
√ 周期:三长三短一不全族:主族(ⅠA — ⅦA)副族(ⅠB — ⅦB)第Ⅷ族(8、9、10纵行)0族(稀有气体元素)横7竖18七主七副七周期O族Ⅷ族镧锕系6、判断下列说法是否正确:
①元素周期表中有9个横行,即9个周期
②周期表共有18纵行,每1纵行标作1族
③每一周期所含元素数目都不相等
④每一主族含有的元素一定比每一副族多
⑤同一族元素其最外层电子数一定相同
⑥所有族中ⅢB族含有元素种类最多
⑦ⅠA族全部是金属元素金属性增强非金属性增强金属性增强非金属性增强BAlSiGeAsSbTe8、下表是元素周期表的一部分,回答下列问题:化学性质最不活泼的是 ,只有负价无正价的是 ,原子半径最大的是 ,还原性最强的单质是 ,最高价氧化物对应水化物碱性最强的是 ,酸性最强的是 ,呈两性的是 ,A和C化学性质较活泼的是 ,怎样用化学实验证明?G和H化学性质较活泼的是 ,怎样用化学实验证明?NaKArBrClOCAlMgArOKKOHHClO4KAl(OH)3NaCl2F元素氢化物的化学式是 ,该氢化物在常温下分别与B、G发生反应的化学方程式是 、 。H元素与A元素形成化合物的化学式是 ,高温灼烧此物时,火焰呈 色,此物与G单质反应的化学方程式是 。E元素与G元素形成化合物的化学式是 ,单质H溶于该化合物中所得溶液呈 色。 H2O2H2O+2K=2KOH+H2↑H2O+Cl2=HCl+HClONaBr黄2NaBr+Cl2=2NaCl+Br2CCl4橙金属性强弱比较⒈单质与水或酸反应置换氢的难易⒉最高价氧化物的水化物的碱性强弱⒊单质的还原性强弱非金属性强弱比较⒈与氢化合的难易及气态氢化物的稳定性⒉最高价氧化物的水化物的酸性强弱⒊单质的氧化性强弱10、A、B、C 是相邻的三种短周期元素,其中A、B 同周期,B、C 同主族。此三种元素最外层电子数之和为19,质子数总和为33。则A、B、C 分别是:+ACB+++ABCABCABCx(x-1)+x+x=19
(y-1)+y+y+8=33+FSOy x=20/3
y=26/3∴(x+1)+x+x=19
(y+1)+y+(y+8)=33∴ x=6
y=89、现有含有元素硒(Se)的保健品正开始进入市场,已知它与氧同族,与钾同周期,下列关于硒的叙述不正确的是
A、原子序数为24
B、最高价氧化物化学式为SeO3
C、非金属性比溴强
D、气态氢化物化学式为H2Se√ √ OSeSK…ClBr11、下图为周期表中短周期的一部分,若a原子最外层电子数比次外层电子数少3个,则下列说法不正确的是A、a、b、c最高价氧化物对应水化物的酸性强弱关系是c>b>a。B、a的氢化物比d的氢化物稳定。C、a和d的原子结合能形成带3个负电荷的D、原子半径大小顺序是c<b<d<a。阴离子。√ √ 7、已知同周期的X、Y、Z三元素的最高价氧化物的水化物的酸性由强到弱的顺序:HZO4>H2YO4>H3XO4 ,则下列判断正确的是
A.原子序数按 X、Y、Z 的顺序增大 B.原子半径按 X、Y、Z 的顺序减小 C.单质的氧化性按 X、Y、Z 的顺序减弱 D.气态氢化物的稳定性按 X、Y、Z 的顺序减弱√ √ 原子离子键共价键极性键单质化合物表示方法分子的极性化学式电子式非极性键化学键阴阳离子原子静电作用共用电子对活泼金属与活泼非金属非金属元素离子化合物单质 共价化合物 离子化合物判断下列说法是否正确:4、金属和非金属元素组成的化合物一定3、全部由非金属元素组成的化合物一定1、有离子键的化合物一定是离子化合物。2、有共价键的化合物一定是共价化合物。√ NH4Cl NH4HCO3AlCl3 BeCl2NaOH Na2O2 NH4Cl × × × 是共价化合物。是离子化合物。分子是否具有极性的判断规律⑴A-A型:非极性分子(H2 O2 N2 Cl2)⑵A-B型:极性分子 ( HCl NO CO)⑶ABn型:若中心原子A达到了最高正价,则为非极性分子(PCl5 SO3 CO2 CCl4 BF3)若中心原子A未达到最高正价,则为极性分子(PCl3 SO2 NH3 H2O H2S)⑷由三种或三种以上元素原子构成的分子一般为极性分子(HNO3 CH3Cl)5、对双原子分子而言,键的极性和分子6、极性分子中只有极性键,非极性分子7、有非极性键的物质一定是非极性分子。 9、共价化合物中一定有极性键。CH4 CCl4 CO2 BF3H2O2 Na2O28、只含有非极性键的物质一定是非极性的极性是一致的。中只有非极性键。√ × × √ √ 分子。书写下列电子式:
⑴K2S ⑵N2 ⑶NH3 ⑷CO2 ⑸PCl3 ⑹HCl ⑺NaOH ⑻Na2O2 ⑼CH4其中:
是离子化合物的有:
既有离子键又有共价键的化合物有:
含非极性键的物质有:
含非极性键的非极性分子有:
含极性键的非极性分子有:⑴ ⑺ ⑻ ⑺⑻⑵ ⑻ ⑷ ⑼⑵已知A、B是短周期元素,A元素原子的最外层电子数是次外层电子数的1/2,B元素原子的最外层电子数是次外层电子数的3倍,则A、B可能形成
A、离子化合物A2B B、共价化合物A2B
C、离子化合物AB2 D、共价化合物AB2√ √ ⑴书上复习题
⑵同步练习(二十九) 周日晚第一节课考试作业:(周日前完成)
