元素周期律(习题课)[下学期]
文档属性
| 名称 | 元素周期律(习题课)[下学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 94.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-03-10 00:00:00 | ||
图片预览







文档简介
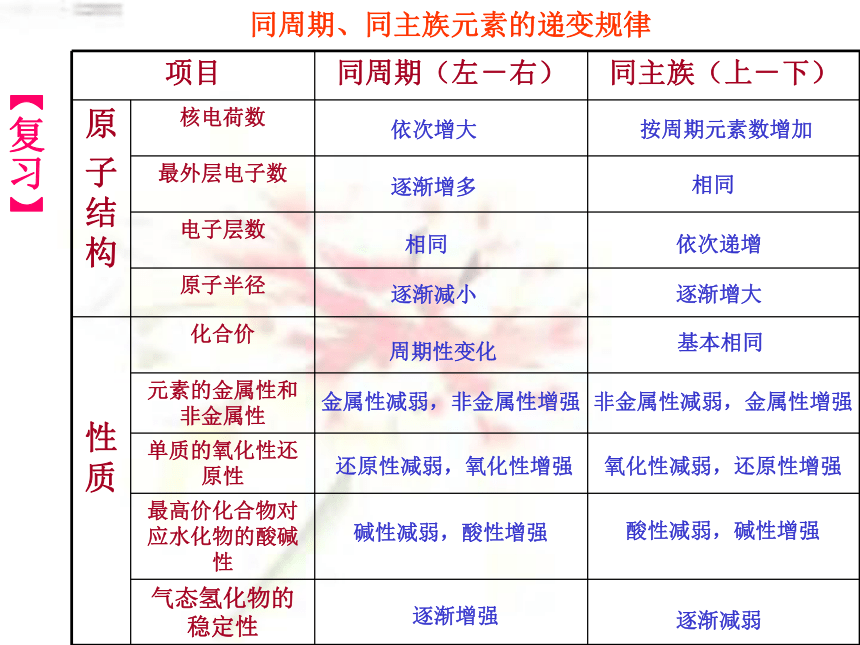
课件20张PPT。第二节 元素周期律(习题课)同周期、同主族元素的递变规律依次增大逐渐增多相同逐渐减小周期性变化金属性减弱,非金属性增强还原性减弱,氧化性增强碱性减弱,酸性增强逐渐增强按周期元素数增加相同依次递增逐渐增大基本相同非金属性减弱,金属性增强氧化性减弱,还原性增强酸性减弱,碱性增强逐渐减弱【复习】【知识整理】
1H:原子序数最小,原子半径最小;没有中子;
外层电子数=周期数;电子总数=电子层数;气体密度最小。
6C:最外层电子数是次外层的两倍;单质硬度最大的,熔沸点最高的,形成化合物品种最多的,正负化合价代数和为零,气态氢化物中含H质量分数最高的是CH4。
7N:最外层电子数比次外层多3个;空气含量最多的元素;氧化物形式最多(6种)的元素;气态氢化物溶解度最大,且其水溶液唯一呈碱性的元素
8O:最外层电子数是次外层的3倍;地壳中含量最多的元素【知识整理】9F:除H元素外,在短周期元素中原子半径最小;只有负价而无正价;不能被任何物质氧化;无含氧酸;气态氢化物最稳定;能置换出水中的O的元素是F。
11Na:短周期元素中原子半径最大,焰色反应显黄色的元素是Na。
12Mg:最外层电子数=最内层电子数,次外层电子数是最外层电子数的4倍的元素是Mg。
13Al:最外层比次外层少5个电子;
最外层电子数=电子层数;形成的氧化物和氢氧化物能溶于酸也能溶于碱;地壳中含量最多的金属元素是Al。【知识整理】14Si:最外层电子数是次外层的一半,是最内层的两倍;其最高价氧化物对应水化物不溶于水的元素是Si。
15P:最外层比次外层少3个电子;能形成键角为60 0正四面体型单质P4的元素是P。
16S:最外层比次外层少2个电子;
次外层电子数=最外层与最内层电子数之和;
黄色粉末状单质,易溶于CS2;
气态氢化物具有臭鸡蛋气味。
17Cl:最外层比次外层少1个电子,比最内层多5个电子,单质为黄绿色气体,其水溶液有漂白性的元素是Cl。例:X和Y均为短周期元素,已知aXn-比bYm+多两个电子层,则下列说法正确的是 ( )A b < 5
B X只能位于第3周期
C a + n – b + m = 10或16
D Y 不可能位于第2周期A C第一周期第二周期第二周期第三周期a + n – b + m
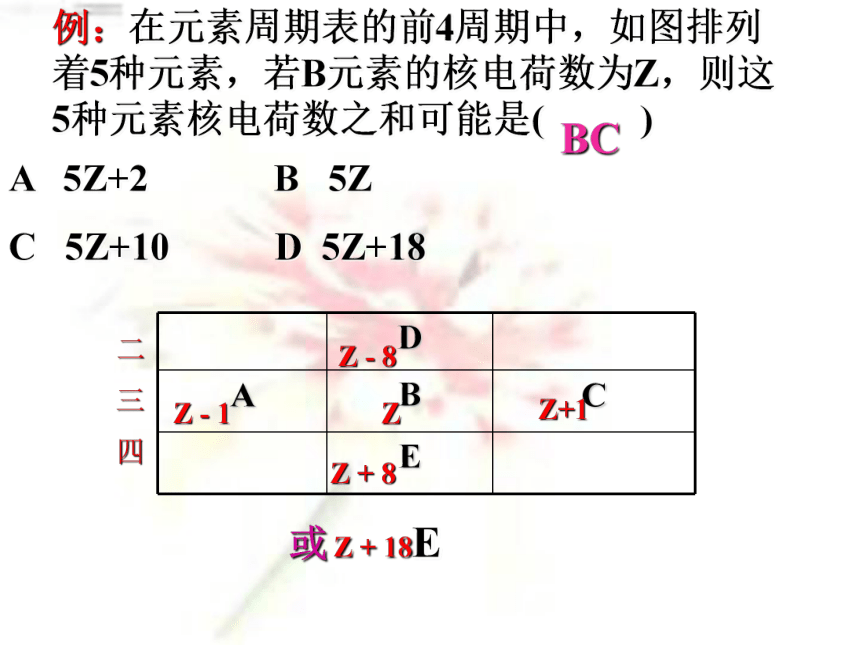
=阴离子电子数 - 阳离子电子数a + n – b + m = 10 – 0 = 10a + n – b + m = 18 – 2 = 16例:在元素周期表的前4周期中,如图排列着5种元素,若B元素的核电荷数为Z,则这5种元素核电荷数之和可能是( )A 5Z+2 B 5Z
C 5Z+10 D 5Z+18BC 二
三
四Z Z - 8 Z + 8
或 Z + 18EZ - 1Z+1试比较 O2- F- Na+ Mg2+ Al3+ 的半径大小核电荷数 8 9 11 12 13电子层数 2 2 2 2 2 电子总数 10 10 10 10 10>>>> 电子排布相同的离子,离子
半径随着核电荷数的递增而减小。 总结: 【课堂练习】1、相邻三个短周期的主族元素A、B、C、D、E,它们的原子序数依次增大,B、C、D元素在同一周期,A、E在同一主族。除A外的各元素的原子的电子层内层已填满电子。其中B的最外层有4个电子。A与B,B与C都能生成气态的化合物。D与E生成离子化合物。在离子化合物中它们化合价的绝对值相等。试回答:它们各是什么元素?H、C、O、F、Na 2、 下列叙述正确的是:
A、两种微粒,若核外电子排布完全相同,则其化学性质一定相同。
B、若两原子核外电子排布相同,则一定是同一种元素。
C、阴离子的核外电子排布,一定与上一周期稀有气体元素原子电子排布相同。
D、凡单原子形成的离子,一定具有稀有气体元素的原子核外电子排布。分子、原子、离子同位素H+、 Fe2+、Fe3+B 3、请选择正确的序号:
A、质子数 B、中子数 C、核外电子数
D、最外层电子数 E、电子层数
1、原子(核素)种类由___ ____ __决定。
2、元素种类由___ ____ __决定。
3、元素有同位素由___ ____ __决定。
4、同位素原子量由___ ____ __决定。
5、原子半径由___ ____ __决定。
6、元素化合价由___ ____ __决定。
7、元素化学性质由___ ____ __决定。
8、价电子数通常是指___ ____ __。
9、核电荷数由___ ____ __决定。ABABAB A、 E、CDDDA4、元素位、构、性三者关系***处于同周期的相邻两种元素A和B,A的最高价氧化物的水化物的碱性比B弱,A处于B的 边(左或右);B的原子半径比A ;若B的最外层有2个电子,则A最外层有 个电子。
***处于同周期的相邻两种元素A和B,A的最高价氧化物的水化物的酸性比B弱,A处于B的 边(左或右);B的原子半径比A ;若B的最外层有3个电子,则A最外层有 个电子。右大3左小25:下列各组元素性质递变情况错误的是( )
A.Li、B、Be原子最外层电子数依次增多
B.P、S、Cl元素最高正化合价依次升高
C.B、C、N、O、F 原子半径依次增大
D.Li、Na、K、Rb 的金属性依次增强6:某元素的气态氢化物化学式为H2R,此元素最高价氧化物对应水化物的化学式可能为 ( )
A.H2RO3 B.H2RO4
C.HRO3 D.H3RO4ACB8.下列性质的递变中,正确的是 ( )
A.O、S、Na的原子半径依次增大
B.LiOH、KOH、CsOH的碱性依次增强
C.HF、NH3、SiH4的稳定性依次增强
D.HCl、HBr、HI的还原性依次减弱AB 7:第114号元素是化学家和物理学家很感兴趣的元素,试推测此元素在周期表中的位置 ( )
A.第八周期ⅢA族 B.第六周期ⅤA族
C.第七周期ⅣB族 D.第七周期ⅣA族 D9.某元素X的原子序数为52,下列叙述正确的是 ( )
A.X的主要化合价是-2、+4、+6
B.X可以形成稳定的气态氢化物
C.X的最高价氧化物对应水化物的酸性
比HBrO4的酸性强
D.X原子的还原性比碘原子强AD 10.已知铍(Be)的原子序数为4。下列对铍及其化合物的叙述中,正确的是 ( )
A.铍的原子半径大于硼的原子半径
B.氯化铍化学式中铍原子的最外层电子
数是8
C.氢氧化铍的碱性比氢氧化钙的弱
D.单质铍跟冷水反应产生氢气 AC 【课时作业】 参考答案(课时1)
题号1 2 3 4 5 6 7 8 9 10 11 12
答案A A A AD B A C A B D D B
13、该元素为磷元素
14、Be
15、(1)O Ca Na Cl (2)略
16、(1)A:碳、C B:硅、Si C:氯、Cl
(2)A: B: C:
17、磷;P;【课时作业】 参考答案(课时2)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
答案AB AD A C B C B A D B C D A B D B
17、18、
19、(1)A:氢 B:氧 C:氟 D:钠
( 2) ;
(3)H<F<O<Na
(4)
(5)
20、(1)A:氧 B:氮 (2)m=3,n=2 (3) 【课时作业】 参考答案(课时3)
题号 1 2 3 4 5 6 7 8 9 10
答案AB AD AC C B B C D AB AD
11、(1)、、;HCl、、、
12、(1)+5(2)7
13、(1)HCl,弱 (2)N,
(3)H、O、S
(4)Be(OH)2+2NaOH===Na2BeO2+2H2O, Li
14、X原子序数为19,原子量为39;Y原子序数为11,原子量为23;Z原子序数为16,原子量为32再见!
1H:原子序数最小,原子半径最小;没有中子;
外层电子数=周期数;电子总数=电子层数;气体密度最小。
6C:最外层电子数是次外层的两倍;单质硬度最大的,熔沸点最高的,形成化合物品种最多的,正负化合价代数和为零,气态氢化物中含H质量分数最高的是CH4。
7N:最外层电子数比次外层多3个;空气含量最多的元素;氧化物形式最多(6种)的元素;气态氢化物溶解度最大,且其水溶液唯一呈碱性的元素
8O:最外层电子数是次外层的3倍;地壳中含量最多的元素【知识整理】9F:除H元素外,在短周期元素中原子半径最小;只有负价而无正价;不能被任何物质氧化;无含氧酸;气态氢化物最稳定;能置换出水中的O的元素是F。
11Na:短周期元素中原子半径最大,焰色反应显黄色的元素是Na。
12Mg:最外层电子数=最内层电子数,次外层电子数是最外层电子数的4倍的元素是Mg。
13Al:最外层比次外层少5个电子;
最外层电子数=电子层数;形成的氧化物和氢氧化物能溶于酸也能溶于碱;地壳中含量最多的金属元素是Al。【知识整理】14Si:最外层电子数是次外层的一半,是最内层的两倍;其最高价氧化物对应水化物不溶于水的元素是Si。
15P:最外层比次外层少3个电子;能形成键角为60 0正四面体型单质P4的元素是P。
16S:最外层比次外层少2个电子;
次外层电子数=最外层与最内层电子数之和;
黄色粉末状单质,易溶于CS2;
气态氢化物具有臭鸡蛋气味。
17Cl:最外层比次外层少1个电子,比最内层多5个电子,单质为黄绿色气体,其水溶液有漂白性的元素是Cl。例:X和Y均为短周期元素,已知aXn-比bYm+多两个电子层,则下列说法正确的是 ( )A b < 5
B X只能位于第3周期
C a + n – b + m = 10或16
D Y 不可能位于第2周期A C第一周期第二周期第二周期第三周期a + n – b + m
=阴离子电子数 - 阳离子电子数a + n – b + m = 10 – 0 = 10a + n – b + m = 18 – 2 = 16例:在元素周期表的前4周期中,如图排列着5种元素,若B元素的核电荷数为Z,则这5种元素核电荷数之和可能是( )A 5Z+2 B 5Z
C 5Z+10 D 5Z+18BC 二
三
四Z Z - 8 Z + 8
或 Z + 18EZ - 1Z+1试比较 O2- F- Na+ Mg2+ Al3+ 的半径大小核电荷数 8 9 11 12 13电子层数 2 2 2 2 2 电子总数 10 10 10 10 10>>>> 电子排布相同的离子,离子
半径随着核电荷数的递增而减小。 总结: 【课堂练习】1、相邻三个短周期的主族元素A、B、C、D、E,它们的原子序数依次增大,B、C、D元素在同一周期,A、E在同一主族。除A外的各元素的原子的电子层内层已填满电子。其中B的最外层有4个电子。A与B,B与C都能生成气态的化合物。D与E生成离子化合物。在离子化合物中它们化合价的绝对值相等。试回答:它们各是什么元素?H、C、O、F、Na 2、 下列叙述正确的是:
A、两种微粒,若核外电子排布完全相同,则其化学性质一定相同。
B、若两原子核外电子排布相同,则一定是同一种元素。
C、阴离子的核外电子排布,一定与上一周期稀有气体元素原子电子排布相同。
D、凡单原子形成的离子,一定具有稀有气体元素的原子核外电子排布。分子、原子、离子同位素H+、 Fe2+、Fe3+B 3、请选择正确的序号:
A、质子数 B、中子数 C、核外电子数
D、最外层电子数 E、电子层数
1、原子(核素)种类由___ ____ __决定。
2、元素种类由___ ____ __决定。
3、元素有同位素由___ ____ __决定。
4、同位素原子量由___ ____ __决定。
5、原子半径由___ ____ __决定。
6、元素化合价由___ ____ __决定。
7、元素化学性质由___ ____ __决定。
8、价电子数通常是指___ ____ __。
9、核电荷数由___ ____ __决定。ABABAB A、 E、CDDDA4、元素位、构、性三者关系***处于同周期的相邻两种元素A和B,A的最高价氧化物的水化物的碱性比B弱,A处于B的 边(左或右);B的原子半径比A ;若B的最外层有2个电子,则A最外层有 个电子。
***处于同周期的相邻两种元素A和B,A的最高价氧化物的水化物的酸性比B弱,A处于B的 边(左或右);B的原子半径比A ;若B的最外层有3个电子,则A最外层有 个电子。右大3左小25:下列各组元素性质递变情况错误的是( )
A.Li、B、Be原子最外层电子数依次增多
B.P、S、Cl元素最高正化合价依次升高
C.B、C、N、O、F 原子半径依次增大
D.Li、Na、K、Rb 的金属性依次增强6:某元素的气态氢化物化学式为H2R,此元素最高价氧化物对应水化物的化学式可能为 ( )
A.H2RO3 B.H2RO4
C.HRO3 D.H3RO4ACB8.下列性质的递变中,正确的是 ( )
A.O、S、Na的原子半径依次增大
B.LiOH、KOH、CsOH的碱性依次增强
C.HF、NH3、SiH4的稳定性依次增强
D.HCl、HBr、HI的还原性依次减弱AB 7:第114号元素是化学家和物理学家很感兴趣的元素,试推测此元素在周期表中的位置 ( )
A.第八周期ⅢA族 B.第六周期ⅤA族
C.第七周期ⅣB族 D.第七周期ⅣA族 D9.某元素X的原子序数为52,下列叙述正确的是 ( )
A.X的主要化合价是-2、+4、+6
B.X可以形成稳定的气态氢化物
C.X的最高价氧化物对应水化物的酸性
比HBrO4的酸性强
D.X原子的还原性比碘原子强AD 10.已知铍(Be)的原子序数为4。下列对铍及其化合物的叙述中,正确的是 ( )
A.铍的原子半径大于硼的原子半径
B.氯化铍化学式中铍原子的最外层电子
数是8
C.氢氧化铍的碱性比氢氧化钙的弱
D.单质铍跟冷水反应产生氢气 AC 【课时作业】 参考答案(课时1)
题号1 2 3 4 5 6 7 8 9 10 11 12
答案A A A AD B A C A B D D B
13、该元素为磷元素
14、Be
15、(1)O Ca Na Cl (2)略
16、(1)A:碳、C B:硅、Si C:氯、Cl
(2)A: B: C:
17、磷;P;【课时作业】 参考答案(课时2)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
答案AB AD A C B C B A D B C D A B D B
17、18、
19、(1)A:氢 B:氧 C:氟 D:钠
( 2) ;
(3)H<F<O<Na
(4)
(5)
20、(1)A:氧 B:氮 (2)m=3,n=2 (3) 【课时作业】 参考答案(课时3)
题号 1 2 3 4 5 6 7 8 9 10
答案AB AD AC C B B C D AB AD
11、(1)、、;HCl、、、
12、(1)+5(2)7
13、(1)HCl,弱 (2)N,
(3)H、O、S
(4)Be(OH)2+2NaOH===Na2BeO2+2H2O, Li
14、X原子序数为19,原子量为39;Y原子序数为11,原子量为23;Z原子序数为16,原子量为32再见!
