元素周期表(第二课时)[下学期]
文档属性
| 名称 | 元素周期表(第二课时)[下学期] |

|
|
| 格式 | rar | ||
| 文件大小 | 771.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-03-15 00:00:00 | ||
图片预览







文档简介
课件27张PPT。第一章 第一节元素周期表元素周期表(二)一、教学目的
1、了解碱金属和卤素的物理性质和化学性质,并用原子结构理论来解释它们性质的差异和递变规律,为今后学周期律打基础。
2、对学生进行科学方法的训练及辩证唯物主义观点的教育。
复习:一、_______周期是短周期,分别包含
元素的种类数是___、___ 、 ____。二、_____ _ _ _ _周期是长周期,分别包
含元素的种类数是___、___ 、 ____ 、
___ 。1、2、32 8 84、5、6、718 18 3226复习:4、周期表中有___主族,___副族、
___ VIII族, _____零族。5、主族元素的周期序数等于
原子_ _ _ _ _ _ _ _数;6、主族序数等于原子_____ __ _ __ _数。7个7个1个电子层最外层电子 1个★思考与交流:
元素周期表为什么把Li、Na、K等元素
编在一个族呢?
它们的原子结构和性质有什么联系呢?★设计出探索方案:探索方案:理论探索(结构特点、规律)实验探索(元素性质递变规律)得出结论完成P5的表格:
讨论:碱金属元素的原子结构有什么
共同之处?相似性:碱金属元素原子最外层都
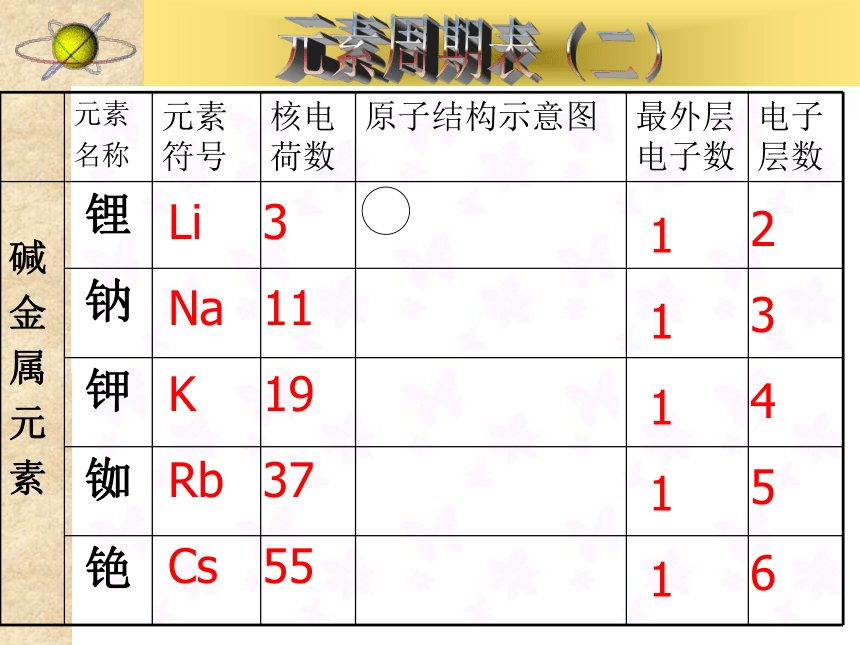
只有一个电子,一、碱金属元素Li
Na
K
Rb
Cs3
11
19
37
551
1
1
1
12
3
4
5
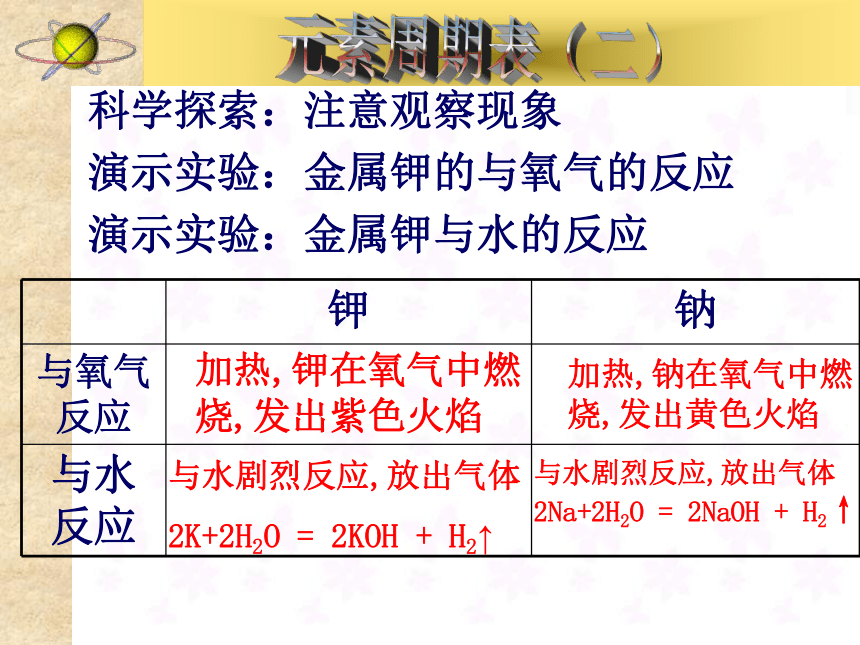
6科学探索:注意观察现象
演示实验:金属钾的与氧气的反应
演示实验:金属钾与水的反应加热,钾在氧气中燃烧,发出紫色火焰加热,钠在氧气中燃烧,发出黄色火焰与水剧烈反应,放出气体
2K+2H2O = 2KOH + H2↑与水剧烈反应,放出气体
2Na+2H2O = 2NaOH + H2↑★思考与交流:
钠和钾的性质有什么相似性和不同,
与它们的原子结构有无关系?钠和钾都能与氧气、水剧烈反应,但是
钾的反应更为剧烈。
与原子结构有密切关系:因物质结构
决定性质碱金属元素的原子结构 名称 符号 核电荷数 电子层结构 原子半径
锂 Li 3 2 1
钠 Na 11 2 8 1
钾 K 19 2 8 8 1
铷 Rb 37 2 8 18 8 1
铯 Cs 55 2 8 18 18 8 1
逐渐增大 碱金属元素的原子结构规律:碱金属元素原子最外层都只有一个电子,随着核电荷数增多,电子层数逐渐增多,原子半径逐渐增大。
2、递变性:随着核电荷数增加,碱金属电子层数增多,原子半径逐渐增大, 原子核对最外层电子的吸引力逐渐减弱,失去最外层电子的能力逐渐增强。从锂到铯金属性逐渐增强。 P7推论
1、相似性:碱金属元素原子最外层都只有一个电子,它们的化学性质相似; P6 碱金属元素单质的物理性质。 名称 符号 核电荷数 颜色状态 密度 熔点 沸点锂 钠 钾 铷 铯 Li 3 Na 11K 19Rb 37Cs 55逐渐增大 逐渐降低逐渐降低是否有特殊?银
白
色、
柔
软略带金色1、碱金属元素单质的物理性质 规律:随着碱金属核电荷数的增加,
密度呈增大趋势,熔点和沸点逐渐降低。
分析卤族元素的原子结构,试推测一
下F、Cl、Br、I在化学性质上表现的
相似性和递变性?二、卤族元素思考与交流:找出卤族元素在元素周期表中的位置卤族元素: 氟(F)氯(Cl)溴(Br)碘(I)砹(At)Cl递 变 性逐渐增大逐渐增多逐渐增大最外层7个电子结构上的相同 性质上的相似决定(最外层均为7个电子)(1)都能与金属反应生成金属卤化物
(2)都能与氢气反应生成卤化氢(HX)
(3)都能与水反应
(4)都能与碱反应(回忆氯气的性质)1、卤素单质的物理性质 密度逐渐增大熔点逐渐升高沸点逐渐升高颜色逐渐加深溶解度 减少2、卤素单质与氢气反应H2+F2=2HF暗处反应爆炸;HF很稳定H2+Cl2=2HClH2+Br2=2HBr光照或点燃;HCl较稳定加热500℃ ,HBr不稳定 需不断加热,HI同时分解F2 Cl2 Br2 I2剧烈程度: 生成氢化物的稳定性:逐渐减弱逐渐减弱3、卤素单质间的化学性质演示实验: P9 实验1-1溶液由无色
变为橙色2NaBr+Cl2=
Br2+2NaCl溶液由无色
变为深黄色2KI+ Cl2=
I2+2KClCCl4层
为紫色2KI+ Br2 =
I2+2KBr2NaCl+Br22、卤素单质间的化学性质以上实验说明卤族元素的什么性质?卤族元素的性质递变性!2NaCl+I22NaBr+I2课堂小结
从卤素原子结构的相似性去认识卤素单质性质的相似性。
2 .从卤素原子结构的递变规律(原子半径
增大)去认识卤素单质性质的递变规律。
3、注意养成严谨的科学态度和对科学不断钻研的精神。 1、同主族:元素金属性、非金属性的递变Li
Na
K
Rb
Cs
Fr
F
Cl
Br
I
At
IAⅦA金属性增强非金属性减弱原因:同一主族的元素中,各元素的最外层电子数相同,由于从上到下电子层数 增多,原子半径增大,原子核对外层电子的引力减弱,失电子能力逐渐增强,得 电子能力逐渐减弱
P9思考与交流同主族元素从上到下,随着原子序数增加:
原子核外电子层数
原子得、失电子能力
元素的金属性逐渐
元素的非金属性逐渐
增加金属原子失电子能力增强非金属原子得电子能力减弱增强减弱
1、了解碱金属和卤素的物理性质和化学性质,并用原子结构理论来解释它们性质的差异和递变规律,为今后学周期律打基础。
2、对学生进行科学方法的训练及辩证唯物主义观点的教育。
复习:一、_______周期是短周期,分别包含
元素的种类数是___、___ 、 ____。二、_____ _ _ _ _周期是长周期,分别包
含元素的种类数是___、___ 、 ____ 、
___ 。1、2、32 8 84、5、6、718 18 3226复习:4、周期表中有___主族,___副族、
___ VIII族, _____零族。5、主族元素的周期序数等于
原子_ _ _ _ _ _ _ _数;6、主族序数等于原子_____ __ _ __ _数。7个7个1个电子层最外层电子 1个★思考与交流:
元素周期表为什么把Li、Na、K等元素
编在一个族呢?
它们的原子结构和性质有什么联系呢?★设计出探索方案:探索方案:理论探索(结构特点、规律)实验探索(元素性质递变规律)得出结论完成P5的表格:
讨论:碱金属元素的原子结构有什么
共同之处?相似性:碱金属元素原子最外层都
只有一个电子,一、碱金属元素Li
Na
K
Rb
Cs3
11
19
37
551
1
1
1
12
3
4
5
6科学探索:注意观察现象
演示实验:金属钾的与氧气的反应
演示实验:金属钾与水的反应加热,钾在氧气中燃烧,发出紫色火焰加热,钠在氧气中燃烧,发出黄色火焰与水剧烈反应,放出气体
2K+2H2O = 2KOH + H2↑与水剧烈反应,放出气体
2Na+2H2O = 2NaOH + H2↑★思考与交流:
钠和钾的性质有什么相似性和不同,
与它们的原子结构有无关系?钠和钾都能与氧气、水剧烈反应,但是
钾的反应更为剧烈。
与原子结构有密切关系:因物质结构
决定性质碱金属元素的原子结构 名称 符号 核电荷数 电子层结构 原子半径
锂 Li 3 2 1
钠 Na 11 2 8 1
钾 K 19 2 8 8 1
铷 Rb 37 2 8 18 8 1
铯 Cs 55 2 8 18 18 8 1
逐渐增大 碱金属元素的原子结构规律:碱金属元素原子最外层都只有一个电子,随着核电荷数增多,电子层数逐渐增多,原子半径逐渐增大。
2、递变性:随着核电荷数增加,碱金属电子层数增多,原子半径逐渐增大, 原子核对最外层电子的吸引力逐渐减弱,失去最外层电子的能力逐渐增强。从锂到铯金属性逐渐增强。 P7推论
1、相似性:碱金属元素原子最外层都只有一个电子,它们的化学性质相似; P6 碱金属元素单质的物理性质。 名称 符号 核电荷数 颜色状态 密度 熔点 沸点锂 钠 钾 铷 铯 Li 3 Na 11K 19Rb 37Cs 55逐渐增大 逐渐降低逐渐降低是否有特殊?银
白
色、
柔
软略带金色1、碱金属元素单质的物理性质 规律:随着碱金属核电荷数的增加,
密度呈增大趋势,熔点和沸点逐渐降低。
分析卤族元素的原子结构,试推测一
下F、Cl、Br、I在化学性质上表现的
相似性和递变性?二、卤族元素思考与交流:找出卤族元素在元素周期表中的位置卤族元素: 氟(F)氯(Cl)溴(Br)碘(I)砹(At)Cl递 变 性逐渐增大逐渐增多逐渐增大最外层7个电子结构上的相同 性质上的相似决定(最外层均为7个电子)(1)都能与金属反应生成金属卤化物
(2)都能与氢气反应生成卤化氢(HX)
(3)都能与水反应
(4)都能与碱反应(回忆氯气的性质)1、卤素单质的物理性质 密度逐渐增大熔点逐渐升高沸点逐渐升高颜色逐渐加深溶解度 减少2、卤素单质与氢气反应H2+F2=2HF暗处反应爆炸;HF很稳定H2+Cl2=2HClH2+Br2=2HBr光照或点燃;HCl较稳定加热500℃ ,HBr不稳定 需不断加热,HI同时分解F2 Cl2 Br2 I2剧烈程度: 生成氢化物的稳定性:逐渐减弱逐渐减弱3、卤素单质间的化学性质演示实验: P9 实验1-1溶液由无色
变为橙色2NaBr+Cl2=
Br2+2NaCl溶液由无色
变为深黄色2KI+ Cl2=
I2+2KClCCl4层
为紫色2KI+ Br2 =
I2+2KBr2NaCl+Br22、卤素单质间的化学性质以上实验说明卤族元素的什么性质?卤族元素的性质递变性!2NaCl+I22NaBr+I2课堂小结
从卤素原子结构的相似性去认识卤素单质性质的相似性。
2 .从卤素原子结构的递变规律(原子半径
增大)去认识卤素单质性质的递变规律。
3、注意养成严谨的科学态度和对科学不断钻研的精神。 1、同主族:元素金属性、非金属性的递变Li
Na
K
Rb
Cs
Fr
F
Cl
Br
I
At
IAⅦA金属性增强非金属性减弱原因:同一主族的元素中,各元素的最外层电子数相同,由于从上到下电子层数 增多,原子半径增大,原子核对外层电子的引力减弱,失电子能力逐渐增强,得 电子能力逐渐减弱
P9思考与交流同主族元素从上到下,随着原子序数增加:
原子核外电子层数
原子得、失电子能力
元素的金属性逐渐
元素的非金属性逐渐
增加金属原子失电子能力增强非金属原子得电子能力减弱增强减弱
