必修二第一章第二节元素周期律第2课时[下学期]
文档属性
| 名称 | 必修二第一章第二节元素周期律第2课时[下学期] |  | |
| 格式 | rar | ||
| 文件大小 | 423.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-03-15 16:15:00 | ||
图片预览



文档简介
课件18张PPT。
元素周期律
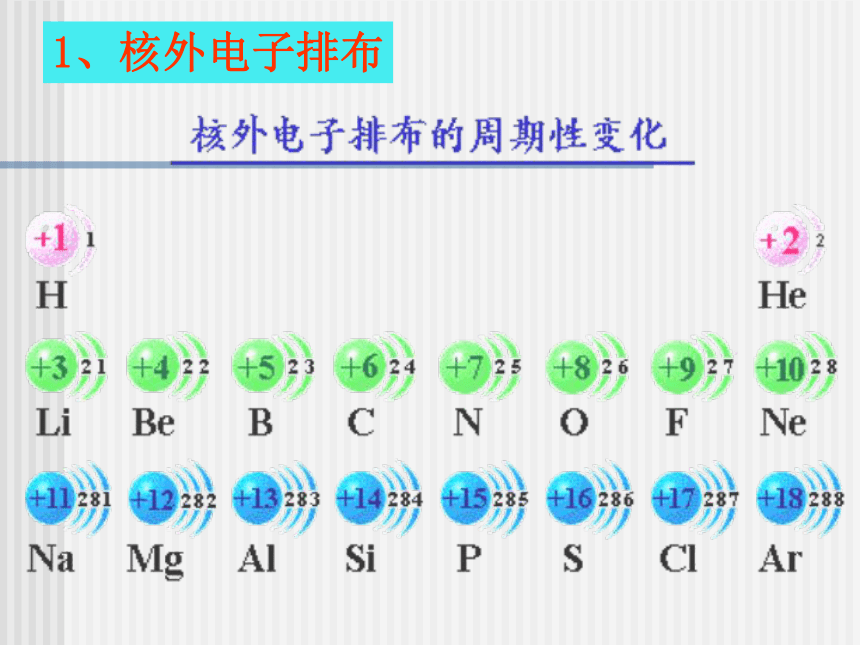
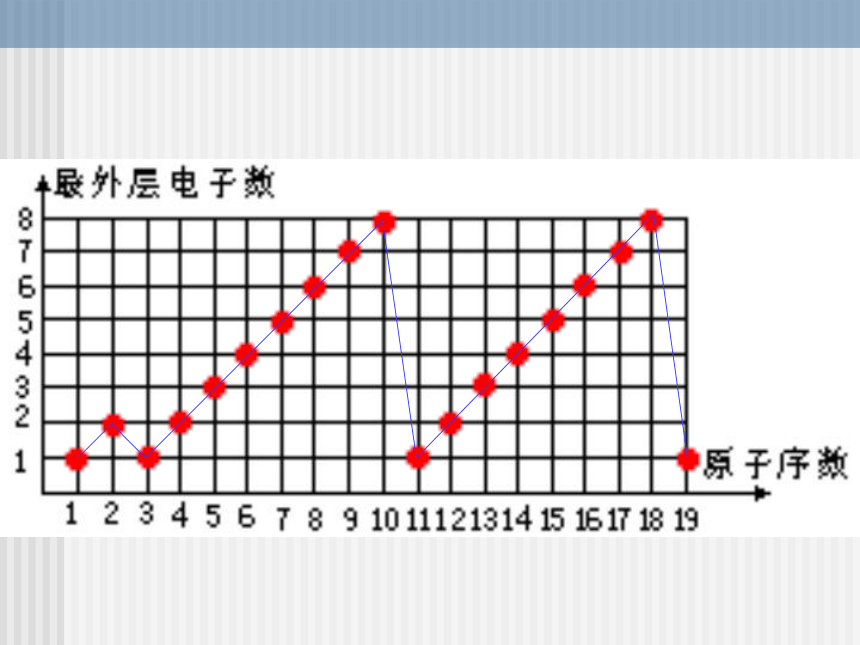
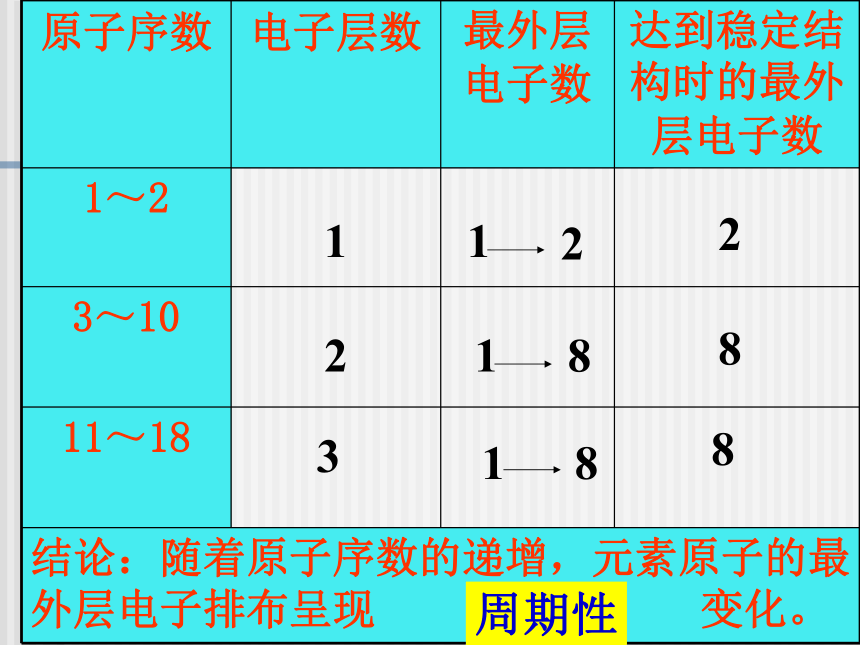
第二课时1、核外电子排布123882周期性2、原子半径结论:
1.同周期元素,随着原子序数的递增,元素原子半径逐渐减小。
2.同主族元素,随着原子序数的递增,元素原子半径逐渐增大。
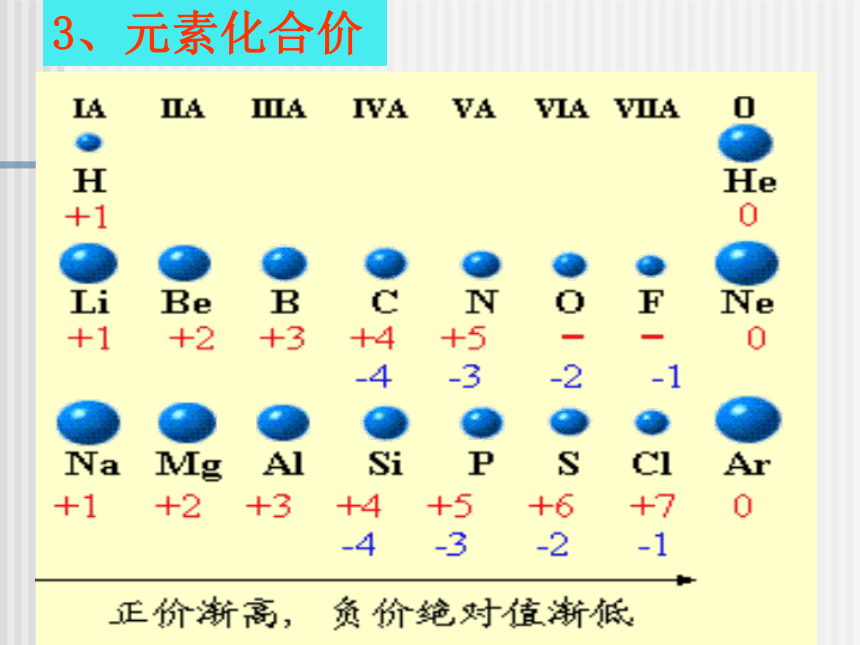
3、元素化合价周期性回顾:
有哪些事实可以作为比较元素的金属性和元素的非金属性强弱的依据?
判断依据跟冷水剧
烈反应NaOH强碱跟沸水反应
放H2;跟酸
剧烈反应放
H2Mg(OH)2
中强碱跟酸较为
迅速反应
放H2Al(OH)3
两性氢氧化物结论:金属性 Na>Mg>Al第三周期(11~18号)元素性质的变化中得出如下的结论:元素的金属性和非金属性递变小结非金属性逐渐增强金属性逐渐增强金属性逐渐增强非金属性逐渐增强元素的性质随着元素原子序数的递增而呈周期性的变化。这个规律叫做元素周期律。元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。练习: 下列递变情况 的是:
A. Na、Mg、Al最外层电子数依次增多,其单质的还原性依次减弱
B. P、S、Cl最高正价依次升高,对应气态氢化 物稳定性增强
C. C、N、O原子半径依次增大
D. Na、K、Rb氧化物的水化物碱性依次增强不正确 C 同一横行X、Y、Z三种元素,已知最高价氧化物对应的水化物的酸性是 HXO4 > H2YO4 > H3ZO4,则下列说法判断 的是
A. 阴离子半径 X > Y > Z
B. 气态氢化物稳定性 HX > H2Y > ZH3
C. 元素的非金属性 X > Y > Z
D. 单质的氧化性 X > Y > Z错误 有V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且均小于20,其中X、Z是金属元素,V和Z元素原子的最外层都只有一个电子,W和Y元素原子的最外层电子数相等,且W元素原子L层电子数是K层电子数的3倍,X元素原子的最外层电子数是Y元素原子最外层电子数的一半。由此可推知(填元素符号):
V是____W是____X是_____Y是____Z是_____答案:H、O、Al、S、K
元素周期律
第二课时1、核外电子排布123882周期性2、原子半径结论:
1.同周期元素,随着原子序数的递增,元素原子半径逐渐减小。
2.同主族元素,随着原子序数的递增,元素原子半径逐渐增大。
3、元素化合价周期性回顾:
有哪些事实可以作为比较元素的金属性和元素的非金属性强弱的依据?
判断依据跟冷水剧
烈反应NaOH强碱跟沸水反应
放H2;跟酸
剧烈反应放
H2Mg(OH)2
中强碱跟酸较为
迅速反应
放H2Al(OH)3
两性氢氧化物结论:金属性 Na>Mg>Al第三周期(11~18号)元素性质的变化中得出如下的结论:元素的金属性和非金属性递变小结非金属性逐渐增强金属性逐渐增强金属性逐渐增强非金属性逐渐增强元素的性质随着元素原子序数的递增而呈周期性的变化。这个规律叫做元素周期律。元素性质的周期性变化是元素原子的核外电子排布的周期性变化的必然结果。练习: 下列递变情况 的是:
A. Na、Mg、Al最外层电子数依次增多,其单质的还原性依次减弱
B. P、S、Cl最高正价依次升高,对应气态氢化 物稳定性增强
C. C、N、O原子半径依次增大
D. Na、K、Rb氧化物的水化物碱性依次增强不正确 C 同一横行X、Y、Z三种元素,已知最高价氧化物对应的水化物的酸性是 HXO4 > H2YO4 > H3ZO4,则下列说法判断 的是
A. 阴离子半径 X > Y > Z
B. 气态氢化物稳定性 HX > H2Y > ZH3
C. 元素的非金属性 X > Y > Z
D. 单质的氧化性 X > Y > Z错误 有V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且均小于20,其中X、Z是金属元素,V和Z元素原子的最外层都只有一个电子,W和Y元素原子的最外层电子数相等,且W元素原子L层电子数是K层电子数的3倍,X元素原子的最外层电子数是Y元素原子最外层电子数的一半。由此可推知(填元素符号):
V是____W是____X是_____Y是____Z是_____答案:H、O、Al、S、K
